王强珍
复旦大学附属妇产科医院妇科,上海 200090
宫颈癌是女性第二大恶性肿瘤,仅次于乳腺癌,其发病率逐年升高,其中约半数患者发生死亡,对妇女的健康和生存构成严重威胁。由于宫颈癌缺乏特异性标记物,早期诊断和预后评估指标仍然是学者们研究的热点。近年来,血清学标记物逐渐被学者们认可,其具有可重复、快速、便捷和无创等优点,已引起学者们的广泛重视[1]。三叶因子3(TFF3)是三叶草结构的多肽家族,在膀胱癌和胃癌等恶性肿瘤中呈高表达,具有促进肿瘤侵袭和抗凋亡的作用[2-3],现已经在宫颈癌细胞和组织标本中证实TFF3呈高表达,参与宫颈癌的发生和发展[4]。同种异体移植物炎性因子-1(AIF-1)是一种与细胞免疫调控密切相关的细胞因子,起初用于免疫方面的监测,后来发现在宫颈癌中呈高表达,并且发现与宫颈癌的淋巴结转移有关[5]。S100 钙结合蛋白-A11(S100-A11)是血清标记物蛋白家族的重要成员,在宫颈癌中表达上调,与宫颈癌的侵袭、转移和增殖有密切联系[6]。本研究对宫颈癌患者血清TFF3、AIF-1和S100-A11水平进行检测,并观察其在宫颈癌诊断和预后评估中的临床价值,现报道如下。
1 资料与方法
1.1一般资料 选取2019年1月至2020年6月在本院确诊的128例宫颈癌患者作为宫颈癌组,年龄25~59岁,平均(39.72±8.27)岁;病理分化:高中分化82例,低分化46例;病理类型:腺癌47例,鳞癌81例;人乳头瘤病毒(HPV):阳性102例,阴性26例;临床分期:Ⅰa期7例,Ⅰb期56例,Ⅱa期33例,Ⅱb期32例。选取同期在本院确诊的75例宫颈上皮内瘤变(CIN)患者作为CIN组,年龄26~59岁,平均(39.17±9.27)岁。选取同期在本院行健康体检的45例女性作为健康对照组,年龄30~59岁,平均(38.92±8.19)岁。所有受试者均知情同意并签署知情同意书,本研究经本院伦理委员会审核通过。纳入标准:(1)宫颈癌和 CIN均经病理检查证实;(2)年龄25~59岁;(3)入组前未经放疗、化疗和免疫治疗。排除标准:(1)其他系统恶性肿瘤;(2)女性生殖系统其他疾病;(3)孕妇和哺乳期妇女;(4)血液性和免疫性疾病;(5)心、肝、肾等重要脏器功能不全;(6)智力下降和精神疾病。
1.2方法
1.2.1治疗方法 对于Ⅰa期宫颈癌患者行次广泛子宫切除术,对于Ⅰb~Ⅱb期宫颈癌患者行广泛性子宫切除术和相关淋巴结清扫术。对于Ⅰb~Ⅱb期宫颈癌患者宫颈肿瘤最大径>4 cm,术前常规局部插植放疗(每周一次,共2次),并行新辅助化疗1次,放疗结束后2周再行手术治疗。对于术后病理检查发现肿瘤侵及宫颈肌层浸润深度≥1/2、切缘有肿瘤累及、盆腔淋巴结有转移和累及脉管者术后均补充放疗和化疗治疗。
1.2.2血液标本保存和指标检测 各组受试者入组时抽取空腹肘静脉血5 mL,放置在抗凝管中,以3 000 r/min离心10 min,将上清液放置在-70 ℃冰箱中用于检测血清TFF3、AIF-1和S100-A11水平。采用酶联免疫吸附试验检测血清TFF3、AIF-1和S100-A11水平,试剂盒购于上海联迈生物工程有限公司。
1.3观察指标 观察各组血清TFF3、AIF-1和S100-A11水平变化情况,以及血清TFF3、AIF-1和S100-A11水平在宫颈癌辅助诊断中的效能。
2 结 果
2.1健康对照组、CIN组和宫颈癌组血清TFF3、AIF-1和S100-A11水平比较 宫颈癌组血清TFF3、AIF-1和S100-A11水平均明显高于CIN组和健康对照组,CIN组血清TFF3、AIF-1和S100-A11水平均明显高于健康对照组,差异均有统计学意义(P<0.05)。见表1。

表1 健康对照组、CIN组和宫颈癌组血清TFF3、AIF-1和S100-A11水平比较
2.2血清TFF3、AIF-1和S100-A11水平在宫颈癌中的诊断效能 以CIN为对照,根据是否发生宫颈癌将3项指标进行多因素Logistic回归分析得Y=0.27×XTFF3+0.02×XAIF-1+0.03×XS100-A11-26.06为联合检测指标,3项指标联合检测的灵敏度为89.1%,特异度为97.3%,曲线下面积(AUC)为0.968,明显高于TFF3(Z=4.627,P<0.05)、AIF-1(Z=4.164,P<0.05)和S100-A11(Z=5.217,P<0.05)单独检测。见表2、图1。
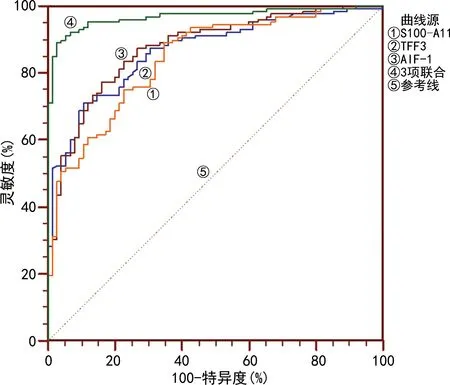
图1 血清TFF3、AIF-1和S100-A11水平诊断宫颈癌的ROC曲线
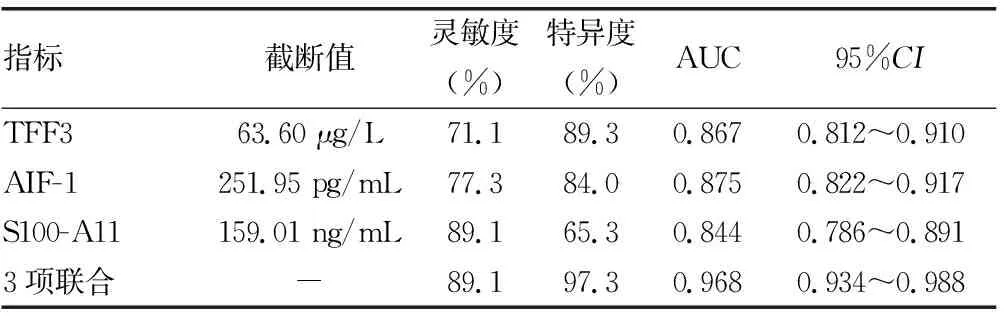
表2 血清TFF3、AIF-1和S100-A11水平在宫颈癌中的诊断效能
2.3不同临床指标患者血清TFF3、AIF-1和S100-A11水平比较 低分化、HPV阳性、临床分期为Ⅱ期和有淋巴结转移宫颈癌患者血清TFF3、AIF-1和S100-A11水平均明显高于高中分化、HPV阴性、临床分期为Ⅰ期和无淋巴结转移宫颈癌患者,差异均有统计学意义(P<0.05);而不同年龄、病理类型、肿瘤最大径、浸润肌层深度、脉管浸润和神经浸润宫颈癌患者血清TFF3、AIF-1和S100-A11水平比较,差异均无统计学意义(P>0.05)。见表3。

表3 不同临床指标宫颈癌患者血清TFF3、AIF-1和S100-A11水平比较

续表3 不同临床指标宫颈癌患者血清TFF3、AIF-1和S100-A11水平比较
2.4死亡组和存活组血清TFF3、AIF-1和S100-A11水平比较 所有患者均随访1年,按最终结局分为死亡组(40例)和存活组(88例)。死亡组患者血清TFF3、AIF-1和S100-A11水平均明显高于存活组,差异均有统计学意义(P<0.05),见表4。

表4 死亡组和存活组血清TFF3、AIF-1和S100-A11 水平比较
3 讨 论
宫颈癌位居女性恶性肿瘤的第2位,常规手术治疗和放化疗具有其局限性,其5年生存率仍较低,一旦发生预后较差。随着宫颈癌筛查的普及和HPV疫苗的使用,宫颈癌的发病率和病死率明显降低,但宫颈癌发病率和病死率仍呈逐年上升和年轻化趋势。因此,早期诊断和治疗宫颈癌是降低病死率的关键。肿瘤标记物水平在恶性肿瘤中可以出现明显升高,持续监测有助于对良恶性肿瘤的鉴别,而传统的肿瘤标记物,如糖类抗原125、癌胚抗原和细胞角蛋白 19 片段等在宫颈癌中的诊断缺乏特异性和灵敏性,因此,寻找特异性强和灵敏度高的肿瘤指标成为学者们关注的热点。
TFF3是三叶草家族的成员之一,是由杯状细胞分泌的新型肠肽,位于肠道黏膜的表面,具有抗酸、抗热和抗蛋白酶消化的作用,发生胃肠道溃疡时出现TFF3水平升高,是胃肠道黏膜的保护因子[7]。而TFF3在恶性肿瘤中同样出现明显表达,具有类似癌基因一样的作用,主要表现为TFF3在肿瘤的发生和发展中具有促进作用,对肿瘤细胞的黏附具有抑制作用,促进肿瘤细胞浸润和侵袭,对细胞凋亡具有明显抑制作用,从而促进癌细胞转移和扩散[8]。本研究结果显示,宫颈癌组血清TFF3水平明显高于CIN组和健康对照组,并且发现血清TFF3截断值为63.60 μg/L时,诊断宫颈癌的灵敏度为71.1%,特异度为89.3%,AUC为0.867,说明TFF3在诊断宫颈癌方面具有较高的辅助诊断效能,与血清TFF3水平对非小细胞肺癌的诊断具有一定价值的结果一致[9]。有研究显示,宫颈癌细胞TFF3水平明显增高,而通过上调宫颈癌细胞的TFF3表达能够明显促进细胞增殖、迁移和抑制细胞凋亡[10]。本研究结果显示,低分化、HPV阳性、临床分期为Ⅱ期和有淋巴结转移宫颈癌患者血清TFF3水平均明显高于高中分化、HPV阴性、临床分期为Ⅰ期和无淋巴结转移宫颈癌患者,并且随访1年内死亡组血清TFF3水平明显高于存活组,说明血清TFF3是宫颈癌的预后评估指标。在一项研究中显示,胃癌组织TFF3表达水平越高,提示患者预后越差[11],说明TFF3是多种肿瘤的预后评估指标。
AIF-1是最早在移植物中发现的一种新型炎症介质,主要来源于单核-巨噬细胞,具有参与机体免疫应答的作用。有研究证实,AIF-1与肿瘤有密切关系,参与免疫反应调节,促进细胞迁移,增强细胞的增殖能力,调控细胞周期,对血管形成具有促进作用,参与了肿瘤的微环境形成[12]。本研究结果显示,宫颈癌组血清AIF-1水平明显高于CIN组和健康对照组,并且发现AIF-1水平截断值为251.95 pg/mL时,诊断宫颈癌的灵敏度为77.3%,特异度为84.0%,AUC为0.875,说明血清AIF-1在诊断宫颈癌方面具有较高的辅助诊断效能。AIF-1在乳腺导管上皮细胞癌出现大量表达,AIF-1促进肿瘤细胞的增殖和迁移[13]。AIF-1通过与ADAM28m相互作用并激活下游信号通路参与乳腺癌的发生和发展,是乳腺癌预防和治疗的新靶点[14]。本研究结果显示,低分化、HPV阳性、临床分期为Ⅱ期和有淋巴结转移宫颈癌患者血清AIF-1水平均明显高于高中分化、HPV阴性、临床分期为Ⅰ期和无淋巴结转移宫颈癌患者,并且随访1年内死亡组血清AIF-1水平明显高于存活组,说明血清AIF-1是宫颈癌的预后评估指标。有研究报道显示,AIF-1以肿瘤坏死因子(TNF)-α上调的方式增强乳腺癌细胞的迁移,通过激活p38 MAPK信号通路上调乳腺癌细胞中的TNF-α水平[15],由此认为AIF-1是调控肿瘤转移方面的潜在靶标。
S100-A11是S100家族的成员之一,主要在血管内皮和平滑肌细胞中表达,其表达水平升高能够导致肿瘤细胞内钙离子异常调控,增加钙离子癌细胞内转录因子上调,增加癌细胞的增殖和转录活性[16]。本研究结果显示,宫颈癌组血清S100-A11水平明显高于CIN组和健康对照组,并且发现血清S100-A11截断值为159.01 ng/mL时,诊断宫颈癌的灵敏度为89.1%,特异度为65.3%,AUC为0.844,说明血清S100-A11在诊断宫颈癌方面具有较高的辅助诊断效能,与文献[17]报道的血清S100-A11水平对胰腺癌具有较高的诊断效能的结果一致。本研究结果显示,低分化、HPV阳性、临床分期为Ⅱ期和有淋巴结转移宫颈癌患者血清S100-A11水平均明显高于高中分化、HPV阴性、临床分期为Ⅰ期和无淋巴结转移宫颈癌患者,并且随访1年内死亡组血清S100-A11水平明显高于存活组,说明血清S100-A11是宫颈癌的预后评估指标。在一项对非小细胞肺癌的研究发现,S100-A11蛋白的表达与肿瘤的生物学行为有关,其参与了肿瘤的发生和发展,S100-A11有望成为非小细胞肺癌诊断和预后的评估指标[18]。本研究结果显示,联合检测TFF3、AIF-1和S100-A11对宫颈癌具有更高的诊断效能,明显高于单项指标,说明3项指标之间存在某种互补性,其确切的内在联系需要进一步研究。当然本研究也有不足之处:病例数较少,需要在今后的研究中进一步扩大病例,减少偏倚发生;同时,在今后随访中应在不同随访阶段增加上述指标的检测,以便动态观察宫颈癌患者TFF3、AIF-1和S100-A11水平的变化情况。
综上所述,血清TFF3、AIF-1和S100-A11水平在宫颈癌的诊断和预后评估中具有较高的临床价值,联合检测有助于提高宫颈癌的辅助诊断效能。



