李永涛 ,费洪新 ,沈 雷 ,姜 杨 ,郭志鸿 ,高 磊 ,石小芳 ,刘文华
(1.齐齐哈尔医学院,黑龙江齐齐哈尔 161000;2.中国科学院寒区旱区环境与工程研究所,甘肃兰州 730070)
白藜芦醇(resveratrol,Res)是广泛存在于葡萄、花生和多种传统中药中的一种多酚类化合物,具有降血脂、抗感染、抗氧化、抑制肿瘤细胞增殖、转移和促进凋亡等生物学功能,是近年中西医结合领域的一个研究热点[1-3]。本实验选用18月龄的衰老雌性昆明小鼠,观察白藜芦醇对肝细胞凋亡相关蛋白Bcl-2、Bax表达以及血清中SOD活力和MDA含量的影响,探讨延缓肝细胞衰老的途径和作用机制,为临床肝硬化、肝癌的预防和治疗提供理论依据。
1 材料与方法
1.1 实验动物
选用18月龄的自然衰老雌性昆明小鼠为实验组,体重(40±2) g;4 月龄青年雌性昆明小鼠为青年对照组,体重(18±1) g,均由哈尔滨医科大学实验动物中心黄小义博士提供。将昆明小鼠做阴道细胞涂片,连续检查2个动情周期,无规律性周期变化者确定为自然衰老昆明小鼠,随机分为四组,分别为衰老对照组和白藜芦醇小、中、大剂量(40、120、180 mg/ml)组,连续腹腔注射9周,青年对照组注射等量生理盐水。
1.2 实验材料
白藜芦醇(Sigma公司)用二甲基亚砜(DMSO)配制;RPMI-1640(Gibco/BRL 公司,USA);Bcl-2 兔抗鼠多克隆抗体、Bax兔抗鼠多克隆抗体(武汉博士德生物工程有限公司);SABC(兔IgG)-POD试剂盒(武汉博士德生物工程有限公司);MTT(上海华舜生物工程有限公司)。
1.3 实验标本采集与制备
雌性昆明小鼠末次给药24 h后,实验动物眶内静脉取血,取血后昆明小鼠断头处死,迅速摘取肝细胞,一侧置于10%甲醛溶液中固定,常规石蜡包埋切片。
1.4 血清总SOD活力和MDA含量的测定
冰台上迅速取肝脏,放于Carnoy溶液固定后,制作石蜡切片,用 PBS 液(0.01 mol/L,pH 7.4)冲洗 3 次,每次 5 min。H2O2室温孵育10 min,以消除内源性过氧化物酶的活性,室温下孵育10 min,蒸馏水冲洗,PBS浸泡5 min。10%正常山羊血清(PBS稀释)封闭,室温孵育10 min。倾去上清液,勿洗,滴加1∶100比例稀释的一抗,37℃孵育1h。PBS冲洗,5min×3次。滴加第二代生物素标记过的二抗工作液,37℃或室温孵育30 min。PBS冲洗,5 min×3次。滴加第二代辣根酶标记的链霉卵白素工作液,37℃孵育 30 min。PBS冲洗,5 min×3次。显色剂(DAB)显色,使用DAB显色试剂盒,取1 ml蒸馏水,加A、B、C试剂各1滴,混匀后加至切片上,室温显色,镜下控制反应时间。自来水充分冲洗,苏木精复染,封片。治疗组除用PBS代替一抗外,其他步骤相同。昆明小鼠处死后马上剥离肝脏,加入组织裂解液(50 mmol/L,Tris-HCl缓冲液,pH 7.4,10 g/L PMSF,0.5 mol/L EDTA),制成匀浆,4℃离心 30 min,用 2.5%戊二醛固定,继续用2%四氧化锇固定,脱水、包埋、切片和染色按常规处理,观察拍照,检测SOD、MDA的活性。
1.5 肝组织中Bcl-2及Bax的测定
用免疫组织化学SABC法,Bcl-2定位于核膜、粗面内质网和线粒体膜上,Bax定位于胞质。免疫细胞化学结果判定采用组织化学评分法。阳性染色为胞质内出现棕黄色颗粒,以i代表染色深浅,根据细胞着色的强弱分为4个等级:无着色0分,淡黄色1分,棕黄色2分,棕褐色3分。该评分法可反映单个细胞是否具有阳性表达及表达强弱,更客观地评价细胞蛋白的表达情况。
1.6 统计学分析
2 结果
2.1 昆明小鼠血清SOD活力和MDA含量的变化
40、120、180 mg/ml各组白藜芦醇与衰老对照组比较,SOD水平有升高趋势,但差异无统计学意义,衰老对照组昆明小鼠SOD水平低于青年对照组(P<0.05)。衰老对照组MDA含量显着高于青年对照组,各白藜芦醇剂量组MDA含量均显着低于衰老对照组(P<0.05)。见表1。
表1 昆明小鼠血清SOD活力和MDA含量的变化()
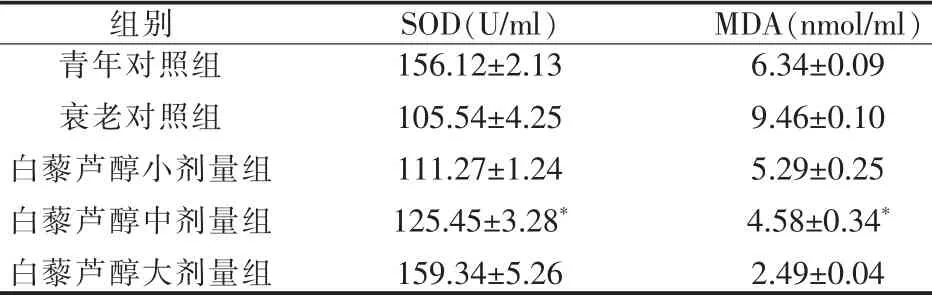
表1 昆明小鼠血清SOD活力和MDA含量的变化()
与衰老对照组比较,*P<0.05
组别 SOD(U/ml) MDA(nmol/ml)青年对照组156.12±2.136.34±0.09衰老对照组105.54±4.259.46±0.10白藜芦醇小剂量组111.27±1.245.29±0.25白藜芦醇中剂量组125.45±3.28*4.58±0.34*白藜芦醇大剂量组159.34±5.262.49±0.04
2.2 昆明小鼠肝细胞Bcl-2及Bax的表达情况(图1、2)
青年对照组中昆明小鼠肝组织肝细胞形态清晰,胞质丰富,细胞核大而圆,细胞生长旺盛(图1A);衰老对照组中可以见到肝组织中肝细胞界限不清,细胞核深染,胞质中可以见到染色深的棕黄色结构(图1B);白藜芦醇中剂量组可见肝组织Bcl-2表达量少的组织中棕黄色颗粒较少,Bax表达肝组织中棕黄色颗粒较多(图1D、图2D);提示衰老对照组Bcl-2表达降低,Bax表达升高,胞质中棕黄色的颗粒较多(图2B),Bcl-2/Bax比值明显减小,白藜芦醇剂量组Bcl-2表达有升高趋势,而Bax表达低于衰老对照组(P<0.05),各白藜芦醇剂量组之间差异有统计学意义,白藜芦醇剂量组Bcl-2/Bax比值高于衰老对照组(P<0.05),提示120 mg/ml白藜芦醇可调控凋亡相关蛋白Bcl-2、Bax的表达和对抗自由基对肝细胞的损伤。
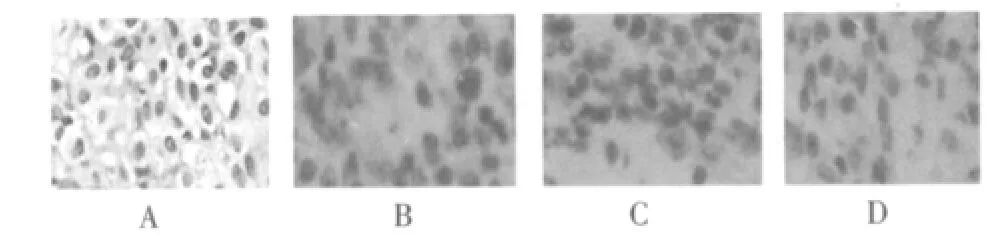
图1 昆明小鼠肝细胞Bcl-2的表达情况
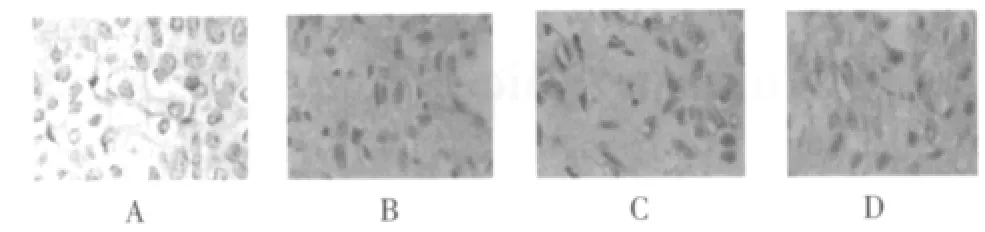
图2 昆明小鼠肝细胞Bax的表达情况
2.3 昆明小鼠肝细胞Bcl-2及Bax的表达水平 见表2。
表2 昆明小鼠肝细胞Bcl-2及Bax的表达情况()
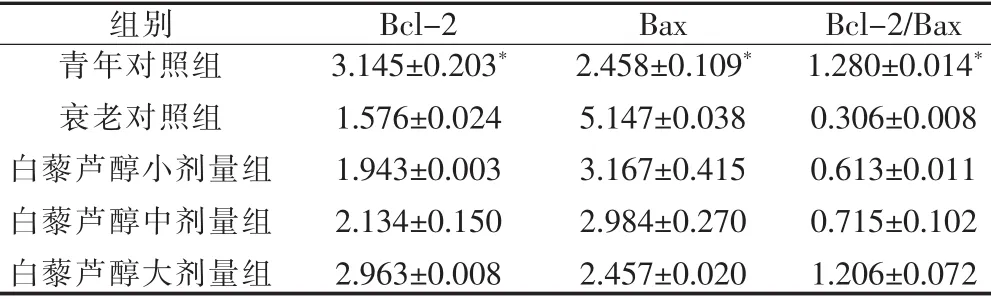
表2 昆明小鼠肝细胞Bcl-2及Bax的表达情况()
与衰老对照组比较,*P<0.05
组别 Bcl-2 Bax Bcl-2/Bax青年对照组3.145±0.203*2.458±0.109*1.280±0.014*衰老对照组1.576±0.0245.147±0.0380.306±0.008白藜芦醇小剂量组1.943±0.0033.167±0.4150.613±0.011白藜芦醇中剂量组2.134±0.1502.984±0.2700.715±0.102白藜芦醇大剂量组2.963±0.0082.457±0.0201.206±0.072
从表2中可以看出,昆明小鼠衰老后Bcl-2/Bax比值减小,昆明小鼠处于青壮年后Bcl-2/Bax比值增大,提示肝细胞的老化与Bcl-2/Bax密切相关。白藜芦醇中剂量组(120 mg/ml)作用于衰老昆明小鼠后Bcl-2/Bax升高明显,提示白藜芦醇作用于昆明小鼠肝组织后,可以改善Bcl-2/Bax,对衰老小鼠有一定的治疗作用。
3 讨论
白藜芦醇分子式为C14H12O3,分子量为228.25 D,是许多植物中存在的一种活性非黄酮类多酚化合物,呈白色针状晶体,难溶于水,能溶于乙醇、乙酸乙酯、丙酮、DMSO等极性强的溶剂中。单药应用对晚期乳腺癌、肺癌、头颈部癌、食管癌、淋巴瘤均有一定的疗效,被认为是一种广谱抗癌药物,联合其他常用抗肿瘤药物,疗效明显提高,成为最有效的抗肿瘤药之一。自1940年该成分被发现以来,一直受到医药界的重视。研究表明,白藜芦醇具有抗肿瘤、抗心血管疾病、抗氧化、抗菌、抗感染、抑制血小板聚集、调节免疫等作用,已成为科学家们高度重视的天然活性成分,具有很大的药用价值和市场前景[4-6]。
细胞是否发生凋亡与凋亡抑制因子和凋亡活化因子之间的平衡密切相关。其中重要的有凋亡抑制因子Bcl-2、Bcl-XL和凋亡活化因子Bax、Bad等。bcl-2基因及其表达蛋白可明显延长细胞的存活时间,bcl-2基因位于18q21上,约230 kb,该基因有3个外显子和2个启动子,指导Bcl-2蛋白的合成。Bcl-2蛋白是一个线粒体外膜蛋白,其C端由19个氨基酸组成疏水段,使Bcl-2蛋白可以铆钉于核膜、粗面内质网和线粒体膜上,可能在核的运输、核微孔复合物的形成和核膜的维持等方面起重要作用。bax与bcl-2基因具有40%的同源性,位于19号染色体,长约4.5 kb,有6个外显子,指导Bax蛋白的合成。Bax增高,促进细胞凋亡;Bcl-2增高,抑制细胞凋亡,Bcl-2与Bax的相互作用是其中心环节[7-8]。白藜芦醇作用于衰老昆明小鼠后Bcl-2/Bax升高明显,提示白藜芦醇作用于昆明小鼠肝组织后,可以改善Bcl-2/Bax,对衰老小鼠有一定的治疗作用。
SOD是体内最重要的抗氧化酶,可明显增加O2-的歧化反应速度,从而清除细胞内过多的氧自由基,以减少氧自由基对细胞的损伤。如果SOD活性不足,不能及时发挥抗氧化作用,细胞就会受到氧自由基的攻击,引起细胞损伤。自由基对生殖功能有很大的影响,动物实验证实,抗氧化酶活性下降,氧自由基含量增多,会导致黄体细胞凋亡,引起黄体萎缩和凋亡,引起卵泡闭锁[9-10]。MDA是脂质过氧化物的代谢产物,如果细胞内氧自由基增多,可以与细胞质膜上磷脂中的多价不饱和脂肪酸发生过氧化反应,产生过氧化物,过氧化物进一步裂解成具有细胞毒性的MDA。MDA有很强的生物活性,而且化学性质较稳定,在很低的浓度下即可明显抑制细胞内许多酶的功能,通常用MDA来反映机体脂质过氧化的程度,间接反映氧自由基对细胞的损伤程度[11-12]。实验发现,衰老对照组血清SOD活力下降,MDA含量升高,表明衰老昆明小鼠有明显的自由基损伤,给予白藜芦醇后SOD活力虽有所升高,但差异无统计学意义;MDA含量明显下降,提示白藜芦醇可能通过抑制自由基的产生或直接清除自由基等途径减少自由基对细胞的损伤。
综上所述,白藜芦醇可以通过调控凋亡相关蛋白Bcl-2、Bax的表达以及对抗自由基对细胞的损伤来抑制细胞凋亡,而对细胞起到一定的保护作用。白藜芦醇对Bcl-2、Bax蛋白的调控可能是由于白藜芦醇通过对抗自由基作用降低细胞内有毒性的MDA等脂质过氧化物的含量,恢复了细胞内相关酶的活性,进而调控Bcl-2/Bax蛋白的表达,其具体机制有待于进一步研究。
[1]Jeong SH,Lee JS,Jeong NY,et al.A novel resveratrol analogue HS-1793 treatment overcomes the resistance conferred by Bcl-2 and is associated with the formation of mature PML nuclear bodies in renal clear cell carcinoma Caki-1 cells[J].Int J Oncol,2009,35(6):1353-1360.
[2]Kurt M,Aksoy S,Cizginer S,et al.Gastric cancer and the coincidental finding of herpetic esophagitis immediately after pregnancy:a case report[J].J Reprod Med,2007,52(5):425-427.
[3]Shiraishi N,Sato K,Yasuda K,et al.Multivariate prognostic study on large gastric cancer[J].J Surg Oncol,2007,96(1):14-18.
[4]Liu HS.Studies on effects of resveratrol in inhibition growth of C6 and TJ905 glioma cell[J].Chin Tradit Herb Drugs,2005,36(11):1695-1696.
[5]Aggarwal S,Ichikawa H,Takada Y,et al.Curcumin(diferuloylmethane)down-regulates expression of cell proliferation and antiapoptotic and metastatic gene products through suppression of I kappa B alpha kinase and Akt activation[J].Mol Pharmacol,2006,69(1):195-206.
[6]Sheng L,Anl F.Research on resveratrol's effects of suppressing growth and inducing apoptosis of GBC cells[J].J Chin Med Mater,2005,28(6):489-491.
[7]Fulda S,Debatin KM.Resveratrol mediated sensitisation to TRA IL induced apoptosis depends on death receptor and mitochondrial signaling[J].Eur J Cancer,2005,41(5):786-798.
[8]Atten MJ,Godoy RE,Attar BM,et al.Resveratrol regulates cellular PKC alpha and delta to inhibit growth and induce apoptosis in gastric cancer cells[J].Invest New Drug,2005,23(2):111-119.
[9]Markovits J,Wang Z,Carr B,et al.Differential effect of two growth inhibitory K vitamin analogs on cell cycle regulating proteins in human hepatoma cells[J].Life Sci,2003,72(24):2769-2784.
[10]Oztopcu P,Kabadere S,Mercangoz A,et al.Comparison of vitamin K effecting growth of rat glioma and human glioblastoma multiforme cells in vitro[J].Acta Neurol Belg,2004,104(3):106-110.
[11]Liontas A,Yeger H.Curcumin and resveratrol induce apoptosis and nuclear translocation and activation of P53 in human neuroblastoma[J].Anticancer Res,2004,24(2B):987-998.
[12]陈东,郑勇,王东萍,等.白藜芦醇诱导MDA-MB-231细胞凋亡及其对活性氧和Caspase-3的影响[J].实用癌症杂志,2008,23(6):561-563.



