郭元元,王丽英,张 宇,张文佳,廖 璞
中国科学院大学重庆医院/重庆市人民医院检验科,重庆 400014
氯吡格雷是常用于治疗心血管疾病的抵抗血小板聚集的药物,是二磷酸腺苷(ADP)受体拮抗剂,通过抑制ADP对血小板的诱导作用产生抗凝作用。氯吡格雷对于经皮冠状动脉介入治疗(PCI)和急性冠状动脉综合征(ACS)的抗栓治疗具有极为明显的疗效,但由于患者之间存在个体差异,血小板对氯吡格雷的反应不同,对氯吡格雷缺乏反应或反应降低,称之为氯吡格雷抵抗,也称氯吡格雷无反应、氯吡格雷低反应等[1-2]。研究表明,氯吡格雷抵抗与遗传因素、吸烟、年龄、糖尿病、高血压等多种因素有关,而且对氯吡格雷反应较低的患者发生心血管不良事件的概率比反应高的患者更高[3-4]。为了进一步深入探讨氯吡格雷抵抗发生、发展的原因,本研究通过分析本院PCI术后冠心病患者的CYP2C19基因型、临床相关危险因素和主要心血管不良事件发生情况对氯吡格雷抵抗的影响,为临床治疗提供有效依据。
1 资料与方法
1.1一般资料 收集2017年1月至2018年12月本院收治并进行过基因检测的346例冠心病患者资料,分析其CYP2C19基因型和代谢型分布特征,最终筛选出251例患者做进一步分析。纳入标准:(1)经冠状动脉造影确诊为冠心病,且已行PCI术。(2)已完成人CYP2C19基因分型检测(荧光PCR法)。(3)服用标准剂量(100 mg/d)阿司匹林,服用氯吡格雷75 mg/d抗血小板治疗,持续用药至少3 d,3 d后进行血小板聚集率检查。排除标准:(1)对阿司匹林或氯吡格雷有禁忌。(2)病历资料不完善。(3)经冠状动脉造影术证实不需行PCI术。(4)患有严重肝、肾疾病或凝血功能障碍。(5)贫血[血红蛋白(Hb)水平<100 g/L],有出血史。(6)使用过西洛他唑或替格瑞洛等新型抗血小板药物。
1.2仪器与试剂 血液基因组DNA提取试剂盒(潮州凯普生物化学有限公司)、CYP2C19基因分型检测试剂盒(荧光PCR法)(苏州旷远生物分子技术有限公司);实时荧光扩增仪(7500 Real Time PCR System、7300 Plus Real-Time PCR System,美国ABI)、PL-Ⅱ血小板功能分析仪(江苏英诺华医疗技术有限公司)、高速离心机、掌式离心机、漩涡振荡器、恒温金属浴锅。
1.3方法
1.3.1血小板聚集功能试验 采用枸橼酸钠双层真空采血管采血3~5 mL,采用连续计数法进行血小板聚集功能的检测,将血液标本颠倒混匀后,检测血小板计数、平均血小板体积等参数(血小板聚集前),然后仪器自动对血液标本加入40 μL诱聚剂诱导血小板聚集,并混匀,随后继续对血液标本中的血小板计数、平均血小板体积等参数进行连续检测,最终比较血液标本加入诱聚剂前后标本中血小板参数变化,从而得到诱聚剂对血小板聚集水平影响的相关指标。
1.3.2基因组DNA的提取 血液采集和处理:采集静脉血2~3 mL加至含乙二胺四乙酸二钾(EDTA-K2)的紫色管中,不可用肝素抗凝全血,并充分摇匀,避免溶血或凝血,血液标本采集后应立即送检(如需存放可在8 ℃存放7 d以内)。按照试剂盒说明书,提取基因组DNA,未能及时检测的DNA样品于—20 ℃保存,保存时间不超过6个月。DNA水平应为10~100 ng/μL,不能低于10 ng/μL;DNA的A260/A280值必须为1.7~2.0。
1.3.3采用荧光PCR法进行CYP2C19基因分型检测 操作流程:PCR反应体系配制、设置PCR程序、上机检测、分析结果。PCR程序设置:(1)37 ℃2 min去污染;(2)95 ℃3 min预变性;(3)95 ℃30 s,56 ℃30 s,65 ℃45 s,10个扩增循环;(4)95 ℃30 s,56 ℃30 s※,65 ℃45 s,30个扩增循环,设置FAM和ROX双通道采集荧光信号,其中“※”为信号采集点;(5)25 ℃ 1 min程序结束,机器冷却至室温。按照试剂盒说明书进行结果分析,此试剂盒检测位点覆盖CYP2C19基因*1(野生型)、*2(c.681G>A)和*3(c.636G>A),不包括*17位点。
1.4氯吡格雷抵抗定义 目前,国际上对于氯吡格雷抵抗尚无统一标准,不同的研究所采用的标准大多是根据经验得来的。有人将氯吡格雷抵抗定义为ADP诱导的血小板聚集率>50%,≤50%则为氯吡格雷敏感[5],但也有研究将血小板聚集率>46%或>70%等定义为氯吡格雷抵抗[6],从本研究的方法和临床实用性考虑,本研究将临界值定为血小板最大聚集率(MAR)50%,MAR≥50%则判定为氯吡格雷抵抗。
1.5观察指标 (1)分析346例患者的CYP2C19基因型和代谢型分布特征。代谢型分为快代谢型(*1/*1)、中代谢型(*1/*2、*1/*3)、慢代谢型(*2/*2、*2/*3、*3/*3)。(2)比较最终入选的251例患者中不同CYP2C19代谢型患者的MAR。(3)将最终入选的251例患者,按照MAR进行进一步分组,MAR≥50%的患者纳入氯吡格雷抵抗组,MAR<50%的患者纳入氯吡格雷敏感组,比较氯吡格雷抵抗组与氯吡格雷敏感组不同代谢型的患者比例。(4)比较氯吡格雷抵抗组与氯吡格雷敏感组的患者年龄、性别比例,以及吸烟、糖尿病、高血脂、高血压患者比例。(5)比较氯吡格雷抵抗组与氯吡格雷敏感组的临床心血管不良事件发生情况,临床心血管不良事件包括支架内再狭窄、心源性疾病、心肌梗死、心绞痛。
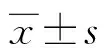
2 结 果
2.1CYP2C19基因型和代谢型分布 346例患者CYP2C19基因检测结果显示,CYP2C19基因型*1/*1有136例(39.3%),*1/*2有144例(41.6%),*1/*3有22例(6.4%),*2/*2有36例(10.4%),*2/*3有8例(2.3%),未检测到*3/*3;代谢型分别为快代谢型136例(39.3%),中代谢型166例(48.0%),慢代谢型44例(12.7%)。
2.2不同CYP2C19代谢型患者的MAR比较 慢代谢型、中代谢型、快代谢型患者的MAR分别为(62.9±7.8)%、(48.7±6.5)%、(43.9±9.1)%,慢代谢型患者的MAR较中代谢型、快代谢型的MAR高,差异均有统计学意义(t=10.6、15.3,P<0.05)。
2.3CYP2C19代谢型与氯吡格雷抵抗的关系 入选的251例患者检测出MAR≥50%的患者110 例(氯吡格雷抵抗组),MAR<50%的患者141例(氯吡格雷敏感组)。氯吡格雷抵抗组与氯吡格雷敏感组在快代谢型中的患者比例差异有统计学意义(χ2=4.741,P=0.029)。见表1。

表1 CYP2C19代谢型与氯吡格雷抵抗的关系[n(%)]
2.4两组临床相关危险因素比较 氯吡格雷抵抗组的患者年龄、男性比例,以及吸烟、糖尿病、高血脂患者比例与氯吡格雷敏感组比较,差异均无统计学意义(P>0.05),氯吡格雷抵抗组的高血压患者比例与氯吡格雷敏感组比较,差异有统计学意义(P<0.05),见表2。
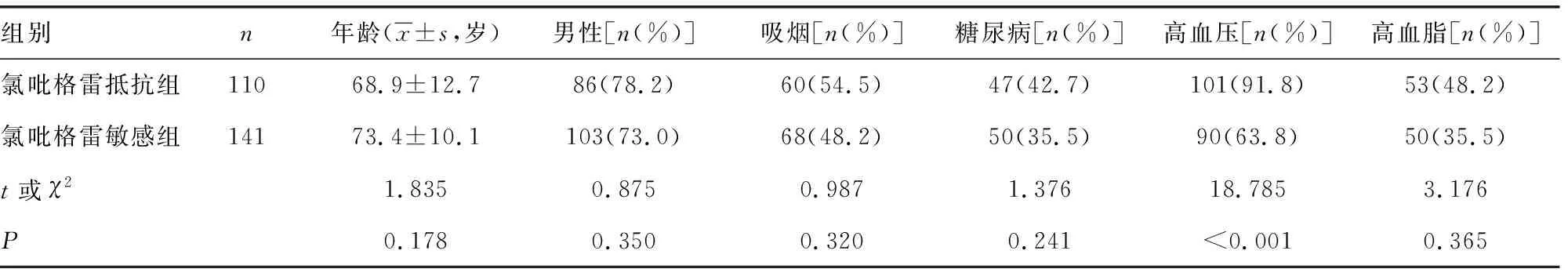
表2 两组临床相关危险因素比较
2.5两组临床心血管不良事件发生情况比较 氯吡格雷抵抗组临床心血管不良事件发生率高于氯吡格雷敏感组,差异有统计学意义(P<0.05)。见表3。
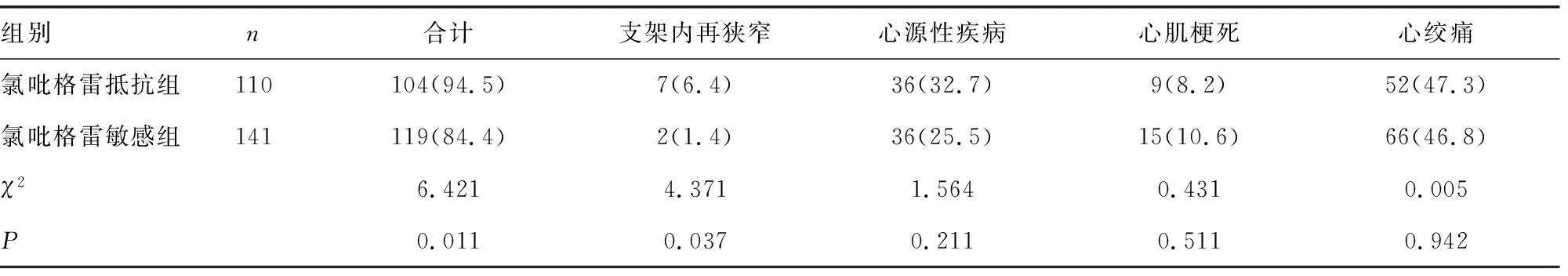
表3 两组临床心血管不良事件发生情况比较 [n(%)]
3 讨 论
目前,在已发现的25个CYP2C19等位基因中,中国人群主要以CYP2C19*1、CYP2C19*2、CYP2C19*3 为主,而且不同地域和种族人群之间CYP2C19基因型多态性的分布也不一致[7]。本研究分析了重庆地区346例患者CYP2C19的基因型和代谢型分布,快代谢型占39.3%、中代谢型占48.0%、慢代谢型占12.7%。这与重庆地区其他两组研究报道结果[8-9]相似,但*2/*2的比例较文献[9]报道的7.1%增加,*3/*3的比例较文献[8]报道的1.3%减少,差异均有统计学意义(P<0.05);但与蒙古族人群的中代谢型和慢代谢型占比不完全一致[10]。与新疆地区维吾尔族和哈萨克族人群的CYP2C19代谢型相比,本研究快代谢型占比较低,中代谢型和慢代谢型占比较高,但与汉族人群的代谢型分布基本一致[11]。
本研究结果显示,慢代谢型患者与快代谢型、中代谢型患者比较,具有较高的MAR,且快代谢型患者发生氯吡格雷抵抗的概率较小。进一步可推出非快代谢型(中代谢型和慢代谢型)患者发生氯吡格雷抵抗的可能性较大。CYP2C19酶是P450氧化酶系统的重要组成部分,对氯吡格雷的氧化起到关键性作用,而CYP2C19酶的活性受到CYP2C19基因的调控,因此CYP2C19基因突变可影响到机体对氯吡格雷的敏感程度[12-13]。中代谢型包括CYP2C19 *1/*2、*1/*3,慢代谢型包括CYP2C19 *2/*2、*2/*3、*3/*3,即CYP2C19携带了一个以上的突变位点;当CYP2C19基因发生突变,其酶的催化活性降低,从而降低体内氯吡格雷活性代谢产物水平,导致血小板聚集率升高,氯吡格雷抵抗率也升高。故CYP2C19基因突变可能是氯吡格雷抵抗发生的一个危险因素。
有研究表明,CYP2C19rs12248560基因多态性能够作为心力衰竭合并肺动脉高压发生的危险因素,可以作为早期预防心力衰竭合并肺动脉高压的指标[14]。本研究发现,氯吡格雷抵抗与CYP2C19基因多态性和高血压存在一定关系,因此,推荐对冠心病患者尽早进行CYP2C19基因检测和血小板聚集功能试验,根据检测结果进行个体化用药,避免氯吡格雷抵抗现象发生,从而预防临床心血管不良事件的发生。PAN等[15]研究报道,在氯吡格雷治疗的缺血性脑卒中或短暂性脑缺血发作的患者中,携带CYP2C19功能丧失等位基因的患者比非携带者具有更高的复发脑卒中和复合心血管事件风险。余建萍等[16]研究发现,氯吡格雷抗血小板治疗患者携带CYP2C19*2基因是颈动脉血管内支架置入术(CAS)后氯吡格雷抵抗组发生支架内血栓的重要因素,并影响患者预后。本研究也发现,氯吡格雷抵抗更容易发生临床心血管不良事件,故可推测出携带CYP2C19杂合突变和纯合突变的PCI术后患者更容易发生临床心血管不良事件。CYP2C19基因突变可影响冠心病患者PCI术后的联合心脏事件发生率,分析其中原因主要是突变纯合型的血小板聚集率和氯吡格雷抵抗率较高,导致这部分患者未能达到预期的抗血小板聚集作用,进而导致其预后不良,增加联合心脏事件发生率。
尽管本研究与多数的研究结果一致认为氯吡格雷抵抗与CYP2C19基因多态性及后续的心血管事件存在一定相关性,但也有研究发现中国PCI术后患者心血管不良事件发生率与经氯吡格雷代谢途径的基因变异无显着相关[17],且也有研究支持氯吡格雷抵抗与CYP2C19的基因多态性无相关[4]。再加上目前血小板聚集功能检测方法众多但一致性不理想,不同种族间氯吡格雷治疗后血小板高反应性不同,患者如何通过试验结果从抗血小板治疗中获益等问题尚未解决,因此对氯吡格雷抵抗及其相关影响因素的研究值得进一步探讨。
综上所述,本研究探讨了重庆地区CYP2C19 基因多态性、临床危险因素及不良心血管事件与氯吡格雷抵抗的关系,结果显示,PCI术后携带CYP2C19慢代谢型的冠心病患者具有较高的MAR,且快代谢型患者发生氯吡格雷抵抗的概率较小;同时发现氯吡格雷抵抗的发生可能与高血压有关,且存在氯吡格雷抵抗患者更容易发生临床心血管不良事件的可能。但本研究局限在于仅选择某一时间段的本院PCI术后患者,可能不能完全代表本地区的整体情况,应加大多中心合作,扩大样本量,进一步证实本研究结论。
CYP2C19基因突变和高血压可能是氯吡格雷抵抗发生的两个重要影响因素,并且氯吡格雷抵抗增加了PCI术后患者临床心血管不良事件的发生风险。因此,对于PCI术后使用氯吡格雷的冠心病患者,应及早进行CYP2C19基因多态性检测,根据检测结果个体化用药,减少或避免临床心血管不良事件的发生。



