谭 莹 ,谭庆华
(1.广东省深圳市观澜人民医院内二科,广东深圳 518000;2.贵阳医学院附属医院消化内镜科,贵州贵阳 550004)
随着内镜微创技术的进步,对某些胃肠道黏膜病变及黏膜下表浅病变,可行内镜下电切术,完全摘除病变[1]。术后局部随即形成溃疡,当溃疡完全愈合后,才真正达到临床治愈的目的。 结缔组织生长因子(connective tissuegrowth factor,CTGF)具有促进细胞增殖、合成胶原等诸多生理作用[2];而表皮生长因子与其受体(epidermalgrowth factor receptor,EGF-R)结合形成二聚体,启动相应的信号转导通路,促进细胞有丝分裂,促进损伤组织的修复[2]。电切术后的一段时间内,临床上常经验性给予抗菌治疗以减少术后创面感染的发生。但常规使用抗生素是否有利于黏膜创面的修复?本文观察大鼠结肠黏膜电切术后创面自然愈合的过程及抗菌治疗过程中CTGF和ERF-R的变化。
1 材料与方法
1.1 实验动物及分组
选用成年的健康SD大鼠共48只(贵州省贵阳医学院实验动物中心),雌雄各半,体重(200±13)g。饲养标准棒状饲料,自由饮水,室温(23±2)℃,实验前适应性喂养1周。平均随机分为4组:①正常组;②手术未治疗组;③手术治疗组;④假手术组。
1.2 动物模型
术前24 h禁食,8 h禁饮。腹腔内注射麻醉剂(10%水合氯醛3~6 ml/kg)后,无菌操作下取下腹正中切口入腹腔,将膨大的盲肠部钳拉出腹腔外,在盲肠远端的结肠侧切开肠管,切口长约5 mm,在距切口约5 mm处的结肠黏膜下注射生理盐水至黏膜隆起,用单极电刀(CHR-ⅢE型,武汉春光医疗美容仪器有限公司,中国)电切隆起的结肠黏膜大小约3 mm×3 mm。关闭肠管、腹腔、消毒、包扎,所有动物术后禁食、禁水24 h。假手术组只切开肠管,不行黏膜电切术,其余同手术治疗组。
1.3 动物给药
手术治疗组用0.08%的盐酸左氧氟沙星[0.018g/(kg·d),国药准字H19990324,扬子江药业集团有限公司,中国]和0.92%的甲硝唑[0.047g/(kg·d),国药准字 H10930165,山西仟源制药有限公司,中国]腹腔内注射,分组持续注射至术后第4、7、12天;手术未治疗组、假手术组均采用等剂量的生理盐水腹腔注射;正常组予以常规饲养,不予以腹腔注射给药。各组其余实验条件相同,于相应时间用离断颈椎法处死大鼠,留取电切术局部肠管,正常组和假手术组留取相应部位的肠管,用10%中性福尔马林液固定24 h后常规石蜡包埋、切片备用。
1.4 免疫组化法检测CTGF、EGF-R(SABC 法)
用煮沸法修复抗原,修复液为0.01 M枸橼酸盐缓冲液(pH=6.0)。 一抗分别为 Rabbit Anti-CTGF、Rabbit Anti-EGFR(武汉博士德生物工程有限公司,中国),1∶100稀释。生物素化二抗为兔抗大鼠IgG(武汉博士德生物工程有限公司,中国),DAB显色试剂盒(AR1022,北京中杉金桥生物技术有限公司,中国)室温显色20 min后,蒸馏水洗涤以终止反应,苏木素轻度复染1 min,水洗,脱水、透明、中性树胶封片观察。各组设阴性对照。
1.5 结肠黏膜CTGF和EGF-R 的半定量测定
各组大鼠肠壁组织经免疫组化染色后于400倍光镜下,对每张切片随机选择5个视野照像后,用图像分析法测定每个视野中CTGF、EGF-R的积分光密度值(IOD),取其平均值作为每张切片的CTGF、EGF-R的IOD值。
1.6 数据统计
2 结果
2.1 各组动物结肠组织中CTGF 的测定
在正常组大鼠中,CTGF阳性染色主要在结肠黏膜层单层柱状上皮细胞的胞浆中,呈弱阳性,主要集中在大肠腺体的顶端,其基底部几乎为阴性。手术未治疗组和假手术组除了上述部位阳性染色外,黏膜下层的结缔组织的成纤维细胞胞浆也出现阳性染色。经盐酸左氧氟沙星及甲硝唑联合给药治疗后,CTGF阳性染色出现在黏膜层单层柱状上皮细胞的胞浆和黏膜下层的结缔组织的成纤维细胞胞浆中,且染色强度明显高于假手术组及手术未治疗组,见图1。
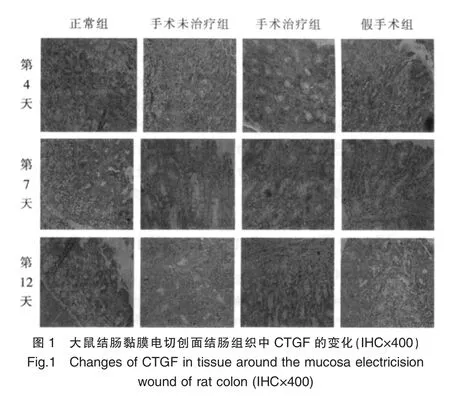
在同一时间点上的不同组间相比,术后第4天手术治疗组的IOD值较正常组、手术未治疗组、假手术组都明显升高(P<0.05)。术后第12天假手术组和手术未治疗组的IOD值较正常组明显升高(P<0.05),且手术未治疗组又明显高于假手术组(P<0.05),见表1。
在同一组内的不同时间相比,正常组的IOD值各时间点之间无明显差异(P>0.05)。手术未治疗组和假手术组均在术后第12天达最大值,明显高于术后第4天和第7天 (P<0.05)。 手术治疗组在术后4d达最大值(P<0.05),第7天降至正常水平,与正常组无显着性差异(P>0.05)。同组内第7天和第12天相比无显着性差异(P>0.05)。见表1。
2.2 各组动物结肠组织中EGF-R 的测定
在正常组大鼠中,EGF-R阳性表达主要位于结肠黏膜层单层柱状上皮细胞的胞浆中,呈弱阳性染色。手术治疗组、手术未治疗组及假手术组EGF-R主要表达在局部组织的黏膜层单层柱状上皮细胞、杯状细胞的胞浆及黏膜下层的血管内皮细胞胞浆中。其中手术治疗组的染色强度较正常组、假手术组及手术未治疗组明显增强。见图2。
在同一时间点上的不同组间比较,术后第4天手术治疗组的IOD值较正常组、手术未治疗组、假手术组都明显升高(P<0.05);手术治疗组术后第7天仍明显高于其他各组 (P<0.05),到术后第12天回落至正常组水平(P>0.05)。术后第12天假手术组和手术未治疗组的IOD值较正常组明显升高 (P<0.05),且手术未治疗组又明显高于假手术组(P<0.05),术后第4、7天的假手术组、手术未治疗组与正常组无显着性差异(P>0.05),见表2。
表1 CTGF在各组大鼠结肠组织中阳性染色的IOD(±s)Tab.1 IOD of CTGF positive stain in tissue of rat colon(±s)
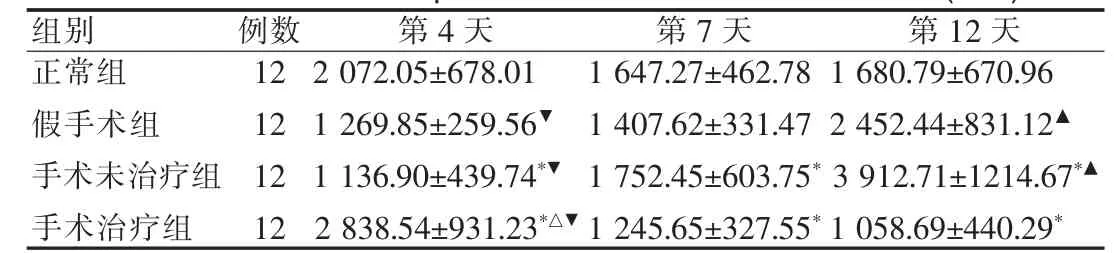
表1 CTGF在各组大鼠结肠组织中阳性染色的IOD(±s)Tab.1 IOD of CTGF positive stain in tissue of rat colon(±s)
与正常组比较,*P<0.05;术后第4天手术治疗组与正常组、手术未治疗组及假手术组相比,△P<0.05;术后第12天假手术组及手术未治疗组与正常组比较,▲P<0.05;同组内与其他两个时间点相比,▼P<0.05Compared with normal controlgroup,*P<0.05;compared with shamgroup and untreatedgroup on the 4thday,△P<0.05;compared with normal controlgroup and untreatedgroup on the 12thday,▲P<0.05;compared with others time point in a samegroup,▼P<0.05
组别例数12 12 12 12正常组假手术组手术未治疗组手术治疗组第4天2 072.05±678.01 1 269.85±259.56▼1 136.90±439.74*▼2 838.54±931.23*△▼第7天1 647.27±462.78 1 407.62±331.47 1 752.45±603.75*1 245.65±327.55*第12天1 680.79±670.96 2 452.44±831.12▲3 912.71±1214.67*▲1 058.69±440.29*
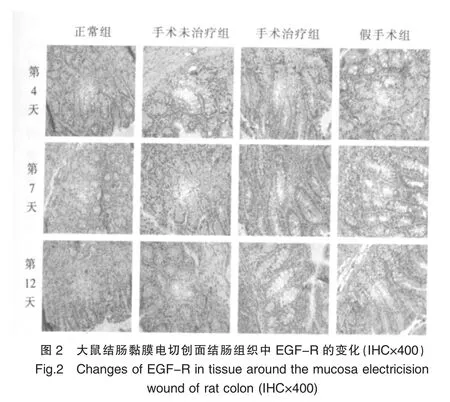
在同一组内的不同时间相比,正常组的IOD值各时间点之间无显着性差异(P>0.05)。经联合给药后,手术治疗组的IOD值在术后第4天达高峰,较同组内第7天和第12天明显升高 (P<0.05),术后第7天又高于术后第12天 (P<0.05)。手术未治疗组和假手术组的IOD值均在术后第12天达最大值,均较同组内第4天和第7天明显增加(P<0.05)。见表2。
3 讨论
内镜下黏膜切除术(endoscopic mucosal resection,EMR)和内镜黏膜下剥离术(endoscopic submucosaldissection,ESD)已成为消化道癌前病变和早期癌的重要治疗手段[1-3]。而术后暴露于肠内容物的创面,可能继发感染,延迟其愈合,所以术后临床上常给予抗生素治疗。
在切除病变的局部将形成黏膜及黏膜下组织的缺损,而创面愈合涉及到坏死物质的清除、基底部肉芽组织的生长、纤维组织和瘢痕组织的生长、新生血管的生成、单层柱状上皮的长入、上皮的重构等过程。在这一过程当中会有包括CTGF和EGF等一系列的细胞因子参与[3-4]。
表2 EGF-R在各组大鼠结肠组织中阳性染色的IOD(±s)Tab.2 IOD of EGF-R positive stain in tissue of rat colon(±s)
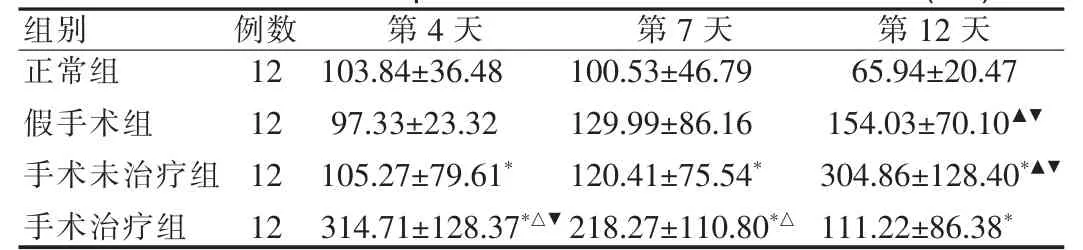
表2 EGF-R在各组大鼠结肠组织中阳性染色的IOD(±s)Tab.2 IOD of EGF-R positive stain in tissue of rat colon(±s)
与正常组比较,*P<0.05;术后第4天及第7天手术治疗组与正常组、手术未治疗组及假手术组相比,△P<0.05;术后12天假手术组和手术未治疗组与正常组比较,▲P<0.05;同组内与其他2个时间点相比,▼P<0.05compared with normal controlgroup,*P<0.05;compared with untreatedgroup and shamgroup on the 4thday and 7thday,△P<0.05;compared with normal controlgroup on the 12thday,▲P<0.05;compared with others time point in a samegroup,▼P<0.05
组别例数12 12 12 12正常组假手术组手术未治疗组手术治疗组第4天103.84 ±36.48 97.33 ±23.32 105.27 ±79.61*314.71 ±128.37*△▼第7天100.53 ±46.79 129.99 ±86.16 120.41 ±75.54*218.27 ±110.80*△第12天65.94 ±20.47 154.03 ±70.10▲▼304.86 ±128.40*▲▼111.22 ±86.38*
CTGF可刺激成纤维细胞增殖和细胞外基质(extracellular matrix,ECM)生成,参与机体组织的创伤修复及器官纤维化形成的过程[2]。本实验结果显示,正常组的CTGF阳性染色主要在结肠黏膜层单层柱状上皮细胞的胞浆中,呈弱阳性表达,且主要集中在大肠腺体的顶端,而在基底部几乎为阴性。这说明少量的黏膜浅层单层柱状上皮细胞分泌的CTGF即可以确保肠壁内结缔组织的生理性更新,使得结缔组织中的相关成分处于一种动态平衡状态,而且这一生理过程主要由黏膜浅层的上皮细胞参与调节。
CTGF不仅促进溃疡修复过程中的纤维化过程,而且在瘢痕组织的重建或改建过程中起着更重要的调节作用,这种调节作用由溃疡及周边结缔组织中的CTGF和黏膜层单层柱状上皮细胞中的CTGF协同完成。其机制可能是一方面通过诱导成纤维细胞的增殖和细胞外的合成,介导细胞黏附,刺激细胞迁移,参与结缔组织的再生、肉芽组织的形成。另一方面通过诱导血管内皮细胞的增殖,促进微血管的形成,参与结构的重建[5]。手术治疗组、手术未治疗组和假手术组在黏膜层柱状上皮细胞的胞浆和黏膜下层结缔组织中明显增强的CTGF染色表明,CTGF可能通过诱导成纤维细胞的增殖和细胞外基质的合成,参与结缔组织的再生、肉芽组织的形成和机化。
通过对CTGF的IOD值分析发现,假手术组和手术未治疗组的结肠黏膜电切损伤后,在不做其他任何处理的情况下,术后7d内对上皮细胞合成和分泌CTGF无明显影响。而在术后12d手术造成的创伤可能引起了机体自身修复反应的增强,此时CTGF分泌的增高是调节创伤修复的重要环节,这种反应使得上皮细胞合成和分泌CTGF的功能在第12天变得最强。术后第12天手术未治疗组CTGF值较同时间的假手术组明显增高,充分说明了额外的黏膜电切损伤,明显增强了上皮细胞合成和分泌CTGF的功能,黏膜电切这一有效而确定的损伤和刺激引起了机体相应的修复反应。
相对于正常组、假手术组和手术未治疗组而言,手术治疗组CTGF值的明显升高和其峰值的前移 (术后第4天)说明,盐酸左氧氟沙星及甲硝唑的干预,使得与CTGF相关的机体修复反应明显提前到术后第4天,这可能与这两种抗生素的抗菌效应所形成的一个肠道近于无菌的环境,增强了这一代偿、修复机制有关,即在抗菌治疗后,黏膜创面的感染减轻,由此出现的较轻炎症反应以及较少的炎症介质的释放,减轻了黏膜的损伤,更有利于上皮的增生和修复。
表皮生长因子(epidermalgrowth factor,EGF)主要由颌下腺及十二指肠Brunner腺分泌。在生理情况下,EGF由唾液直接进入消化道或由十二指肠Brunner腺直接分泌入小肠而发挥其对消化道黏膜的生物效应。在胃肠道的任何部位如果形成溃疡,能诱导干细胞形成新的EGF分泌细胞体系,分泌大量EGF,从而刺激细胞增殖、再生,修复溃疡[10]。EGF必须与细胞膜表面的表皮生长因子受体 (epidermalgrowth factor receptor,EGFR)结合才能发挥其生物学作用,促进上皮细胞、间质细胞的生长,增加黏膜细胞DNA、RNA和蛋白质合成,增加黏膜血流,促进黏液分泌,刺激组织生长修复,保护胃肠黏膜,促进急慢性损伤的愈合等[6]。
在正常组大鼠的结肠黏膜上皮细胞中EGF-R的弱阳性染色,可能是大鼠肠黏膜上皮细胞的生理性更新,维持肠黏膜正常的完整性和肠黏膜上皮细胞正常的吸收功能所必需的。从各组动物的结果显示,EGF-R阳性表达主要位于结肠黏膜层单层柱状上皮细胞的胞浆中,看来无论是结肠黏膜生理性更新,还是外源性损伤后的修复,对结肠黏膜组织中与EGF-R相关的修复反应,其黏膜浅层的上皮细胞应该起到最重要的作用。
有研究发现,EGF腔内应用可诱导小肠黏液杯状细胞分泌黏液,保护鼠肠黏膜免受油酸诱导的损伤[7]。手术治疗组、手术未治疗组及假手术组的EGF-R主要表达在溃疡局部组织的黏膜层单层柱状上皮细胞、杯状细胞及黏膜下层的血管内皮细胞胞浆中,且染色明显加深。由于EGF-R参与调节正常上皮细胞的分化、增殖、上皮细胞间黏附及接触抑制,当上皮细胞更新旺时,EGF-R表达增加,而当创伤被修复或上皮细胞的更新完成后,其表达明显降低[6],这可能是术后手术治疗组、手术未治疗组和假手术组的EGF-R明显升高的原因。说明电切术后增加的EGF-R可能促进了杯状细胞分泌黏液,促进新生血管的形成,增加黏膜血流量,刺激组织生长及修复,从而加快了溃疡的愈合,维持了结肠黏膜的完整性。
假手术组和手术未治疗组的EGF-R值在术后第4、7天没有明显的变化,而在术后第12天达到高峰,说明手术创伤可引起EGF-R表达的增加,其引起的机体自身修复反应在7d内无明显变化,12d时变化最明显。从结果看,可能是黏膜电切术引起了更强的自身修复反应,所以假手术组和手术未治疗组的EGF-R值虽然均在术后第12天达最高峰,但手术未治疗组却较假手术组明显升高。
同CTGF的变化相似,在手术治疗组术后第4天EGF-R值增加达最高峰;不同的是术后第7天虽有下降趋势,但仍明显高于同时间的其他各组,直至术后第12天才慢慢回落至正常水平。这说明抗菌治疗在抑制炎症反应、减少炎症因子的释放、保护黏膜免受损伤的同时[8],不仅可使创伤部位结缔组织的修复反应提前,也可使上皮组织的修复明显提前。由于EGF-R的高表达,促进了结肠黏膜上皮细胞的增殖和再生,减轻炎症损伤,同时增加黏膜杯状细胞合成和分泌黏液,加快了溃疡愈合[9]。到术后第12天,上皮组织的这种修复反应在溃疡表面得以初步修复后,EGF-R的合成和分泌才通过一定的机制回落到正常生理状态时的水平。
溃疡的愈合包括上皮、细胞外基质、黏膜上层和更深层组织的重建,是一个上皮细胞增殖、迁移和结缔组织填补黏膜缺损的主动过程。肠黏膜上皮损伤的修复需要黏膜重建和再生。重建可能是早期黏膜修复的一个关键步骤,其重要过程是细胞迁移即从损伤周围完好的上皮细胞移行覆盖到邻近的损伤表面,重塑黏膜屏障的完整性。再生过程包括增殖和分化[10]。本实验结果显示,在手术治疗组中CTGF和EGF-R的表达高峰均在术后第4天。在术后第7天,CTGF恢复到正常水平,而EGF-R仍明显高于正常组,此说明在给药后,肠黏膜损伤后的修复,无论是结缔组织修复的相关反应,还是上皮组织修复的相关反应,都在术后第4天最明显。
综上所述,大鼠结肠黏膜电切术后,机体自身的黏膜修复反应可能在术后第7天内无明显反应,术后第12天变得最明显。在给予盐酸左氧氟沙星及甲硝唑治疗后,结肠黏膜损伤后的结缔组织修复和上皮组织修复都在术后第4天最明显。随着CTGF的明显下降,结缔组织修复已基本完成,而上皮组织修复仍然很明显。给药后可使修复反应的时间提前,且作用明显增强,有助于创面的愈合,但最佳用药时间长短仍有待于进一步研究证实。
[1]Yoshida N,Yagi N,Naito Y,et al.Safe procedure in endoscopic submucosaldissection for colorectal tumors focused on preventing complications[J].World Jgastroenterol,2010,16(14):1688-1695.
[2]Tarnawski A,Szabo IL,Husain SS,et al.Regeneration ofgastric mucosaduring ulcer healing is triggered bygrowth factors and signal transduction pathways[J].J Physiol Paris,2001,95(1-6):337-344.
[3]姜泊.染色内镜和放大内镜技术是提高早期大肠癌诊治水平的重要手段[J].第一军医大学学报,2002,22(5):385-387.
[4]李益农,陆星华.消化内镜学[M].2版.北京:科学出版社,2004:484.
[5]Matsuda S,Gomi F,Oshima Y,et al.Vascular endothelialgrowth factor reduced and connective tissuegrowth factor induced by triamcinolone in ARPE19 cel ls under oxidative stress [J].Invest Ophthalmol Vis Sci,2005,46(3):1062-1068.
[6]Huang BR,Cai LW,Xiang XZ.The basic and applied study on the epidermalgrowth factor[J].Zhongguo Yi Xue Ke Xue Yuan Xue Bao,2001,23(2):176-180.
[7]Ishikawa S,Cepinskasg,Specian RD,et al.Epidermalgrowth factor attenuates jejunal mucosal injury induced by oleic acid:role of mucus[J].Am J Physiol,1994,267(6 Pt 1):G1067-G1077.
[8]HarveyRJ,WallworkBD,LundVJ.Anti-inflammatoryeffectsof macrolides:applications in chronic rhinosinusitis [J].Immunol Allergy Clin North Am,2009,29(4):689-703.
[9]王雪茜,王新月,杨莉莉.不同给药途径对大鼠溃疡性结肠炎结肠黏膜EGF表达的影响[J].世界华人消化杂志,2006,14(29):2872-2875.
[10]苏华芳,江松福,俞康.三叶肽在胃肠黏膜重建中的作用研究进展[J].国际消化病杂志,2007,27(2):87-89.



