苏冀红,李奇矩
1.长沙市妇幼保健院药剂科,湖南长沙 410007;2.湖南省人民医院药剂科,湖南长沙 410005
加替沙星是新一代日本杏林制药公司研发的氟喹诺酮类广谱抗菌药物,现将其专利权已转让给美国施贵宝制药公司,有口服与静脉注射两种规格,已在全球多个国家等获得许可上市[1]。它抗菌谱广,抗菌活性强,不但对革兰阴性菌包括大肠埃希菌、流感嗜血杆菌、克雷伯菌属、铜绿假单胞菌、不动杆菌属、沙门菌属等具有较好的抗菌活性,而且对革兰阳性球菌包括金黄色葡萄球菌、溶血性链球菌、肺炎链球菌及厌氧菌也有较好的抗菌活性,对非典型病原体作用增强,并具有良好的药代动力学特性[2]。本实验比较了在我国健康成年男性志愿者中口服国产和进口加替沙星片剂的药代动力学参数,以评估两者的生物等效性,现报道如下:
1 材料与方法
1.1 仪器
HPLC 1100高压液相色谱仪,美国Agilent,配备自动进样器和二极管阵列检测器;Agilent化学高级色谱数据工作站;分析天平,上海生工电子;高速冷冻离心机,日本Olympus;HY-4多用调速振荡器;北京医用仪器厂:GL-88B旋涡混合器,上海医用仪器厂。
1.2 试剂
乙腈为色谱纯,四丁基溴化铵、为分析纯。受试制剂国产加替沙星(规格:200 mg/片,重庆赛维药业有限公司,批号:060701);参比制剂进口加替沙星(规格:200 mg/片,美国施贵宝制药公司,批号:060301);加替沙星对照品(加替沙星标准液,中国药品生物制品检定所,含量:98.9%,批号:130518-200402)。
1.3 受试对象与分组
选择健康男性40例,平均年龄(36.5±3.0)岁,平均体重(61.5±5.5)kg。经病史询问,并全面体检。然后采用双周期自身随机交叉试验设计。40例试验者随机等分为两组,试验者于试验前1 d晚餐后,禁食不禁水12 h,次日清晨空腹分别单次口服加替沙星胶囊试验制剂和参比制剂40 mg,以250 ml温开水送服,并作记录。服药2 h后可自由饮水,服药4 h后进统一标准餐。试验期间由医护人员进行监护。间隔7 d后交叉给药,重复上述试验。分别于服药前(0 h)和服药后1.0、4.0、8.0 h由前臂肘静脉取血5 ml。血样置于含有肝素的离心管中,立即离心5 min。分离出血浆,置-40℃冰箱中保存,备测。
1.4 血浆样品测定
精密吸取待测样品血浆0.5 ml,置于eppendorf 2 ml离心试管中,精密加入20%的高氯酸200μl,漩涡振荡1 min,15 000 r/min,离心 8 min,取上清液 100 μl,进样,以外标法定量,色谱工作站自动计算并打印加替沙星的色谱峰面积,将峰面积代入标准曲线方程,求出加替沙星的血浆浓度。
1.5 色谱条件
色谱柱:Phenomenex C18柱;固定进样环:100μl;流动相:甲醇-0.1 mol/L乙酸胺缓冲液-二乙胺;流速:0.8 ml/min;检测波长:295 nm;柱温:室温。在此条件下,加替沙星血浆中内源性杂峰分离良好。
1.6 标准曲线制备
取空白混合血浆2.0 ml,共5份,分别置于试管中,加入适量加替沙星标准液,使血浆中加替沙星浓度依次分别为0.15、0.31、0.62、1.24、2.48 mg/L,按下述血浆样品测定方法操作,以加替沙星的血浆浓度C(mg/L)对加替沙星的色谱峰面积(A)作线性回归,求得加替沙星的标准曲线方程为:C=2.97×10-6A-0.07(n=5)。
1.7 回收率试验
取空白血浆3份,加入适量的加替沙星标准液,分别配成高、中、低三个浓度的加替沙星样品5.0、1.2和0.3 mg/L。按样品测定法各测定含量3次。计算方法回收率,得到平均值依次分别为(97.5±1.5)%、(96.5±1.8)%和(96.5±2.8)%。结果见表1。
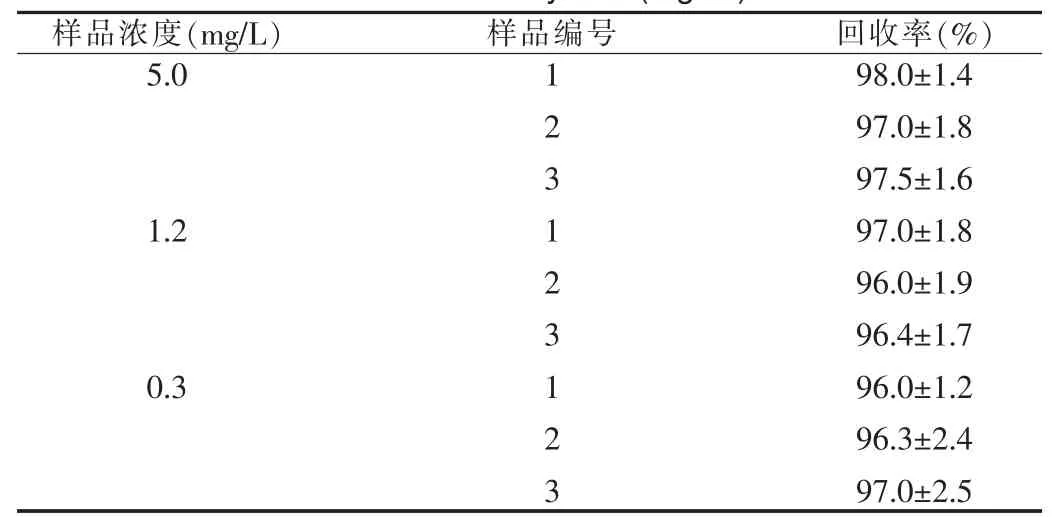
表 1 回收率试验(mg/ml)Tab.1 Recovery test(mg/ml)
1.8 精密度试验
方法同回收率方法,求得加替沙星RSD分别为1.05%、1.65%、5.42%。将上述3个浓度的样品在8 d内陆续各重复测定6次,求得对应的RSD分别为1.65%、3.55%和7.32%。
1.9 统计学分析
实验数据用SPSS 15.0程序进行统计学处理。计量资料用均数±标准差(x±s)表示,若是正态分布,用方差分析,组间、组内比较;若是非正态分布,用秩和检验。以P<0.05作为具有显着性差异的标准。
2 结果
受试者单剂口服国产和进口加替沙星片的药物动力学参数见表1,结果显示口服国产和进口加替沙星后两组的半衰期、峰时间、峰浓度和滞后时间无显着性差异。同时生物等效性也无显着性差异,可认为两种制剂具有生物等效性。见表2。
3 讨论
在药物使用上,加替沙星口服后经胃肠道快速吸收,食物对其吸收影响轻微[3]。加替沙星胶囊血清蛋白结合率约为20%,与血药浓度无关。在唾液中浓度为血药浓度的80%,口服200 mg加替沙星胶囊后平均痰中浓度为2.1μg/ml,与血药浓度的比为1.25,与其他同类药物相比加替沙星胶囊在痰中转移良好。加替沙星吸收后,20%与血浆蛋白结合[4]。在体内分布广泛,单剂口服加替沙星100、200、400及600 mg后,其平均血浆半衰期与剂量无关。口服加替沙星300 mg,每日2次,连续 7 d,在第 1、4、7 d 其半衰期分别为 5.4、7.0、5.7 h[5]。 加替沙星几乎不经代谢以原药形式随尿液排出。单剂口服加替沙星400 mg,72 h用药量的88%左右由尿液排泄[6]。
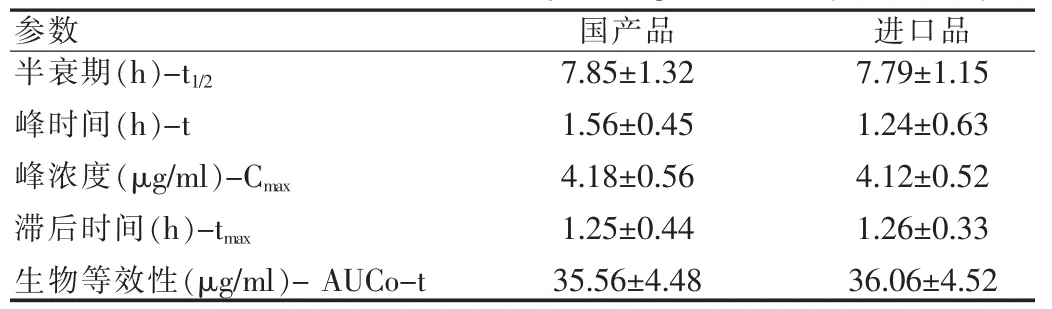
表2 口服国产和进口加替沙星后药物动力学与生物等效性参数(n=20,x±s)Tab.2 Pharmacokinetics and bioequivalence parameters of oral administration of domestic and imported gatifloxacin(n=20,x±s)
在加替沙星胶囊的药代动力学及生物等效性评价上,主要用高效液相色谱法,它具有进样量少、灵敏度高和重复性好等优点,适合生物体液的分析,有关加替沙星胶囊的高效液相色谱法分析应用的文献报道最多,如用该法测定血清、尿液、脑脊液、唾液、粪便中的药物[7]。对于生物体液中的蛋白质或其他生物大分子的影响,用柱切换技术预处理柱,分离除去基质,使分析简单、快速[8]。本文使用的高效液相色谱法为吸收波长为295 mn,流动相为甲醇-0.1 mol/L乙酸胺缓冲液-二乙胺;流速为0.8 ml/min,结果重现性良好,回收率与精密率也比较高。同时本文进行了对照分析,结果显示受试制剂的相对生物利用度高,且受试制剂与参比制剂的药代动力学无显着性差异,说明两种制剂在临床上可相互替代使用。
[1]孙涛,宋坤改,林赴田.盐酸加替沙星胶囊的药代动力学研究[J].中国新药杂志,2000,9(11):758-761.
[2]黄妹,张德平,周贤梅,等.甲磺酸加替沙星治疗下呼吸道感染疗效观察[J].中国药师,2006,9(1):51-52.
[3]李大江.甲磺酸加替沙星片剂与环丙沙星片剂治疗皮肤软组织感染随机对照临床研究[J].中国抗感染化疗杂志,2004,4(5):287-290.
[4]朱曼,王睿,方翼,等.人体血浆及尿液中甲磺酸加替沙星浓度的HPLC测定法[J].药物分析杂志,2003,23(2):53.
[5]白群华,肖永红,余泽波,等.健康人国产加替沙星片的药代动力学[J].中国抗感染化疗杂志,2002,2(2):81.
[6]吴苏澄,姜云平,曾仁杰,等.RP-HPLC法测定兔血浆及载药人工陶骨周围肌肉组织中利福喷丁浓度[J].华西药学杂志,1997,12(1):8-10.
[7]张菁,郁继诚,曹国英,等.国产加替沙星片剂在中国男性健康受试者的临床药代动力学及生物等效性研究[J].中国临床药理学与治疗学,2004,9(5):177.
[8]史爱欣,赫广威,李可欣,等.国产加替沙星胶囊剂人体药代动力学及生物等效性研究[J].中国药学杂志,2003,38(6):45.



