陈 淼 ,郝 玥 ,周 娜 ,张淑英
1.解放军总医院整形修复外科,北京 100853;2.解放军总医院高压氧科,北京 100853
皮瓣坏死是皮瓣移植术后常见的并发症,术后血液灌注不充分及缺血再灌注损伤,导致皮瓣坏死。为了提高移植皮瓣的存活率,我科于2010年1~12月在常规预防皮瓣坏死综合措施的基础上,加用高压氧治疗,疗效满意,现报道如下:
1 资料与方法
1.1 一般资料
选取2010年1~12月我科收治的皮瓣移植患者120例,将其随机分为实验组和对照组。其中,对照组52例,术后常规预防皮瓣坏死;实验组68例,在常规预防皮瓣坏死措施的基础上加用高压氧治疗。其中,男82例,女38例;年龄16~57岁,平均(34.0±4.6)岁;任意型皮瓣 86例,岛状皮瓣 12例,游离皮瓣10例,撕脱皮瓣12例;皮肤缺损面积(1.9 cm×2.0 cm)~(3.5 cm ×6.0 cm);损伤后至手术时间:3~12 h。 两组患者年龄、性别及受伤情况经统计学检验差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 常规治疗与护理 皮瓣移植术后患者均采用抬高患肢、抗凝、解痉、止痛、抗血栓、预防感染治疗。患者要卧床休息1周,病室内保持安静,控制室温恒定在25℃,白炽灯持续照射7~10 d局部保温。术后所有治疗护理操作动作宜轻柔,防止敷料包扎过紧、石膏外固定卡压。维持有效血液循环,嘱患者进食高蛋白、高热量、高维生素饮食,加强基础护理,预防压疮。
1.2.2 皮瓣的观察记录 患者手术后进入病房即开始记录皮瓣的长度、血供、颜色、引流情况等,详细记录皮瓣的颜色有无变化、有无淤血、泛红试验情况等。
1.2.3 皮瓣并发症的处理 ①缺血的处理:缺血是最常见的并发症,表现为皮瓣发白,要及时通知医生,解除加压包扎纱布和绷带,减轻对皮瓣蒂部的压力,或者变换患者的体位,减小皮瓣的张力。②静脉回流不畅的处理:表现为皮瓣发紫,发黑,通常处理是减轻皮瓣蒂部的压力,用棉棒驱赶淤血,或针扎放出积血,以防血栓形成加重淤血,有时也需检查有无皮瓣下积血。
1.2.4 高压氧治疗 实验组术后3~48 h在常规治疗护理基础上辅以高压氧治疗。采用多人空气加压氧舱,匀速加压约20min至压力为 0.2 MPa(2.0 ATA),稳压面罩吸纯氧 30 min×2,中间休息10 min,匀速减至常压约20 min出舱。每日1次,连续10 d为1个疗程,共3个疗程,疗程间隔1~4 d。
1.3 疗效判定标准
术后4周观察皮瓣情况。存活:皮瓣周围无炎症反应,干燥、红润、饱满、弹性好、皮温正常。基本存活:皮瓣周围无炎症反应,皮瓣及切缘表皮呈灰白色,无弹性,出现水泡、紫红色或暗黑色,表皮部分坏死,但有肉芽组织形成。未存活:所植皮瓣全层坏死,全层颜色变黑、切割时不流新鲜血液且无痛觉。
1.4 统计学方法
采用SPSS 16.0软件进行处理,组间总有效率和皮瓣坏死发生率比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
经上述治疗后,实验组68例中,无皮瓣坏死65例,占95.59%;皮瓣坏死3例,皮瓣坏死发生率为4.41%,均经换药使其脱痂愈合。对照组52例中,无皮瓣坏死41例,占78.85%;皮瓣坏死11例,皮瓣坏死发生率为21.15%。两组患者皮瓣移植总有效率和皮瓣坏死发生率比较差异有统计学意义(P=0.016<0.05)。 见表1。
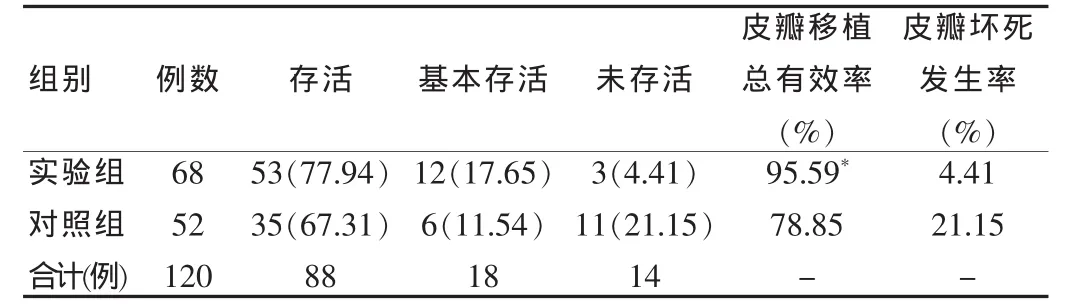
表1 两组临床疗效比较[n(%)]
3 讨论
3.1 皮瓣坏死的原因
皮瓣出现血运障碍,导致皮瓣部分或全部坏死是比较常见且严重的并发症,通常是由于皮瓣动脉供血不足,和(或)静脉回流不畅所致。在过去30年中,由于显微外科迅速发展,吻合小血管的游离皮瓣移植已成为整形外科进行组织移植、再植、重建和器宫再造的一项新的重要的技术。即使游离皮瓣移植围术期的每一步都能很好完成,仍有10%移植皮瓣因缺血再灌注(ischemia-reperfusion,IR)损伤而出现坏死。皮瓣IR损伤的病理生理学机制主要包括组织局部中性粒细胞浸润增多、氧自由基损伤、细胞内钙离子超载、高能磷酸化合物缺乏和无复流等。因此,皮瓣坏死防治的根本措施在于改善血液循环、减轻炎症反应和防止或减轻缺血再灌注损伤。
3.2 高压氧治疗防治皮瓣坏死的机制
本研究发现,术后常规处理后、高压氧治疗的患者(即观察组)的皮瓣坏死发生率显着低于对照组,证实了皮瓣移植术后高压氧治疗对于皮瓣坏死的预防具有重要意义。皮瓣移植术后加用高压氧治疗,能减少皮瓣坏死,明显提高皮瓣存活率。高压氧对皮瓣成活影响的实验研究在20世纪60年代中期就已开始,目前认为,高压氧主要通过以下机制促进皮瓣的存活。
3.2.1 高压氧能提高皮瓣组织氧分压 皮瓣的氧耗量和需氧量均较正常皮肤组织增加[1]。高压氧治疗时,可以改变血液中储氧方式,氧在血液中的物理溶解量显着增加,因此增加了血氧含量及氧储量,从一定程度上增加了皮瓣的氧供,可有效地改善闭塞血管远端组织的缺氧状态。由于压力升高,动脉血氧分压急骤增高,提高血氧分压、组织氧分压和有效血氧弥散半径,使组织含氧量和储氧量增加,在高压环境下氧的弥散距离增加,当动脉血流经组织毛细血管时,增加组织氧供,有氧代谢加强,释放更多的能量供组织需要,改善了神经血管的营养状态,雪旺氏细胞活力增加,加速了细胞的有丝分裂和髓鞘的形成。促使局部生长因子发挥良好作用,促进组织的更新,增强了受皮区组织的生长活力,促进肉芽组织生长。在移植的皮瓣与受皮区血液循环尚未充分建立连接之前,组织液内的高分压氧可减轻移植因缺乏血液供应而造成的持续性乏氧状态,有利于皮瓣移植的成活。
3.2.2 高压氧能改善皮瓣血液循环 Zamboni[2]应用激光多普勒血流仪检查,证明皮瓣经高压氧治疗后,血流量显着增加。外伤创面的血运往往较差,易感染,一旦感染,组织内氧含量降低,血管通透性增加,液体渗入细胞,组织形成水肿,局部纤维增加,更加重了局部组织缺氧,组织缺氧是缺血和感染的重要病理改变,最终导致皮瓣坏死。高压氧引起周围血管收缩,拮抗缺血后反射性的血管舒张,改善微循环,减轻水肿[3]。受损的组织往往缺氧,其氧分压通常低于15 mm Hg(1 mm Hg=0.133 kPa)。而成纤维细胞分裂产生胞质时氧分压不能低于30 mm Hg。高压氧治疗后,促使氧向组织扩散使皮瓣组织氧分压大大增加,刺激成纤维细胞并增加胶原蛋白的合成,促进毛细血管再生,从而有利于皮瓣成活[4]。移植皮瓣失活通常继发于皮瓣远端动-静脉短路的发展,后者导致了重要毛细血管网的血流灌注减少。高压氧的收缩血管效应,可选择性地关闭非缺血区的动-静脉短路[5],从而使更多的血液流入缺血组织以滋养毛细血管循环,促进毛细血管的开放和功能恢复,加速毛细血管增生和侧支循环的建立,增加血供,提高皮瓣成活率[6]。能使红细胞氧合作用增加,血液黏度和细胞凝聚活性下降,减轻淤血状态,使皮肤变软,临床症状减轻缓解。高浓度的组织氧还可抑制厌氧菌的生长及毒素产生,有利于控制感染,且与抗生素有协同作用,更有利于皮瓣的存活。
3.2.3 高压氧能减少缺血再灌注损伤 有研究发现,在术后缺血中自由基是重要的破坏介质。皮瓣缺血后,ATP生成减少,AMP积聚,黄嘌呤氧化酶的活性增加。再灌注时提供的氧使黄嘌呤氧化酶得以催化而产生自由基,引起再灌注损伤。Tai等[7]认为游离皮瓣经高压氧治疗,由于氧供充足,ATP生成增加,AMP积聚减少,黄嘌呤氧化酶活性降低,能阻止次黄嘌呤、黄嘌呤产生,抑制黄嘌呤氧化,提供不利于自由基产生的环境,从而减轻缺血再灌注损伤,提高皮瓣成活率[8]。
3.2.4 高压氧能促进皮瓣表面对氧的吸收 Tan[9]将皮瓣远端变紫的猪处死后置于202.65 kPa高压氧中,皮瓣远端能逐渐变红,证明皮瓣表面皮肤吸收氧是存在的。
3.2.5 免疫抑制作用 高压氧可减轻过强的变态反应对机体的损伤。
本研究表明,皮瓣术后除常规抗凝、解痉、抗感染外,高压氧治疗应尽早介人,有利于提高皮瓣移植的成活率。高压氧治疗可通过逆转皮瓣组织缺氧和低灌注、促进其毛细血管增殖、减轻缺血再灌注损伤及防止中性粒细胞活化等方面提高皮瓣移植的成活率,有助于患者早期康复,对提高患者生活质量有积极作用。高压氧治疗方法简便、经济、安全可靠,无严重不良反应。有学者认为,在条件允许的情况下,术前给予高压氧预处理,对皮瓣成活会有更大的促进作用。对于未成活的皮瓣,及时清创后仍应积极给予高压氧治疗,一方面促进新鲜肉芽生长、控制感染;另一方面,为二次植皮做准备。其机制尚待进一步研究并有待于在临床上进一步实践。
[1]Pelliteri PK,Kennedy TL,Youn BA.The influence of intensive hyperbaric oxygen therapy on skin flap survival in as wine model[J].Arch Otolaryngol Head Neck Surg,2002,118(10):1050-1051.
[2]Zamboni WA,Roth AC,Russell RC,et a1.The effect of hyperbaric oxygen on reperfusion of ischemic axial skin flaps:a laser Doppler analysis[J].Ann Plast Surg,2002,28(4):339-340.
[3]Strauss MB,Hurgrns AR,Gersheni DH,et al.Reduction of skeletal muscle necrosis using intermittent hyperbaric oxygen in a model compartment syndrome[J].J Bone Joint Surg(Am),2006,65(5):656-658.
[4]Kerrigan CL,Zelt RG,Thomson JG,et a1.The pig as an experimental animal in plastic surgery research for the study of skin flaps,myocutaneous flaps and fasiocutaneous flaps[J].Lab Anim Sci,2006,36(4):408-411.
[5]Reinisch JF.The pathophysiology of skin flap circulation[J].Plast Reconstr Surg,1994,54(5):585-586.
[6]Manson PN,Im MJ,Myers RAM,et a1.Improved capillarities by hyperbaric oxygen in skin flaps[J].Surg Forum,2000,31(5):564-567.
[7]Tai YJ,Birely BC,Im MJ,et a1.The use of hyperbaric oxygen for presetvation of f ree flaps[J].Ann Plast Surg,2006,28(3):284-287.
[8]Edwards RJ,ImM J,Hoopes JE.Effects of hyperbaric oxygen preservation of rat limb replantation:a preliminary report[J].Ann Plast Surg,1991,27:31-35.
[9]Tan CM,Im MJ,Myers RAM,et a1.Effects of hyperbaric oxygen and hyperbaric air on the survival of island skin flaps[J].Plast Reconstr Surg,2004,73(1):27-29.



