高建明 Erle S.Robertson▲
1.三峡大学医学院病理生理学教研室,湖北宜昌443002;2.美国宾夕法尼亚大学医学院微生物学教研室,宾夕法尼亚费城19104
卡泼肉瘤病毒复制转录激活因子调控宿主细胞Bcl-2表达的分子机制及其生物学意义
高建明1Erle S.Robertson2▲
1.三峡大学医学院病理生理学教研室,湖北宜昌443002;2.美国宾夕法尼亚大学医学院微生物学教研室,宾夕法尼亚费城19104
目的研究卡泼肉瘤病毒(Kaposis′s sarcoma-associated herpesvirus,KSHV)编码的复制转录激活因子(replica tion and transcription activator,RTA)调控宿主细胞Bcl-2表达的分子机制及其生物学意义。方法突变Bcl-2启动子第1个与第2个CCN9GG样序列,构建了新的报告质粒(命名为pGL3-△RRE1,2),用荧光素酶试验和染色质免疫共沉淀进一步验证CCN9GG样RTA反应元件的功能。构建RNA干扰慢病毒载体,筛选稳定感染的BC3细胞,佛波酯诱导48 h后,分别用PCR、PI(碘化吡啶)染色流式细胞术检测病毒子DNA和细胞凋亡率。结果突变第1个与第2个CCN9GG序列导致启动子活性显着降低;染色质免疫共沉淀试验证实RTA蛋白与CCN9GG序列存在直接相互作用。用RNA干扰技术抑制Bcl-2基因后,佛波酯诱导的KSHV阳性细胞与对照组细胞相比凋亡率增加,病毒子产生减少。结论KSHV RTA能够调控内源性细胞凋亡信号通路,延缓溶解性感染宿主细胞的凋亡,并促进病毒子产生。
复制转录激活因子;Bcl-2;表达上调;抗凋亡;溶解性感染
卡波肉瘤病毒(Kaposis's sarcoma-associated herpesvirus,KSHV)复制转录激活因子(replication andtranscriptionactivator,RTA)是ORF50编码的一种即刻早期蛋白,是促使病毒从潜伏性感染向裂解性感染转变的关键调控因子。无论是外源性还是内源性来源引起的RTA表达增高,均可介导病毒裂解性基因的级联表达[1]。RTA主要通过两种方式激活下游靶基因:一是直接与高亲和性的RTA反应元件(RTA responsive elements,RREs)结合[2];二是间接地与细胞内的一些转录因子结合发挥调控作用,这些转录因子包括K-RBP[3]、CEBP-α[4]、Oct-1[5]和RBP-JК[6]等。RREs主要有两类,一类富含AT碱基,另一类含有CCN9GG样序列,这里N可以为任何碱基。例如,KSHV ORF57基因启动子含有这两类RREs[2]。Bcl-2蛋白是一种定位于线粒体上的膜蛋白,为Bcl-2原癌基因所编码,具有抑制细胞凋亡的功能[7-8]。本研究探讨KSHV RTA调控Bcl-2的分子机制及其在宿主细胞增殖与凋亡、病毒子的产生等方面的生物学意义。
1 材料与方法
1.1 质粒
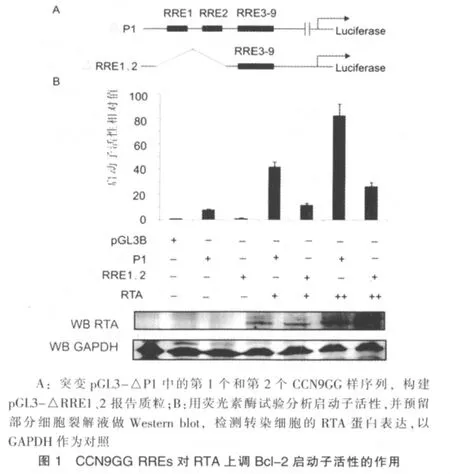
pcDNA-RTA编码全长RTA的真核表达载体。pGL3-Bcl-2为含Bcl-2基因全长启动子的荧光素酶报告质粒。pGL3-△P1是采用PCR定点突变技术构建的突变了Bcl-2基因P1启动子的报告质粒,构建方法如下:先将启动子片段(-346~+1)插入pGL3载体MluⅠ/HindⅢ双酶切位点处(pGL3-P2),再将片段(核苷酸-2 867~-1 545)插入pGL3-P2的MluⅠ/HindⅢ双酶切位点处。pGL3-△RRE1、2是在pGL3-△P1基础上突变了第1个和第2个CCN9GG RRE的报告质粒,克隆所用引物见表1。
1.2 抗体与细胞
RTA抗体由上海巴斯德研究所蓝柯实验室惠赠。Bcl-2小鼠单克隆抗体购自Santa Cruz公司,GAPDH抗体购自Novus Biologicals公司,偶联IR Dye 800的羊抗鼠IgG二抗购自Rockland公司。HEK 293是原代人胚肾细胞转染腺病毒DNA的永生化细胞。BJAB为KSHV、EBVA均阴性的B细胞淋巴瘤细胞,BC3和BCBL1是感染KSHV的人体腔淋巴瘤细胞系。
1.3 细胞转染及KSHV的诱导
采用Bio-Rad公司的Gene Pulser电穿孔仪进行细胞转染。用20 ng/mL佛波酯、1.5 mmol/L丁酸钠诱导KSHV。所有细胞均在诱导后培养48 h收集。

表1 PCR扩增及报告质粒构建的引物序列
1.4 Western blot
细胞收集后加入RIPA缓冲液裂解,用Bradford比色法测定蛋白质浓度。取相同质量的细胞裂解液上样,聚丙烯胺凝胶电泳结束后,转移蛋白样品至PVDF膜,用Bcl-2抗体、RTA抗体、GAPDH抗体及偶联IR Dye 800的羊抗鼠IgG二抗进行免疫印迹。用Odyssey红外线成像系统(LI-COR公司)观察结果。
1.5 荧光素酶报告基因试验
107个HEK 293细胞共转染10 μg荧光素酶报告质粒和10 μg RTA表达质粒。转染后24 h收获细胞,制备细胞裂解液。向40 μL细胞裂解液中加入25 μL荧光素酶试验底物,使用LMaxII384荧光光度计(Molecular Devices)检测荧光水平。结果以3次试验值的均数与标准差表示。Western blot用来验证转染的蛋白质的表达。
1.6 染色质免疫共沉淀(ChIP)
BCBL1细胞于佛波酯诱导48 h后向培养液中加入甲醛,终浓度为1%,37℃固定细胞10 min,使蛋白质和DNA发生交联。加入甘氨酸使其终浓度为0.125 mol/L,在室温下晃动孵育5 min以终止交联反应。使用预冷的PBS清洗细胞2次,加入含1%SDS的裂解液裂解细胞,超声裂解细胞悬液将DNA均一地打断成500~1 000 bp的片段。用ChIP稀释缓冲液将超声剪切后的DNA稀释10倍,取20 μL稀释液保存,这时的样品标记为INPUT,作为PCR的空白对照。其余稀释液加入蛋白A琼脂糖磁珠,4℃孵2 h,分为两组,一组加入RTA抗体,4℃振荡过夜,另一组加入鼠IgG抗体作为阴性对照。将免疫复合物用磁珠沉淀,将沉淀物分别经低盐、高盐和氯化锂溶液3次系列冲洗,然后用TE缓冲液洗2次,每次冲洗时间5 min。用新配制的洗脱缓冲液将蛋白/DNA复合物从磁珠上洗脱,加氯化钠(Na+浓度为200 mmol/L)与2 μL RNaseA(0.5 mg/mL),65℃过夜,松解蛋白/DNA交联;加入5 μL蛋白酶K(20 mg/mL),于55℃水浴2 h。用酚/氯仿抽提DNA。以回收DNA片段为模板,进行PCR反应,DNA的数量水平可通过定量PCR来检测,引物见表1。扩增产物越过RRE1与EERE2区域,片段长度为200 bp。同时做RT-PCR,用比较ΔΔCt值的方法对DNA丰度进行相对定量。
1.7 RNA干扰慢病毒载体的构建及细胞转导
Bcl-2基因小片段发卡结构RNA(small hairpin RNA,shRNA)用shBcl-2表示;对照shRNA以shC表示。它们均由Sigma公司合成[9]。pGIPZ是一种shRNA慢病毒载体,用来表达Bcl-2小片段发卡结构RNA,购自Open Biosystems。RNA干扰慢病毒载体构建及细胞转导实验方法参见文献[10]。本研究中,笔者构建了BC3-shBcl-2、BJAB-shBcl-2细胞及其对照BC3-shC、BJAB-shC细胞。
1.8 病毒子DNA的PCR扩增
BC3-shBcl-2、BC3-shC细胞经佛波酯诱导后培养48 h,离心弃细胞,用0.45 μm孔径的过滤器收集培养液上清,23 500 r/min离心20 min以沉淀病毒颗粒。加50 μL 0.2×PBS重悬病毒颗粒,放置95℃下15 min,加入1 μL蛋白酶K(10 mg/mL)于56℃孵育1 h,95℃30 min灭活蛋白酶K。取5 μL病毒裂解液作模板,PCR扩增KSHV编码的K9。K9引物见表1。以BC3细胞中分离的KSHV基因组DNA为对照。PCR产物条带的灰度用Kodak1D3.6软件(Eastman)定量。
1.9 细胞凋亡检测
PI染色流式细胞仪检测细胞凋亡的原理是:凋亡细胞染色体降解、DNA碎片形成与可染性降低。收集细胞(106/mL)以1 000 r/min离心5 min,弃去培养液。3 mL PBS洗涤1次。离心去PBS,加入冰预冷的70%乙醇固定,4℃过夜。离心弃去固定液,PBS重悬细胞。加入终浓度50 μg/mL PI(Sigma公司)、1 μg/mL RNA酶于4℃下避光染色1 h。用FACSCalibur流式细胞仪(Becton Dickinson公司)检测细胞凋亡,每个样本重复测定6次。
1.10 统计学方法
数据分析采用FlowJo软件(Tree Star),采用方差分析进行统计学检验,以P<0.05为差异有统计学意义。
2 结果
2.1 突变第1个与第2个CCN9GG RRE导致启动子活性显着降低
为进一步验证CCN9GG RRE的功能,笔者将pGL3-△P1报告质粒中的第1个和第2个CCN9GG RRE进行了突变,得到了pGL3-△RRE1、2这一新的报告质粒(图1A)。荧光素酶试验结果表明突变第1个与第2个CCN9GG RRE导致启动子活性显着降低(图1B)。在没有转染RTA的293细胞,报告质粒pGL3-△RRE1、2的荧光素酶活性与对照质粒pGL3-Basic都比较低;在转染了RTA的293细胞,报告质粒pGL3-△RRE1、2的荧光素酶活性约增加10倍,约为带有9个完整CCN9GG RRE的pGL3-△P1报告质粒荧光素酶活性的1/3。预留部分细胞裂解液做Western blot检测,以GAPDH作为对照,转染细胞RTA表达良好,表明转染效率佳。
2.2 RTA蛋白与CCN9GG序列存在直接相互作用
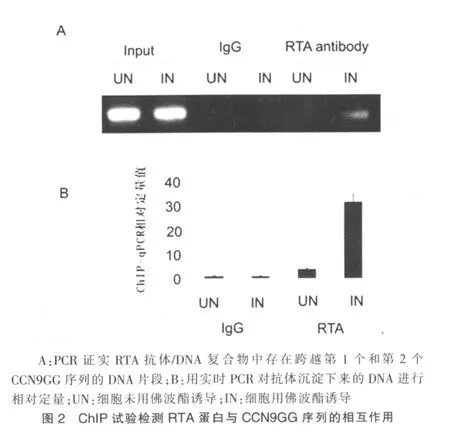
用佛波酯诱导和未经诱导的BCBL1细胞进行ChIP试验,表明RTA蛋白与CCN9GG序列存在直接的相互作用。PCR扩增证实免疫复合物中存在跨越第1个和第2个CCN9GG序列的DNA片段。在RTA抗体沉淀下来的经诱导的核DNA组目的条带清晰可见,在RTA抗体沉淀下来的未经诱导的核DNA组无阳性信号,两个IgG抗体阴性对照组亦均无阳性条带(图2A)。实时PCR用来相对定量沉淀下来的DNA的丰度,RTA抗体沉淀下来的经诱导BCBL1细胞的核DNA量比对照组高8~32倍(图2B)。
2.3 RTA介导的Bcl-2上调延缓溶解性感染的宿主细胞的凋亡,促进病毒子产生
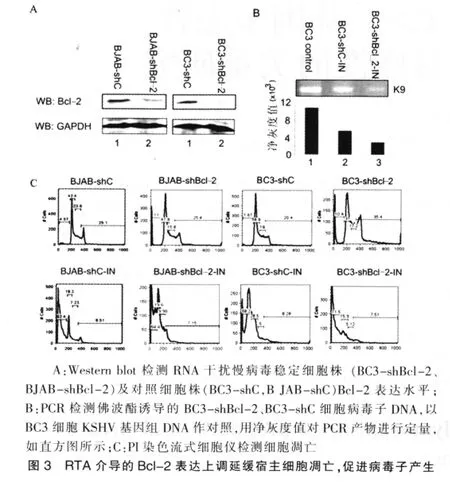
RTA上调Bcl-2表达,Bcl-2是调节细胞凋亡的重要分子,因此笔者推测RTA介导的Bcl-2上调具有抑制宿主细胞的凋亡、促进病毒子产生的生物学功能。为验证此假设,笔者应用慢病毒介导的RNA干扰技术构建了Bcl-2抑制的稳定细胞株(BC3-shBcl-2、BJAB-shBcl-2)及对照细胞株(BC3-shC、B JAB-shC)。Western blot分析证实BC3-shBcl-2、BJAB-shBcl-2细胞的Bcl-2蛋白的表达水平很低(图3A)。BC3-shBcl-2、BC3-shC细胞经佛波酯诱导后培养48 h,分离宿主细胞裂解产生的病毒子,以PBS重悬的病毒颗粒作模板,扩增KSHV编码的K9基因。结果显示Bcl-2抑制细胞病毒子的产量约为对照组细胞的1/2(图3B)。这表明RTA介导的Bcl-2表达上调能够促进宿主细胞病毒子的产生。流式细胞仪分析显示KSHV阴性细胞BJAB-shC与BJAB-shBcl-2细胞经佛波酯诱导后细胞凋亡率分别为62.4%、64.4%,二者比较,差异无统计学意义(P>0.05);KSHV阳性细胞BC3-shC与BC3-shBcl-2细胞经佛波酯诱导后细胞凋亡率分别为58.2%、71.5%(图3C),二者比较,差异有统计学意义(P<0.05)。
3 讨论
Bcl-2家族成员调控着内源性线粒体途径的细胞凋亡[11]。其中根据其结构和功能可将Bcl-2家族成员分为两类,一类是具有抗凋亡功能,如:Bcl-2、Mcl-1、Bcl-xL等,它们含有4个高度保守的Bcl-2同源结构域(BH 1-4)[12];另一类具有促进凋亡的功能,如:Bax、Bak、Bad、Bid、Bim等,其中Bax、Bak含有BH 1-3,而Bid、Bad、Bim等仅含BH3结构[13]。BH3是与促进凋亡有关的结构域,BH4是抗凋亡蛋白所特有的结构域。Bcl-2蛋白为Bcl-2原癌基因所编码,不论在生理或病理条件下均具有抑制细胞凋亡的功能[7-8]。Bcl-2基因在许多肿瘤细胞都高表达,不仅阻止肿瘤细胞凋亡,而且是肿瘤化疗、放疗不敏感的重要原因[14-15]。
笔者前期研究[16]发现KSHV RTA能够上调宿主细胞Bcl-2表达。RTA可直接激活Bcl-2基因启动子,这种激活作用呈剂量依赖性,无细胞选择性。CCN9GG RREs和P2启动子对RTA调控Bcl-2表达具有重要作用。为进一步验证CCN9GG样RTA反应元件的功能,阐明RTA调控Bcl-2的分子机制及其生物学意义,笔者突变Bcl-2启动子第1个和第2个CCN9GG RRE,在pGL3-△P1基础上构建了pGL3-△RRE1、2这一新的报告质粒。荧光素酶试验结果显示,突变第1个与第2个CCN9GG RRE导致RTA介导的Bcl-2启动子活性显着降低。染色质免疫共沉淀实验表明RTA蛋白与Bcl-2启动子中的RREs存在直接的相互作用。上述证据再次证明CCN9GG RRE对RTA反式激活Bcl-2具有重要的作用。用RNA干扰技术抑制Bcl-2基因后,佛波酯诱导的BC3-shB-cl2细胞与对照组细胞相比凋亡率显着增加,病毒子产生减少。
综上所述,KSHV RTA介导的Bcl-2表达上调促进病毒的溶解性感染,可以延缓宿主细胞的凋亡,并增加病毒子的产生。
[志谢:衷心感谢Véronique Bourgarel-Rey(Aix-Marseille Université,Marseille Cedex 05,France)提供Bcl-2基因全长启动子荧光素酶报告质粒pGL3-Bcl-2。]
[1]Lukac DM,Kirshner JR,Ganem D.Transcriptional activation by the product of open reading frame 50 of Kaposi's sarcoma-associated herpesvirus is required for lytic viral reactivation in B cells[J].J Virol,1999,73(11):9348-9361.
[2]Wen HJ,Minhas V,Wood C.Identification and characterization of a new Kaposi′s sarcoma-associated herpesvirus replication and transcription activator(RTA)-responsive element involved in RTA-mediated transactivation[J].J Gen Virol,2009,90(Pt4):944-953.
[3]Yang Z,Wood C.The transcriptional repressor K-RBP modulates RTA-mediated transactivation and lytic replication of Kaposi's sarcoma-associated herpesvirus[J].J Virol,2007,81(12):6294-6306.
[4]Wang SE,Wu FY,Fujimuro M,et al.Role of CCAAT/enhancer-binding protein alpha(C/EBPalpha)in activation of the Kaposi's sarcoma-associated herpesvirus(KSHV)lytic-cycle replication-associated protein(RAP)promoter in cooperation with the KSHV replication and transcription activator(RTA)and RAP[J].J Virol,2003,77(1):600-623.
[5]Sakakibara S,Ueda K,Chen J,et al.Octamer-binding sequence is a key element for the autoregulation of Kaposi's sarcoma-associated herpesvirus ORF50/Lyta gene expression[J].J Virol,2001,75(15):6894-6900.
[6]Liang Y,Ganem D.RBP-J(CSL)is essential for activation of the K14/ vGPCR promoter of Kaposi's sarcoma-associated herpesvirus by the lytic switch protein RTA[J].J Virol,2004,78(13):6818-6826.
[7]Bourgarel-Rey V,Savry A,Hua G,et al.Transcriptional down-regulation of Bcl-2 by vinorelbine:identification of a novel binding site of p53 on Bcl-2 promoter[J].Biochem Pharmacol,2009,78(9):1148-1156.
[8]Onyshchenko MI,Gaynutdinov TI,Englund EA,et al.Stabilization of G-quadruplex in the BCL2 promoter region in double-stranded DNA by invading short PNAs[J].Nucleic Acids Res,2009,37(22):7570-7580.
[9]Junn HJ,Kim JY,Seol DW.Effective knockdown of multiple target genes by expressing the single transcript harbouring multi-cistronic shRNAs[J].Biochem Biophys Res Commun,2010,396(4):861-865.
[10]Lu J,Verma SC,Murakami M,et al.Latency-associated nuclear antigen of Kaposi's sarcoma-associated herpesvirus(KSHV)upregulates survivin expression in KSHV-Associated B-lymphoma cells and contributes to their proliferation[J].J Virol,2009,83(14):7129-7141.
[11]FlanaganAM,LetaiA.BH3domainsdefineselectiveinhibitoryinteractions with BHRF-1 and KSHV BCL-2[J].Cell Death Differ,2008,15(3):580-588.
[12]Chipuk JE,Moldoveanu T,Llambi F,et al.The BCL-2 family reunion [J].Mol Cell,2010,37(3):299-310.
[13]Cory S,Adam JM.The Bcl2 family:regulators of the cellular life-ordeath switch[J].Nat Rev Cancer,2002,2(9):647-656.
[14]Ohmori T,Podack E,Nishio K,et al.Apoptosis of lung cancer cells caused by some anti-cancer agents(MMC,CPT-11,ADM)is inhibited by bcl-2[J].Biochem Biophys Res Commun,1993,192(1):30-36.
[15]Harima Y,Harima K,Shikata N,et al.Bax and Bcl-2 expressions predict response to radiotherapy in human cervical cancer[J].J Cancer Res Clin Oncol,1998,124(9):503-510.
[16]高建明,Erle S.Robertson.KSHV RTA上调宿主细胞Bcl-2表达的分子机制研究[J].中国当代医药,2012,19(30):12-15.
Molecular mechanism and biological significance of upregulation of cellular Bcl-2 by the KSHV encoded RTA
GAO Jianming1Erle S.Robertson2▲
1.Department of Pathophysiology,Three Gorges University School of Medicine,Hubei Province,Yichang443002,China; 2.Department of Microbiology,University of Pennsylvania School of Medicine,Philadelphia,Pennsylvania19104,United States of American
Objective To explore the molecular mechanism and biological significance of upregulation of cellular Bcl-2 by the KSHV(Kaposis's sarcoma-associated herpesvirus)encoded RTA(replication and transcription activator).Methods A new reporter plasmid named pGL3-△RRE1,2 was generated by deletion of the first and second CCN9GG-like sequences. Luciferase assay and chromatin immunoprecipitation(ChIP)analysis were carried out to further confirm the important role of CCN9GG RTA responsive elements(RREs).RNA interference lentiviral vector was constructed,and stablly infected BC3 cells were screened.At 48 h postinduction,cells were subjected to PCR,PI staining flow cytometry for virus progeny production and cellular apoptosis analysis.Results Mutation of the first and second CCN9GG RRE motifs I the Bcl-2 promoter dramatically diminished promoter activity.ChIP assay showed the direct interaction of RTA protein with CCN9GG RTA responsive elements.Furthermore,knockdown of cellular Bcl-2 using specific short hairpin RNA(shRNA)indicated that RTA plays an essential role in Bcl-2-mediated anti-apoptosis of the cell,promoting the production of virus progeny. Conclusion These findings provide an insight into the mechanism by which KSHV utilizes the intrinsic apoptosis signaling pathways for promoting the survival of lytically infected host cells to allow maximum production of virus progeny.
RTA;Bcl-2;Upregulation;Antiapoptosis;Lytic replication
R373
A
1673-7210(2012)11(a)-0012-04
2012-09-06本文编辑:谷俊英)
National Cancer Institute 5R01CA091792-08,5R01CA108461-05,1R01CA137894-01 and 1R01CA138434-01A209;National Institute of Allergy and Infectious Diseases 5R01AI067037-04 and National Institute of Dental and Craniofacial Research 5R01DE017338-03(to ESR).
▲通讯作者



