梁碧华 李润祥 马少吟 龚业青 李薇 毕超 朱慧兰 广东省广州市皮肤病防治所,广东广州 510095
CD 20嵌合抗体的构建、表达及纯化的实验研究
梁碧华 李润祥 马少吟 龚业青 李薇 毕超 朱慧兰 广东省广州市皮肤病防治所,广东广州 510095
目的构建CD20嵌合抗体,检测其活性并纯化该嵌合抗体。方法从杂交瘤细胞株中分别扩增抗鼠CD20抗体的轻链和重链基因的可变区,并与人的轻链和重链恒定区连接,分别克隆到pTY5真核表达载体,然后共转染293E细胞,通过RT-PCR检测mRNA的转录,夹心ELISA检测抗体表达量,流式细胞术(FCM)分析嵌合抗体的结合特异性。结果正确扩增得到抗CD20人鼠嵌合抗体的轻链和重链基因片段并成功构建重组真核表达载体pTY5-CD20H和pTY5-CD20L,在293E细胞中进行瞬时表达,RT-PCR显示抗体基因在细胞中进行了成功的转录,ELISA测定抗体表达量在15~24 ng/mL之间,流式检测结果证实细胞上清分泌的抗CD20嵌合抗体可与NS-1细胞株结合,并通过protein A柱亲和层析获取高纯度的抗CD20嵌合抗体。结论成功构建表达抗CD20嵌合抗体的载体,且表达的抗体具有结合活性,为下一步研究慢性荨麻疹的发病机制及治疗打下基础。
CD20;嵌合抗体;慢性荨麻疹;自身免疫疾病
CD20抗原是一种B细胞分化抗原,仅位于前B细胞和成熟B细胞,而在造血干细胞、血浆细胞和其他正常组织中不表达[1],是B细胞靶向治疗的理想作用位点。抗CD20单克隆抗体(mAb)以B细胞表面分子CD20为靶向,其用于治疗B细胞淋巴瘤已经获得了令人鼓舞的疗效[2]。近年来也越来越多地应用到自身免疫性疾病的治疗,包括慢性荨麻疹(chronic urticaria,CU)的治疗[3]。
慢性荨麻疹是一种常见皮肤病,目前治疗效果不佳,且其发病机制较为复杂,至今尚未完全清楚[4-8]。虽有研究表明将B细胞靶向治疗应用于慢性荨麻疹具有良好疗效[9-11],但目前资料有限,对于具体的作用机制尚不清楚。为了寻找更为有效安全的用于治疗慢性荨麻疹的CD20抗体药物,本研究在前期筛选获取抗CD20单克隆细胞株的基础上,拟克隆其重链和轻链的基因片段,构建重组真核表达载体,并最终表达、纯化具有细胞结合活性的抗CD20嵌合抗体,为下一步治疗慢性荨麻疹的研究打下基础。
1 材料与方法
1.1 实验材料
杂交瘤细胞株、TOP10(大肠埃希菌)、293E细胞、NS-1细胞为本实验室保存。
RNA提取试剂盒、RT-PCR试剂盒购自美国Promega公司;质粒提取试剂盒和胶回收试剂盒购于康为世纪公司;DNA连接酶、限制性内切酶、Ex Taq酶、DNA Marker购于大连宝生物公司;转染试剂Lipofectamine 2000、RPMI 1640培养基、DMEM培养基购自Invitrogen公司;改良型快速杂交瘤细胞培养基购自PAA公司;FITC标记的羊抗小鼠IgG抗体购自美国Santa Cruz公司;protein A层析柱购自杭州贤至生物科技有限公司。
1.2 实验方法
1.2.1 引物设计参考文献报道[12-13]设计合成针对鼠轻、重链可变区序列的引物;根据Genebank检索得到的抗体κ和IgG1型基因序列设计合成针对轻、重链恒定区的引物,见表1。
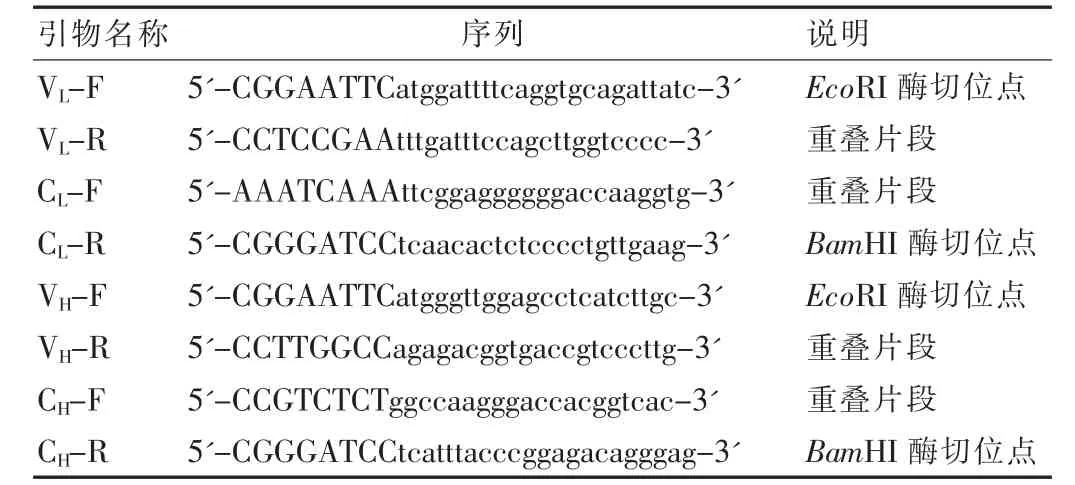
表1 PCR引物
1.2.2 细胞培养杂交瘤细胞培养于改良型快速杂交瘤细胞培养基中;293E细胞培养于DMEM培养基中,NS-1细胞培养于RPMI 1640培养基中,均含10%胎牛血清和双抗;培养于5%CO2、37℃培养箱中。
1.2.3 RNA提取与cDNA合成分别收集杂交瘤细胞和293E细胞,按TRIZOL的说明书进行提取细胞总RNA,测OD值和电泳检测RNA质量,按RT-PCR试剂盒说明书进行逆转录得cDNA,保存于-20℃备用。
1.2.4 抗体轻、重链基因的调取与克隆以来源于杂交瘤细胞的cDNA为模板,用引物VL-F和VL-R、VH-F和VH-R分别扩增轻、重链可变区基因;以来源于293E细胞的cDNA为模板,用引物CL-F和CL-R、CH-F和CH-R分别扩增轻、重链恒定区基因。上述序列测序验证正确后,通过重叠延伸PCR,连接可变区和恒定区,得到完整抗体基因。再次测序验证,然后将轻、重链基因用内切酶Eco RI、Bam HI分别进行双酶切,分别克隆到用同样酶进行双酶切的载体pTY5中。连接产物转化TOP10感受态细胞,于平板(氨苄抗性)37℃过夜培养后,分别挑取单克隆菌株鉴定测序。构建好的重组表达载体分别命名为pTY5-CD20H和pTY5-CD20L。
1.2.5 转染和鉴定转染前1天接种细胞:用胰酶消化293E细胞后,调细胞浓度为2.5×105个/mL,每孔1.0mL接种24孔板,置37℃含5%CO2培养箱培养至细胞贴壁生长达到底面积70%。转染按Lipofectamine 2000说明书进行,质粒转染量为1μg,培养4 h后更换DMEM培养液,继续培养48 h,然后收集细胞提取RNA,进行逆转录,PCR鉴定抗体基因转录情况。
1.2.6 蛋白表达纯化及初步测定质粒转染293E细胞,摇瓶培养,4~7 d收获培养基上清,ProteinA柱纯化抗体。操作方法参照说明书进行,纯化后用分光光度计测OD值推算浓度,以SDA-PAGE测定蛋白的纯度、分子量。
1.2.7 嵌合抗体表达的ELISA检测以羊抗人κ多抗于4℃包被酶标板过夜,用含1%BSA的PBST在37℃进行封闭2 h。分别加入嵌合抗体的表达上清和空质粒转染的上清,以人IgG参考品作为阳性对照。37℃孵育30min后用PBST洗5次,再加入HRP标记的羊抗人Fc抗体,37℃孵育30 min后用PBST洗5次。再加入TMB显色,酶标仪读取450 cm及630 cm双波长读数。
1.2.8 流式细胞术检测抗体结合活性收集NS-1细胞,每管5×105个,用PBS洗1遍,离心收集细胞;各管加表达抗体,室温反应1 h,设置阴性对照;离心收集细胞,用PBS洗1遍,加二抗FITC-羊抗小鼠IgG(1∶500),室温避光反应1 h;离心收集细胞,用PBS洗1遍,各管用300μL PBS重悬,上机检测。
2 结果
2.1 抗体基因的克隆
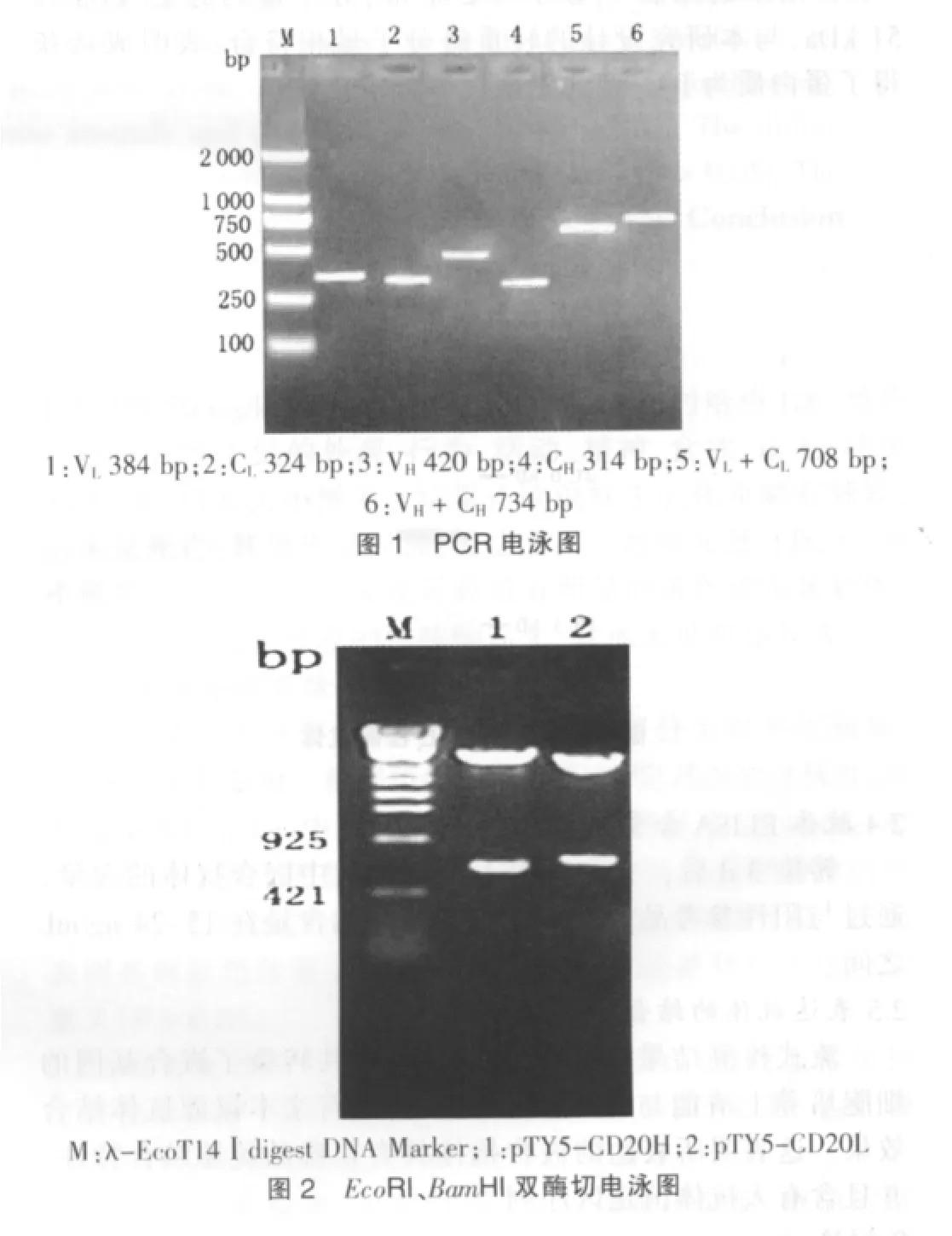
PCR结果见图1,扩增大小正确,测序验证后,序列显示为抗体基因。克隆到表达载体后,双酶切鉴定无误,结果见图2。测序结果显示,所克隆片段为鼠轻链可变区加人轻链恒定区,所调取抗体恒定区轻链为κ型;另一片段为鼠重链可变区加人重链恒定区,所调取抗体恒定区重链为IgG1型。
2.2 抗体基因的表达鉴定
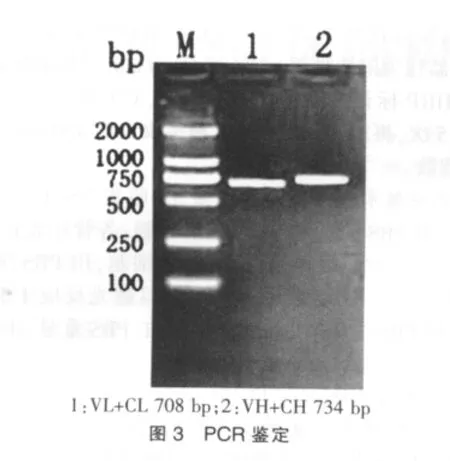
将克隆有抗体轻、重链基因的表达载体同时转染进293E细胞,然后收集细胞提取RNA,进行逆转录后用特异的引物进行PCR鉴定。PCR结果显示能特异扩增目的片段,见图3。这说明携带抗体轻、重链基因的表达载体成功转染进293E细胞,并能表达抗体基因。
2.3 表达蛋白的纯化和测定
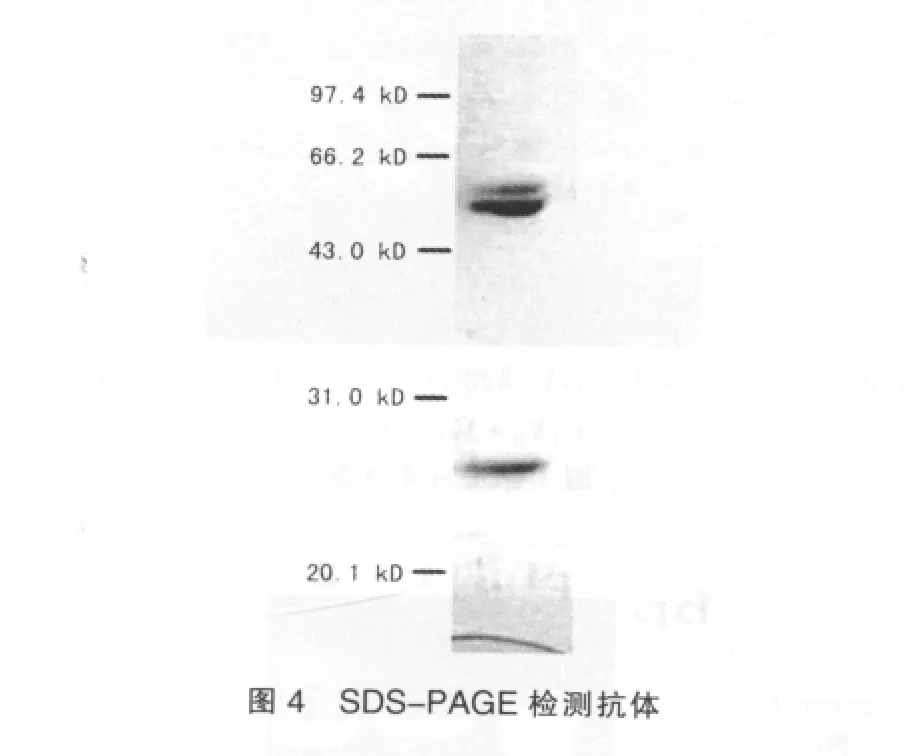
收集上清约180mL进行纯化,纯化后体积为2.7mL。根据分光光度计所测OD值估算蛋白浓度为200μg/mL左右。用protein A柱能纯化出蛋白,即说明此蛋白能与protein A亲和柱结果,可判定其为抗体类物质。在还原条件下的SDSPAGE结果请见图4,显示有2条带,分子量约为23 kDa和51 kDa,与本研究设计的轻重链分子量相符合,表明成功获得了蛋白质为IgG1型的完整抗体分子。
2.4 抗体ELISA含量的测定
转染3 d后,夹心ELISA测定上清中嵌合抗体的含量,通过与阳性参考品比较,上清中抗体的含量在15~24 ng/mL之间。
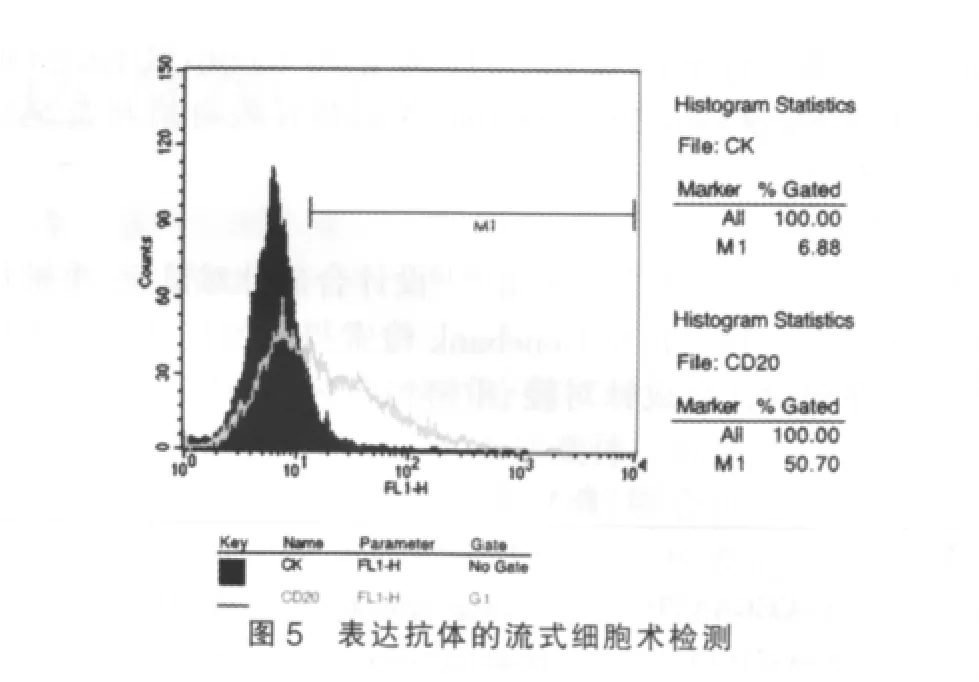
2.5 表达抗体的结合活性
流式检测结果请见图5,结果表明共转染了嵌合基因的细胞培养上清能与NS-1细胞结合,具有亲本鼠源抗体结合效果。这表明所表达的嵌台抗体具有正确的抗原结合特性,并且含有人抗体恒定区序列。
3 讨论
慢性荨麻疹病因多样复杂,发病机制不清楚,治疗相对比较困难,严重影响了患者的生活质量[4-8]。目前治疗慢性荨麻疹的药物很多,但疗效不佳[14-15]。目前已有研究表明抗CD20单克隆抗体治疗慢性荨麻疹具有良好疗效[9-11],但具体作用机制还有待研究。
CD20是非糖基化的Ⅲ型跨膜蛋白,具有高度保守性,位于B淋巴细胞表面,是B淋巴细胞表面分化抗原[16]。它主要参与调节B淋巴细胞的增殖与分化,在免疫系统起重要作用。而B细胞在荨麻疹的发病中起着关键作用,抗CD20单克隆抗体通过靶向治疗而清除B细胞,可能通过干扰B细胞所发挥的功能而达到免疫抑制作用,从而缓解荨麻疹症状[3]。Arkwright[9]首次报道利用利妥昔单抗成功治疗严重慢性自身免疫性荨麻疹1例,不过其报道同时认为此单抗可能不适用于物理性荨麻疹患者的治疗。Mukhtyar等[10]也报道成功治疗1例难治性荨麻疹性血管炎。而Murota等[11]报道1例Schnitzler综合征并发B细胞淋巴瘤患者在接受利妥昔单抗和放射疗法联合治疗后,在淋巴瘤症状改善后荨麻疹症状也逐步得到改善。这些研究均提示B细胞在荨麻疹发病中的重要作用,但更深入的研究还有待进行。
与鼠抗相比,嵌合抗体既保留了鼠源可变区的高亲和性,又具有人Fc段的多种免疫杀伤功能,降低了人抗鼠抗体反应的发生率,改善了临床治疗效果[17-18]。与其他小分子基因工程抗体相比,嵌合抗体作为完整抗体分子,在体内半寿期更长,并具有人Fc段的多种免疫杀伤功能[19-20]。本研究成功构建了含鼠源可变区和人源恒定区的抗体基因,在293E细胞中进行瞬时表达后,RT-PCR显示抗体基因在细胞中进行了成功的转录,ELISA测定抗体表达量在15~24 ng/mL之间,流式检测结果证实细胞上清分泌的抗CD20嵌合抗体可与NS-1细胞株结合,并通过protein A柱亲和层析获取高纯度的抗CD20嵌合抗体,可用于进一步研究抗抗CD20单克隆抗体治疗慢性荨麻疹的疗效和机制的实验。
[1]张久丁,张冠一,师明磊,等.CD20生物学功能的研究进展[J].生物技术通讯,2009,20(2):227-229.
[2]王玉刚,沈倍奋.CD20抗原及治疗性抗CD20抗体[J].中国肿瘤生物治疗杂志,2005,12(1):76-79.
[3]梁碧华,樊翌明,朱慧兰.抗CD20单抗的研究进展及其临床应用[J].国际皮肤性病学杂志,2011,37(2):80-83.
[4]李振化,王玲,张理涛.自身免疫性荨麻疹研究进展[J].医学综述,2010,16(6):894-895.
[5]马一平,姚煦.慢性荨麻疹自身免疫发病机制研究进展[J].中国麻风皮肤病杂志,2010,26(9):643-645.
[6]谭志建,陈静,李家文.慢性荨麻疹的发病机制研究进展[J].中国麻风皮肤病杂志,2006,22(3):221-223.
[7]吴伊旋,沈惠风.慢性荨麻疹部分发病机制的研究进展[J].临床皮肤科杂志,2008,37(2):136-137.
[8]郝飞,钟华.慢性荨麻疹发病机制和治疗策略的思考[J].中华皮肤科杂志,2010,43(1):2-5.
[9]ArkwrightPD.Anti-CD20oranti-IgE therapy forseverechronicautoimmune urticaria[J].JAllergy Clin Immunol,2009,123(2):510-511.
[10]Mukhtyar C,Misbah S,Wilkinson J,etal.Refractory urticarial vasculitis responsive toanti-B-cell therapy[J].Br JDermatol,2009,160(2):470-472.
[11]Murota H,Shoda Y,Ishibashi T,etal.Improvementof recurrenturticaria in a patientwith Schnitzler syndrome associated with B-cell lymphoma with combination rituximab and radiotherapy[J].JAm Acad Dermatol,2009,61(6):1070-1075.
[12]师明磊,胡显文,陈惠鹏,等.抗CD20嵌合抗体的表达与活性检测[J].中国生物工程杂志,2005,25(7):34-39.
[13]Olafsen T,BettingD,KenanovaVE,etal.Recombinantanti-CD20antibody fragments for small-animal PET imagingof B-cell lymphomas[J].JNucl Med,2009,50(9):1500-1508.
[14]王一乐.荨麻疹的发病机制及中西药治疗[J].浙江中西医结合杂志,2009,19(1):61-63.
[15]唐秀生.慢性荨麻疹的药物治疗进展[J].右江医学,2008,36(1):81-83.
[16]王秋兰,卢育洪,李盛璞,等.B细胞膜CD20抗原的分布与单分子力谱探测[J].生物工程学报,2011,27(1):131-136.
[17]包红霞,吴春铃,李淑珍,等.鼠抗人CD20单克隆抗体的制备与鉴定[J].细胞与分子免疫学杂志,2009,25(5):454-456.
[18]王玉刚,黄英,谷欣,等.抗CD20嵌合抗体的构建与表达[J].细胞与分子免疫学杂志,2006,22(3):363-367.
[19]李爱玲,孙瑛勋,洪海燕,等.利用基因重组抗原研制人CD20单克隆抗体及其功能的研究[J].中华微生物学和免疫学杂志,2002,22(4):385-388.
[20]丁峰,张代军,宋蜀伶,等.抗p21Ras单克隆抗体KGH-R与肝细胞肝癌及正常肝组织的免疫反应性研究[J].解放军医药杂志,2012,24(4):5-8.
Experimental study of construction,expression,and purification of CD20 chimeric antibody
LIANG Bihua LIRunxiang MA Shaoyin GONG Yeqing LIWei BIChao ZHU Huilan
Guangzhou Institute of Dermatology,Guangdong Province,Guangzhou 510095,China
ObjectiveTo construct CD20 chimeric antibody and test its activity and purify it.MethodsLight chain gene's and heavy chain gene's variable regions from rat anti-CD20 antibody were amplified from hybridoma cell strains respectively,and were connected with invariable regions of human's light chain and heavy chain.After that,they were cloned to pTY5 eukaryotic expression vector,and then to transfection of 293E cell.Transcription ofmRNA,antibody expression,and binding specificity of chimeric antibody were tested by reverse transcription-polymerase chain reaction(RT-PCR)and sandwich enzyme-linked immuno sorbent assay(ELISA),and analyzed by flow cytometry(FCM)correspondingly.ResultsLight chain gene segment and heavy chain gene segment of human-rat chimeric antibody from CD20 antibody were correctly amplified,which also successfully constructed recombination eukaryotic expression vectors of pTY5-CD20H and pTY5-CD20L who could express instantaneously in 293E cell.RT-PCR revealed antibody gene′s transcription in cellswas successful.Through ELISA determination,quantity of antibody expression was between 15-24 ng/mL.Flow cytometry confirmed that anti-CD20 chimeric antibody from secretion of supernatant could bind with NS-1 cell strain.High purity of anti-CD20 chimeric antibody could be obtained through protein A column affinity chromatography.ConclusionSuccessful construction of expression anti-CD20 chimeric antibody's vector and expressed antibody with bound activity lay a foundation for next study of pathogenesis and treatmentof chronic urticaria.
CD20;Chimeric antibody;Chronic urticaria;Autoimmune disease
R593
A
1673-7210(2012)11(b)-0010-04
广东省广州市科技支撑计划项目(项目编号:2009Z1-E011)。
朱慧兰(1966.9-),女,中共党员,主任医师,硕士生导师,广州市卫生局局管优秀科技人才,现任广州市皮肤病防治所副所长,主要从事皮肤病方面的研究。
2012-04-25 本文编辑:卫轲)



