赵京禹 费 翔 岳 琦 郭 徽 邓城旗 郝建华
解放军总医院第一附属医院麻醉科,北京 100037
脓毒症一般是由于重大外科手术或严重烧伤、创伤和缺血再灌注损伤引起的并发症,具有极高的发病率和病死率,是重症监护室(intensive care unit,ICU)患者死亡的首要因素[1-2]。严重的脓毒症可以导致多个器官的功能损伤,临床表明肺一般最先受到影响导致急性肺损伤(acute lung injury,ALI)[3-4]。 据临床调查统计,ICU脓毒症患者一般有大于50%的可能发生急性肺损伤,其极高的发病率和病死率是ICU面临的一个重大难点[5-6]。脓毒症是由于感染引起的全身炎性反应[7],虽然现代医学技术急速发展和新型抗生素的不断运用,但是脓毒症和其并发症并没有受到有效的遏制[8],其发病率高居不下[9]。急性肺损伤是由于肺部不受控制的炎性反应导致急性发生的进行性呼吸衰竭,目前并没有有效的治疗方法和途径。因此,探讨脓毒症急性肺损伤的发病机制和追寻有效的治疗药物和手段是现代医学的重要的任务。
蛇床子素(Osthole)是从蛇床子中提取的,具有多种药理活性,研究表明其对心血管系统、神经系统和内分泌系统相关疾病都具有显着的疗效,同时还具有抑癌的功能[10]。近年来研究发现,Osthole还具有抑菌消炎的作用,对金黄色葡萄杆菌和绿脓杆菌等有显着的抑制作用并且能够增强机体的免疫功能[11-12]。因此,本研究以脓毒症急性肺损伤大鼠为模型来研究探讨Osthole对急性肺损伤的作用效果,旨在为该病的预防和临床治疗提供一种新的研究思路。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 8周龄雄性SD大鼠(SPF级)购自北京维通利华实验动物技术有限公司,体重170~230 g,实验前12 h禁食,不禁水。
1.1.2 主要试剂 蛇床子素(成都曼思特生物科技有限公司);髓过氧化物酶(MPO)检测试剂盒,超氧化物歧化酶(SOD)检测试剂盒,丙二醛(MDA)检测试剂盒(南京建成生物工程研究所);戊巴比妥钠(上海化学试剂公司);二辛可宁酸(BCA)蛋白浓度测定试剂盒(上海生工);IL-6和TNF-α检测试剂盒(北京四正柏生物科技有限公司);HRP-IgG (Sigma,USA);活性caspase-3 抗体和 β-actin 抗体(Santa Cluz,USA)。
1.2 实验方法
1.2.1 动物模型构建及分组 动物模型的构建根据文献报道过的盲肠结扎穿刺术[13]。SD大鼠实验术前适应生存环境3 d,采用戊巴比妥钠腹腔注射麻醉。皮肤消毒后,在前腹正中线处切口,辨认并小心取出盲肠,在距离盲端1.5 cm处用丝线结扎,然后用18号针头在盲肠结扎处远端穿扎两次,挤出肠内少许粪便,然后归位和关腹。术后采用腹腔注射生理盐水(24 mg/kg)补充体液流失。实验分组:假手术组(Sham)进行手术但不结扎;急性肺损伤模型组(ALI)盲肠结扎穿刺术处理;低剂量组(ALI+Osthole,100mg/kg);高剂量组(ALI+Osthole,200 mg/kg), 术后 2 h腹腔注射,12 h后注射第2次。第2次注射24 h后,麻醉处死大鼠,取材分析。
1.2.2 支气管肺泡灌洗液的收集 大鼠麻醉处死,开腹取左肺叶采用磷酸盐缓冲液进行支气管肺泡灌洗5次(0.5 mL/次),收集灌洗液,12 000 r/min 低温 4℃离心15 min,小心吸取上清,-70℃保存备用。
1.2.3 支气管肺泡灌洗液蛋白含量 蛋白含量的测定按照BCA蛋白浓度测定试剂盒说明书操作。在565 nm波长处测定,结果用g/L表示。
1.2.4 肺组织MPO、MDA和SOD的测定 取大鼠肺组织称重0.1 g左右,漂洗干净,洗去血液,滤纸擦干,加入匀浆介质进行匀浆。匀浆液10000r/min,离心10min,取上清备用检测。MPO测定按MPO测定试剂盒说明,样品孔中加入0.1 mL样品稀释液,后加入肺组织匀浆上清液0.02 mL,同时做好空白孔、阴性对照孔、阳性对照孔;封住板孔,37°C放置30 min;反复洗涤板条5次。每个孔中各加入50 μL的酶联物,封住板孔,37°C放置30 min;反复洗涤板条5次。每个孔内各加入50 μL底物 A、B,封住板孔,37°C 放置 10 min,每个孔内加入终止液50 μL,终止反应。立即取出用分光光度计测定460 nm处OD值。MDA测定:将工作液、缓冲液、沉淀液和40 μL稀释好的肺匀浆液按顺序加进测试管内;对照管中除不加肺匀浆液,余步骤相同;轻轻混匀,分别将试管口用保鲜膜扎紧,用针头在保鲜膜上扎一个小孔,95℃水浴50 min;流水下冷却至室温,加1 mL蒸馏水和5 mL正丁醇吡啶抽提液,漩涡震荡1 min,532 nm波长处测定OD值。SOD测定:样品孔中加入0.1 mL样品稀释液,加入肺组织匀浆上清液0.02 mL,同时做好空白孔、阴性对照孔、阳性对照孔;封住板孔,37°C放置30 min,洗涤板条5次。每个孔中各加入50 μL的酶联物,封住板孔,37℃放置30 min;洗涤板条,每个孔内各加入50 μL底物A、B,封住板孔,37℃放置 10 min,加入终止液 50 μL,终止反应,500 nm波长处测定OD值。
1.2.5 支气管肺泡灌洗液细胞因子水平测定 提前30 min从取出冰箱中试剂盒,温度下降到室温;浓缩洗涤液用双蒸水稀释(0.05%);冻干标准品用其稀释液1 mL彻底溶解混匀,放置15 min。制备梯度浓度的标准品:从冰箱中取支气管肺泡灌洗液(BAL)上清,自然升温至室温。根据先前预实验的情况稀释成合适的浓度;浓缩的生物素抗体以及酶结合物均用其相应的稀释液进行稀释,分别在临用前15 min配好。将准备好的待测样品和标准样品分别加入各反应孔中(0.1 mL/孔)。37℃孵育 90 min,洗涤 5 次。加入生物素化抗体(0.1 mL/孔),暗处 37℃孵育 30 min,洗涤5次。每孔加显色剂 0.1 mL,37℃,15 min,避光显色。加入100 μL终止液,终止显色,450 nm测量OD值。
1.2.6 Western blot方法 提取肺组织蛋白,BCA法测蛋白的浓度。取蛋白样品30 μg,进行SDSPAGE电泳。电泳结束后,将凝胶上的蛋白通过点转移转移到硝酸纤维素膜上,并用1%丽春红染色检测转移效果。而后,将膜放在10 mL封闭液中(2%脱脂奶粉,TBS (Tris-buffered saline,150 mmol/L NaCl,10 mmol/L Tris-HCl,pH=7.5 配制)1 h; 加入一抗 (1∶1000),4℃过夜孵育;TBST(TBS 含 0.02%Tween)洗 3次,加入二抗 HRP-IgG(1∶10000)室温孵育 2 h;TBST洗膜3次,TBS洗膜1次,暗处发色。发色液现用现配(1 mL 4-氯-1-萘酚(6 mg/mL 甲醇配制),9 mL TBS,6 μL H2O2)。
1.3 统计学方法
采用统计软件SPSS 13.0对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 蛇床子素对BAL蛋白总量的影响
结果显示,ALI 组蛋白总量 [(0.48±0.04)g/L]与Sham组相比急剧增加(P<0.01),当用蛇床子素处理后,BAL蛋白含量显着降低(P<0.05),而高剂量的蛇床子素(200 mg/kg)[(0.26±0.02)g/L]比低剂量的蛇床子素 (100 mg/kg)[(0.33±0.03)g/L]效果更加明显(P < 0.05)。 见图 1。
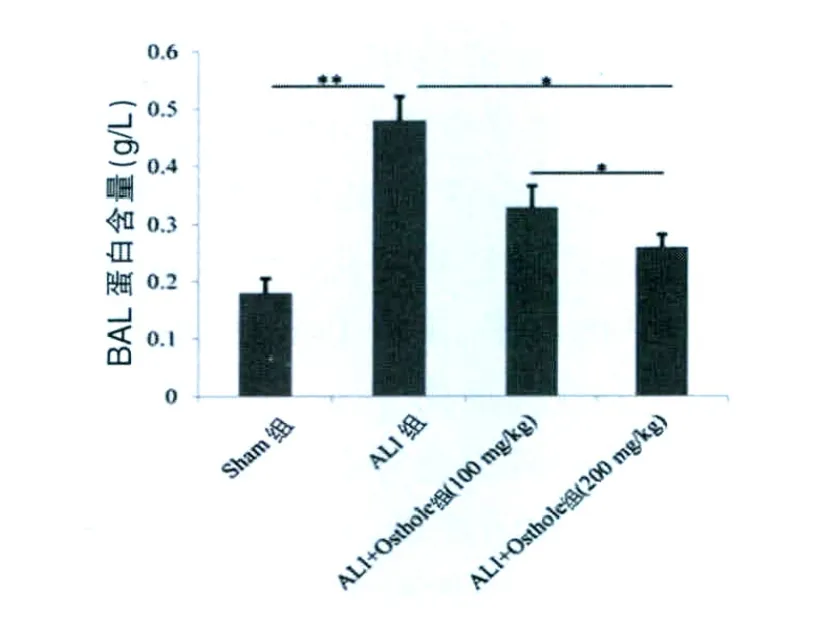
图1 蛇床子素对BAL蛋白总量的影响
2.2 蛇床子素对MPO、SOD和MDA水平的影响
结果显示,ALI组中SOD的水平显着下降,而MDA和MPO的水平则显着升高(P<0.05),说明氧化应激反应在ALI中显着增加,当用蛇床子素处理后,这些异常变化则被显着抑制。见表1。
表1 蛇床子素对氧化应激反应的影响(±s)
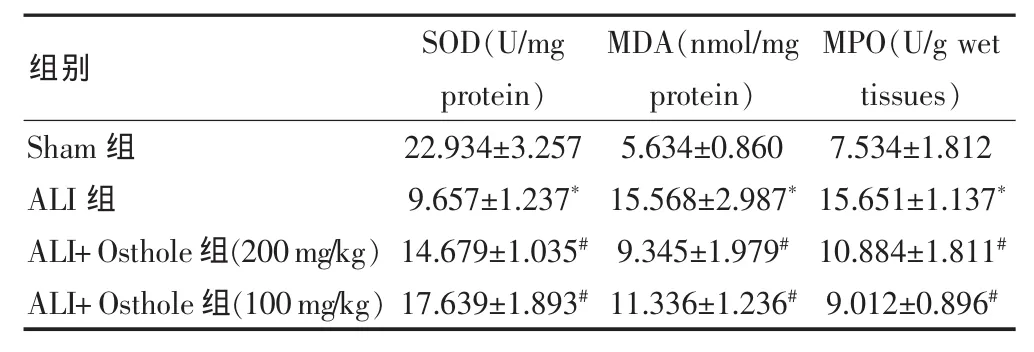
表1 蛇床子素对氧化应激反应的影响(±s)
注:与 Sham 组比较,*P<0.05;与 ALI组比较,#P<0.05;Sham 组:假手术组;ALI:急性肺损伤模型组;ALI+Osthole:蛇床子素处理的急性肺损伤模型组;MPO:髓过氧化物酶;SOD:超氧化物歧化酶;MDA:丙二醛
Sham组ALI组ALI+Osthole组(200mg/kg)ALI+Osthole组(100mg/kg)22.934±3.257 9.657±1.237*14.679±1.035#17.639±1.893#5.634±0.860 15.568±2.987*9.345±1.979#11.336±1.236#7.534±1.812 15.651±1.137*10.884±1.811#9.012±0.896#组别 SOD(U/mg protein)MDA(nmol/mg protein)MPO(U/g wet tissues)
2.3 蛇床子素对细胞因子水平的影响
结果显示,与Sham组相比ALI组中IL-6水平明显升高(P<0.05),当用蛇床子素处理时,IL-6水平明显降低(P<0.05),而TNF-α的水平变化也是相同的趋势(P<0.05),表明蛇床子素可以通过调控促炎因子的水平来抑制炎性反应。见图2。
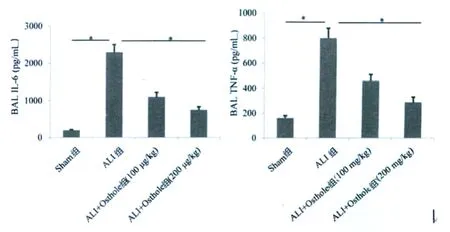
图2 蛇床子素对IL-6和TNF-α水平的影响
2.4 蛇床子素对细胞凋亡的影响
结果显示,急性肺损伤导致活性caspase-3的水平急剧增加,而当蛇床子素处理后,活性caspase-3的水平显着下降,表明蛇床子素对肺组织细胞凋亡具有调控作用。见图3。

图3 蛇床子素对活性caspase-3水平的影响
3 讨论
脓毒症是重ICU患者死亡的最首要的原因,常常导致各器官的损伤,特别是肺最先受到损伤,脓毒症相关的急性肺损伤也是ICU发病率和致死率最高的一种临床疾病[14-16]。急性肺损伤通常由于全身炎性反应失控,导致剧烈的炎性反应,释放大量的炎症因子和介质作用损伤肺泡上皮细胞和微血管内皮细胞,引起血管内蛋白质大量渗出,产生肺泡性水肿和间质性肺水肿,最终引起急性呼吸衰竭[17-18]。如何防治和治疗脓毒症相关的急性肺损伤,降低其发病率和病死率,是现代医学的所面临的难点。中药具有毒性低、安全高、药源充足等特点,因此在治疗脓毒症相关的急性肺损伤中具有潜在的前景。Osthole是从中草药蛇床子中提取的一种成分,其全名为7-甲氧基-8-异戊烯基香豆素。近年来国内外研究学者都对Osthole的药理活性做了广泛的研究,发现其具有抗氧化、抗癌、抗毒、抗菌和抗炎等多种药效功能。本研究以大鼠为模型,主要探讨了Osthole对急性肺损伤的保护相应及其作用的初步机制。
急性肺损伤主要病理变化是肺泡上皮细胞和肺泡微血管通透性显着增高,肺的炎症损伤通常会导致肺泡上皮细胞功能受损,肺泡内的蛋白质渗出,对呼吸功能造成严重的障碍,导致蛋白质的大量外渗。针对肺泡上皮细胞通透性的研究也是当前的热点。有报道称阻断热休克蛋白HSP90的表达,可以显着降低肺泡上皮细胞和微细胞内皮细胞的通透性提高脓毒症大鼠模型的生存率[19-20]。Rac-1的活化可以稳定血管的内皮细胞,降低血管的通透性,对脓毒症大鼠具有显着的保护效应。本实验也表明蛇床子素可以降低急性肺损伤引起的BAL蛋白含量升高的异常变化,对细胞通透性的改善具有显着的效果。为了探究蛇床子素是否对肺泡蛋白质渗出的作用,本研究检测了各实验组BAL蛋白含量的变化情况。结果发现,急性肺损伤组蛋白总量与对照组相比急剧增加 (P<0.01),当用蛇床子素处理后,BAL蛋白含量显着降低 (P<0.05),而高剂量的蛇床子素(200 mg/kg)比低剂量的蛇床子素(100 mg/kg)效果更加明显(P < 0.05)。
细菌感染通常会引起中性粒细胞的浸润和活化,释放大量炎症介质,导致氧化应激反应。活性氧的过量积累导致基因突变和蛋白生活,对细胞功能和机体都造成极大的损害,造成严重的病理结果[21]。急性肺损伤中的氧化应激反应已有大量报道,活性氧的过量积累也是造成肺细胞通透性改变的主要原因[22]。MPO是中性粒细胞的重要标志物,也是重要的过氧化物酶类,其水平与中性粒细胞的活化强度密切相关。因此,通过测定MPO的水平可以反映中性粒细胞的活化和浸润程度。中性粒细胞和相关炎症细胞的活化和浸润,释放大量的促炎症因子例如IL-6和TNF-α,促炎因子通常经过信号通路的转导使炎性反应级联放大,不但加重肺损伤,而且损伤免疫系统[23]。IL-6和TNF-α是许多炎性反应中重要的两种促炎症细胞因子,为了探讨Osthole对促炎因子的影响,本研究检测了BAL中这两种细胞因子水平的变化。氧化应激反应是ALI的重要病理变化,过量的活性氧(ROS)通常会导致基因突变和蛋白。大量中性粒细胞的浸润引起呼吸爆炸,会产生过多的过氧化物。为了探讨Osthole对ALI中氧化应激反应的影响,本研究检测了大鼠肺组织中SOD,脂质氧化产物MDA以及中性粒细胞分泌的标志物MPO。结果发现,Osthole可以显着抑制急性肺损伤引起MPO水平升高,即可以抑制中性粒细胞的活化和浸润,从而可以缓解炎性反应和氧化应激反应。抗氧化剂可以通过清除体内的氧自由基来抑制脓毒性引起的炎性反应[24],而SOD是体内唯一可以清除氧自由基和过氧化物的抗氧化酶,其活性水平是机体抗氧化能力的主要标志。MDA是体内脂质过氧化反应的产物,其水平主要反映体内细胞受到氧自由基攻击的程度[25]。本试验中,还发现在急性肺损伤模型中,SOD水平显着下降,而MDA水平明显升高,表明急性肺损伤引起氧化应激反应,机体的抗氧化能力下降。本结果表明Osthole可以有效的抑制氧化应激反应,提高机体的抗氧化能力。
据报道,绿脓杆菌引起的肺部感染导致内皮细胞的凋亡,是肺部细胞通透性改变的重要原因[26],肺炎症损伤也涉及到细胞凋亡[14],为了进一步探讨Osthole是否对细胞凋亡也有调控作用,本研究检测了肺组织中活性caspase-3的水平变化,结果发现急性肺损伤中肺部组织活性caspase-3的水平明显升高,表明急性肺损伤中细胞凋亡途径被活化[27-30]。Osthole可以抑制活性caspase-3的水平,表明Osthole可以通过调控细胞凋亡来改善急性肺损伤。
综上所述,本研究以急性肺损伤大鼠为模型,探讨研究Osthole对其作用效果。结果发现Osthole可以抑制炎性反应,缓解肺组织的氧化应激反应,降低肺部细胞的凋亡,从而减轻肺组织的损伤和通透性的变化,对急性肺损伤大鼠有显着的保护效应。因此,Osthole对急性肺损伤的作用值得进一步的研究,其作用机制也有待深入的探讨。
[1]Bohannon J,Guo Y, Sherwood ER.The role of natural killer cells in the pathogenesis of sepsis:the ongoingenigma[J].Crit Care,2012,16(6):185.
[2]Riedemann NC,Guo RF,Ward PA.The enigma of sepsis[J].J Clin Invest,2003,112(4):460-467.
[3]Marshall JC.Inflammation, coagulopathy, and the pathogenesis of multiple organ dysfunction syndrome [J].Crit Care Med,2001,29(7):99-106.
[4]Papathanassoglou ED,Bozas E,Giannakopoulou MD.Multiple organ dysfunction syndrome pathogenesis and care:a complex systems'theory perspective [J].Nurs Crit Care,2008,13(5):249-259.
[5]Rubenfeld GD,Caldwell E,Peabody E,et al.Incidence and outcomes of acute lung injury [J].N Engl J Med,2005,353(16):1685-1693.
[6]Zimmerman JJ,Akhtar SR,Caldwell E,et al.Incidence and outcomes of pediatric acute lung injury [J].Pediatrics,2009,124(1):87-95.
[7]Werdan K,Schmidt H,Ebelt H,et al.Impaired regulation of cardiac function in sepsis, SIRS, and MODS [J].Can J Physiol Pharmacol,2009,87(4):266-274.
[8]Andrews P,Azoulay E,Antonelli M,et al.Year in review in intensive care medicine, 2005.Ⅱ.Infection and sepsis, ventilator-associated pneumonia, ethics, haematology and haemostasis, ICU organisation and scoring, brain injury[J].Intensive Care Med,2006,32(3):380-390.
[9]Cheng B,Xie G,Yao S,et al.Epidemiology of severe sepsis in critically ill surgical patients in ten university hospitals in China[J].Crit Care Med,2007,35(11):2538-2546.
[10]孙小兵,叶吉琴.蛇床子素研究进展[J].大众科技,2009(2):132-133.
[11]刘桦,蒋韵,韩英.蛇床子素对小鼠免疫药理作用的研究[J].中草药,1997,28(9):543-545.
[12]杨小红,马福广,梁佩红.复方蛇床子水剂对金黄色葡萄球菌凝固酶活性的影响[J].新中医,2000,32(3):37-38.
[13]Zingarelli B,Sheehan M,Hake PW,et al.Peroxisome proliferator activator receptor-gamma ligands,15-deoxy-Delta(12,14)-prostaglandin J2 and ciglitazone, reduce systemic inflammation in polymicrobial sepsis by modulation of signal transduction pathways[J].J Immunol,2003,171(12):6827-6837.
[14]Petrache I,Verin AD,Crow MT,et al.Differential effect of MLC kinase in TNF-alpha-induced endothelial cell apoptosis and barrier dysfunction [J].Am J Physiol Lung Cell Mol Physiol,2001,280(6):1168-1178.
[15]Martin GS,Mannino DM,Eaton S,et al.The epidemiology of sepsis in the United States from 1979 through 2000[J].N Engl J Med,2003,348(16):1546-1554.
[16]Schlichting D,McCollam JS.Recognizing and managing severe sepsis: a common and deadly threat[J].South Med J,2007,100(6):594-600.
[17]Narasaraju T, Yang E, Samy RP, et al.Excessive neutrophils and neutrophil extracellular traps contribute to acute lung injury of influenza pneumonitis [J].Am J Pathol,2011,179(1):199-210.
[18]Perl M, Lomas-Neira J, Venet F, et al.Pathogenesis of indirect (secondary) acute lung injury [J].Expert Rev Respir Med,2011,5(1):115-126.
[19]Antonov A,Snead C,Gorshkov B,et al.Heat shock protein 90 inhibitors protect and restore pulmonary endothelial barrier function [J].Am J Respir Cell Mol Biol,2008,39(5):551-559.
[20]Chatterjee A,Dimitropoulou C,Drakopanayiotakis F,et al.Heat shock protein 90 inhibitors prolong survival,attenuate inflammation,and reduce lung injury in murine sepsis[J].Am J Respir Crit Care Med,2007,176(7):667-675.
[21]Bhattacharyya J, Biswas S, Datta AG.Mode of action of endotoxin:role of free radicals and antioxidants[J].Curr Med Chem,2004,11(3):359-368.
[22]Ward PA.Oxidative stress:acute and progressive lung injury[J].Ann N Y Acad Sci,2010,1203:53-59.
[23]Grommes J,Soehnlein O.Contribution of neutrophils to acute lung injury[J].Mol Med,2011,17(3-4):293-307.
[24]Suntres ZE,Shek PN.Prophylaxis against lipopolysaccharide-induced acute lung injury by alpha-tocopherol liposomes[J].Crit Care Med,1998,26(4):723-729.
[25]McCord JM,Edeas MA.SOD,oxidative stress and human pathologies:a brief history and a future vision [J].Biomed Pharmacother,2005,59(4):139-142.
[26]Childs EW, Tharakan B, Hunter FA,et al.Apoptotic signaling induceshyperpermeability following hemorrhagic shock [J].Am J Physiol Heart Circ Physiol,2007,292(6):3179-3189.
[27]沈颜红,张建新.异丙酚对油酸性急性肺损伤模型大鼠肺组织细胞凋亡的影响[J].中国药房,2009,20(1):30-32.
[28]马忠伟,王秋玲,魏培玉.关龙胆乙醇提取物在急性肺损伤中的作用研究[J].中国药房,2010,21(11):983-985.
[29]杨爱东,李文雯,王利霞,等.急性肺损伤大鼠肺组织TOLL样受体4及CD14mRNA的表达 [J].中国实验动物学报,2011,19(3):216-219,278.
[30]申东翔,赖添顺,郭振辉,等.大潮气量致急性肺损伤犬呼吸机相关性肺损伤模型的构建 [J].中国实验动物学报,2009,17(4):292-295.



