张东旭 范引科 郭淑云 李穆琼 李晓晔 刘雪英▲
1第四军医大学药学系药物化学与药物分析学教研室,陕西西安 710032;2.陕西省中医药研究院,陕西西安 710003;3.第四军医大学附属唐都医院药剂科,陕西西安 710038
芝麻素为白色针状晶体,是芝麻油中所含的一种木脂素类化合物,是芝麻中的主要活性成分,具有抗高血压、保肝、抗氧化、降低胆固醇等功效[1]。日本东京大学医学院首次研究证实芝麻素具有抗癌功效,对肝癌、皮肤癌均有抑制作用,认为低浓度的芝麻素饮食可能作为肝癌的抑制剂[2]。我国对芝麻的利用仅限于其保健作用,作为临床药物使用的研究极少。为此,我们拟通过抑瘤试验、延长生命试验、免疫试验及增效减毒试验进一步验证其作用,为本品进入临床提供实验依据。
1 仪器与试剂
1.1 仪器
电子天平购自于北京赛多利斯天平厂 (型号:BS210S, 精确度:0.1 mg),Olympus 普通光学显微镜,SW-CJ-2D型双人净化工作台购自于苏州净化设备有限公司生产(型号:NO.0504192%),Taisite 洁净工作台,TDZ4AWS台式低速自动平衡离心机。
1.2 药物及试剂
芝麻素(上海静融生物科技有限公司生产,批号:110836-201005),环磷酰胺(MTX)注射液(江苏恒瑞医药股份有限公司生产,规格:0.2 g,批号:20110903),5-氟脲嘧啶(5-FU)注射液(上海旭东海普药业有限公司生产,规格:10 mL:0.25 g,批号:111033)。
1.3 实验动物及瘤株
ICR小鼠由西安交通大学医学院实验动物中心提供,体重18~22 g,实验动物质量许可证号:SCXK(陕)2007-001。 饲养条件:室温(23±2)℃;日光灯采光,光暗周期 12 h/12 h(光照时间为 7∶00~19∶00);动物自由获取水和食物。小鼠S180肉瘤细胞株由第四军医大学实验动物中心引进。
2 方法与结果
2.1 实验方法
2.1.1 芝麻素对小鼠移植性S180肉瘤生长的影响按文献所述方法[3-5],取ICR小鼠50只(雌雄各半),体重18~22 g,在超净工作台内制备瘤细胞悬液,无菌条件下于小鼠腋下接种瘤细胞悬液0.2 mL,计瘤细胞数约为1×107个/mL。24 h按体重随机分为5组,分别为荷瘤组(常水 10 mL/kg)、环磷酰胺(CTX)40 mg/kg 组和芝麻素 1.0、0.5、0.25 g/kg 剂量组。 接种 S180 瘤细胞后次日开始给药,1次/d,连续给药10 d,末次给药后次日,称体重后处死小鼠,剖取瘤块,计算体重和抑瘤率。试验重复3次。肿瘤抑制率=[(对照组平均瘤重-给药组平均瘤重)/对照组平均瘤重]×100%
2.1.2 芝麻素对S180腹水瘤小鼠生存时间的影响按文献所述方法[5-8],取ICR小鼠50只,雌雄各半,体重18~22 g,在超净工作台内制备瘤细胞悬液,无菌条件下于小鼠腋下接种瘤细胞悬液0.2 mL,计瘤细胞数约为1×107个/mL。24 h按体重随机分为5组,分别为荷瘤组 (常水10 mL/kg)、CTX组40 mg/kg和芝麻素1.0、0.5、0.25 g/kg 剂量组。接种 S180 腹水瘤细胞后次日开始给药。1次/d,连续给药10 d。给药结束后继续观察,记录各组小鼠生存时间,计算生命延长率。实验中对照组7 d内病死率小于20%,无一只生存期超过4周,治疗组观察期以60 d为限。
2.1.3 CTX和5-FU治疗S180荷瘤小鼠的增效作用按文献所述方法[9-11],小鼠90只,雌雄各半25只,体重18~22 g,取生长良好的腹水型肿瘤小鼠,脱臼处死,超净工作台内制备瘤细胞悬液,计瘤细胞数约为1×107个/mL,每只小鼠腋部皮下接种0.2 mL瘤细胞液,即接种2×106个瘤细胞。次日按体重随机分为9组,分别为荷瘤组(常水 10 mL/kg)、芝麻素(0.5 g/kg)组、芝麻素(0.25 g/kg)组、CTX(10 mg/kg)组、5-FU(20 mg/kg)组、芝麻素 0.5 g/kg+CTX 组、芝麻素 0.5 g/kg+5-FU 组、芝麻素 0.25 g/kg+CTX 组、芝麻素 0.25 g/kg+5-FU组。接种S180瘤细胞后次日开始给药,1次/d,连续给药10 d,末次给药后次日,称体重后处死小鼠,剖取瘤块,计算体重和抑瘤率。再根据Nuebb分数乘积法计算芝麻素+CTX组和芝麻素+5-FU组的理论效应值, 即 (Fa)1.2=1-[1-(Fa)1]×[1-(Fa)2],(Fa)1和(Fa)2分别为芝麻素+CTX组和芝麻素+5-FU组的抑瘤率。当合并用药效应大于理论相加效应时,则表示两者间有协同作用。
2.1.4 芝麻素对S180荷瘤小鼠CTX毒性的对抗作用按文献所述方法[12],小鼠72只(雌雄各半),体重18~22 g,取生长良好的腹水型肿瘤小鼠,脱臼处死,超净工作台无菌操作制备瘤细胞液,计数池计数细胞浓度为1×107个/mL,每只小鼠腋部皮下接种0.2 mL瘤细胞液,即接种2×106个瘤细胞。次日按体重随机分为5组,分别为荷瘤组(常水 10 mL/kg)、CTX(40 mg/kg)组和芝麻素 1.0 g/kg+CTX 组、芝麻素 0.5 g/kg+CTX 组和芝麻素0.25 g/kg+CTX组。S180荷瘤接种方法同前。接种S180荷瘤细胞后次日开始给药。1次/d,连续给药10 d。末次给药后次日,自小鼠内眦静脉丛采血,取血20 μL加入到2 mL 2%冰醋酸溶液中摇匀,常规计数外周血白细胞总数。称体重后处死小鼠,剖取瘤块称重,计算抑瘤率。同时剥离左侧股骨,用2%冰醋酸溶液5 mL冲出骨髓内细胞,常规计数细胞总数,即为1根股骨中骨髓有核细胞数。
2.2 统计学方法
采用SPSS 15.0统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2.3 结果
2.3.1 芝麻素对小鼠移植性S180肉瘤生长的影响芝麻素 1.0、0.5 g/kg 剂 量能明显 抑 制 小鼠移 植 性S180 瘤体的生长(P < 0.01),芝麻素 0.25 g/kg剂量对S180瘤体的生长也有一定的抑制作用(P>0.05),表明芝麻素对小鼠移植性S180肉瘤具有一定的抑制作用。见表1。
表1 芝麻素对小鼠移植性S180肉瘤生长的影响(±s)
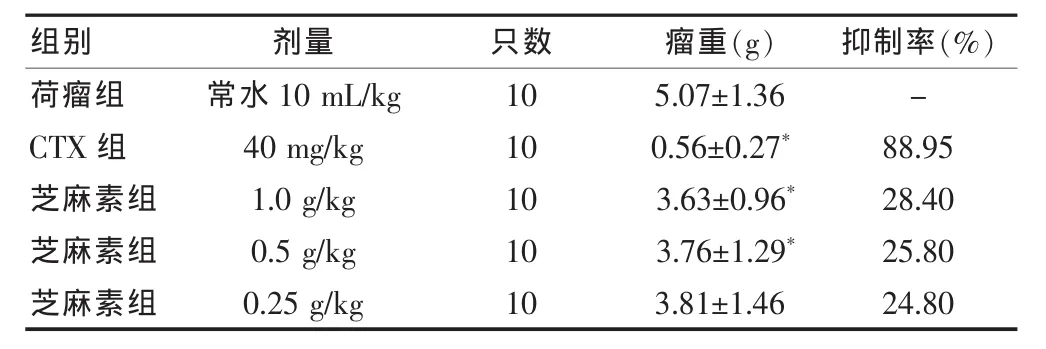
表1 芝麻素对小鼠移植性S180肉瘤生长的影响(±s)
注:与荷瘤组相比,*P < 0.01;CTX:环磷酰胺;“-”表示无数据
荷瘤组CTX组芝麻素组芝麻素组芝麻素组常水10 mL/kg 40 mg/kg 1.0 g/kg 0.5 g/kg 0.25 g/kg 10 10 10 10 10 5.07±1.36 0.56±0.27*3.63±0.96*3.76±1.29*3.81±1.46-88.95 28.40 25.80 24.80组别 剂量 只数 瘤重(g) 抑制率(%)
2.3.2 芝麻素对S180腹水瘤小鼠生存时间的影响芝麻素 1.0、0.5、0.25 g/kg 剂量组和 CTX 组对荷 S180腹水瘤小鼠的平均生命延长率分别为 32.24%、24.18%、17.96%和 78.82%,平均生存时间明显长于荷瘤组(P<0.05)。提示芝麻素能明显延长荷S180腹水癌小鼠的生存时间。见表2。
表2 芝麻素对S180腹水瘤小鼠生存时间的影响(±s)
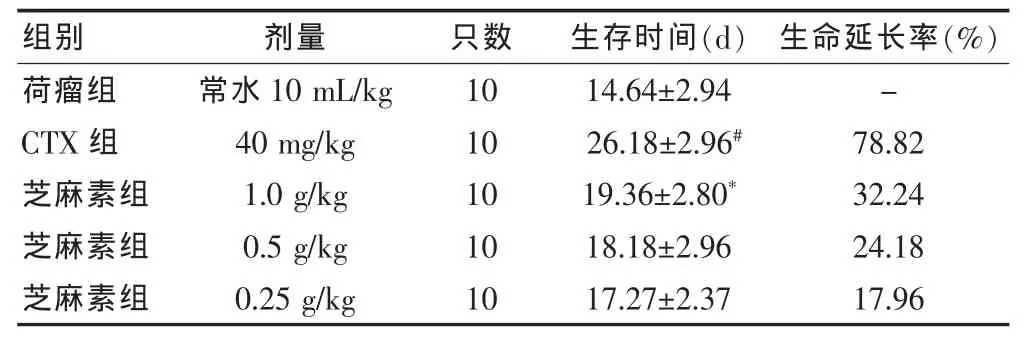
表2 芝麻素对S180腹水瘤小鼠生存时间的影响(±s)
注:与荷瘤组相比,*P﹤0.05,#P < 0.01;CTX :环磷酰胺;“-”表示无数据
荷瘤组CTX组芝麻素组芝麻素组芝麻素组常水10 mL/kg 40 mg/kg 1.0 g/kg 0.5 g/kg 0.25 g/kg 10 10 10 10 10 14.64±2.94 26.18±2.96#19.36±2.80*18.18±2.96 17.27±2.37-78.82 32.24 24.18 17.96组别 剂量 只数 生存时间(d) 生命延长率(%)
2.3.3 CTX和5-FU治疗S180荷瘤小鼠的增效作用单给芝麻素(0.5 g/kg)、CTX (10 mg/kg)及 5-FU(20 mg/kg)时的抑瘤率分别为31.35%、58.81%及63.52%,而5.0g/kg 芝麻素+CTX组和5.0g/kg 芝麻素+5-FU组具有明显的抑瘤作用,抑瘤率分别为73.77%和75.41%,均大于两者合并用药后的理论相加效应值71.72%和74.96%。提示芝麻素与CTX或5-FU联合应用于肿瘤治疗,具有明显的协同增效作用。见表3。单给芝麻素(0.25g/kg)、CTX(10 mg/kg)及 5-FU(20 mg/kg)时的抑瘤 率分别为 22.54%、58.81%及 63.52%,而5.0g/kg芝麻素+CTX 组和 5.0g/kg芝麻素+5-FU 组具有明显的抑瘤作用,抑瘤率分别为71.92%和73.15%,均大于两者合并用药后的理论相加效应值68.10%和71.74%。提示芝麻素与CTX或5-FU联合应用于肿瘤治疗,具有明显的协同增效作用。见表4。
表3 5.0g/kg芝麻素对CTX和5-FU抗小鼠移植性S180肉瘤的增效作用(±s)
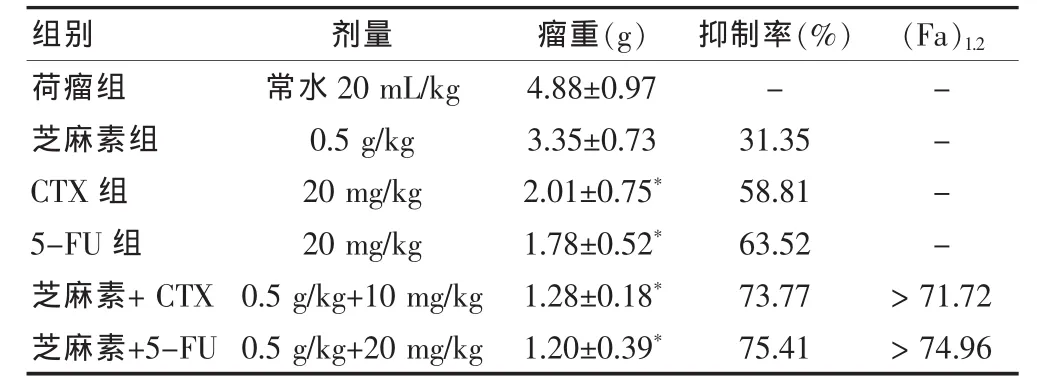
表3 5.0g/kg芝麻素对CTX和5-FU抗小鼠移植性S180肉瘤的增效作用(±s)
注: 与荷瘤组相比,*P < 0.01;CTX: 环磷酰胺;5-FU:5-氟尿嘧啶;“-”表示无数据
荷瘤组芝麻素组CTX组5-FU组芝麻素+CTX芝麻素+5-FU常水20 mL/kg 0.5 g/kg 20 mg/kg 20 mg/kg 0.5 g/kg+10 mg/kg 0.5 g/kg+20 mg/kg 4.88±0.97 3.35±0.73 2.01±0.75*1.78±0.52*1.28±0.18*1.20±0.39*-31.35 58.81 63.52 73.77 75.41----> 71.72> 74.96组别 剂量 瘤重(g) 抑制率(%) (Fa)1.2
表4 0.25g/kg芝麻素对CTX和5-FU抗小鼠移植性S180肉瘤的增效作用(±s)
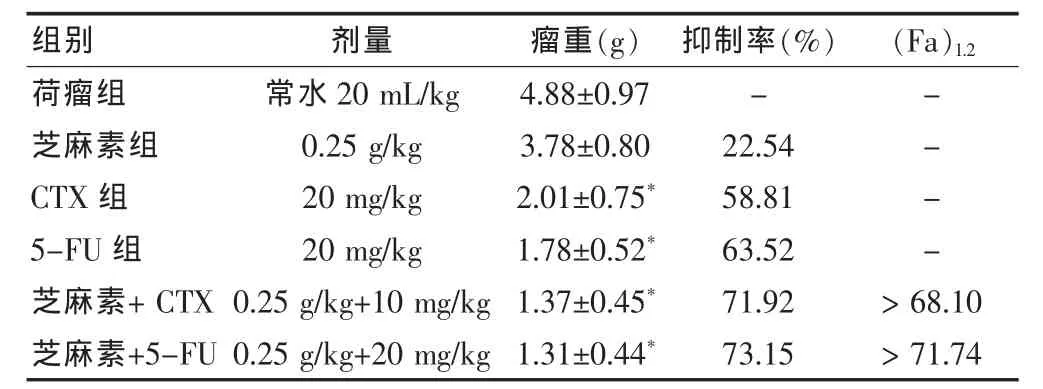
表4 0.25g/kg芝麻素对CTX和5-FU抗小鼠移植性S180肉瘤的增效作用(±s)
注:与荷瘤组相比,*P<0.01;CTX:环磷酰胺;5-FU:5-氟尿嘧啶;“-”表示无数据
荷瘤组芝麻素组CTX组5-FU组芝麻素+CTX芝麻素+5-FU常水20 mL/kg 0.25 g/kg 20 mg/kg 20 mg/kg 0.25 g/kg+10 mg/kg 0.25 g/kg+20 mg/kg 4.88±0.97 3.78±0.80 2.01±0.75*1.78±0.52*1.37±0.45*1.31±0.44*-22.54 58.81 63.52 71.92 73.15----> 68.10> 71.74组别 剂量 瘤重(g) 抑制率(%) (Fa)1.2
2.3.4 芝麻素对S180荷瘤小鼠CTX毒性的对抗作用芝麻素 1.0、0.5、0.25 g/kg 组及 CTX (20 mg/kg)组对S180荷瘤小鼠瘤重均有明显降低作用。芝麻素1.0、0.5 g/kg组可使骨髓有核细胞数明显回升(P < 0.05)。芝麻素 1.0、0.5、0.25 g/kg 组可使外周血白细胞数有明显的回升(P<0.05)。CTX可使荷瘤小鼠的骨髓有核细胞数和外周血白细胞数明显降低 (P<0.01),提示芝麻素对CTX有一定的减毒作用。见表5、6。
表5 芝麻素对S180荷瘤小鼠CTX毒性的对抗作用(±s)

表5 芝麻素对S180荷瘤小鼠CTX毒性的对抗作用(±s)
注:与荷瘤组相比,*P < 0.01;CTX:环磷酰胺;“-”表示无数据
荷瘤组CTX组芝麻素+CTX芝麻素+CTX芝麻素+CTX常水10 mL/kg 40 mg/kg 1.0 g/kg+20 mg/kg 0.5 g/kg+20 mg/kg 0.25 g/kg+20 mg/kg 12/12 12/12 12/12 12/12 12/12 2.49±0.79 0.52±0.13*0.66±0.21*0.73±0.36*0.79±0.27*-79.12 73.49 70.68 68.27组别 剂量 只数(始/末) 瘤重(g) 抑制率(%)
3 讨论
本实验研究了芝麻素对S180荷瘤小鼠的抑癌作用,以及CTX和5-FU治疗S180荷瘤小鼠的增效作用和毒性的抑制作用,实验结果表明,低浓度的芝麻素对S180细胞的生长有一定的抑制作用,能过抑制小鼠移植性S180肉瘤的生长,同时能明显延长荷S180腹水癌小鼠的生存时间;芝麻素与CTX或5-FU联合应用于肿瘤治疗,具有明显的协同增效作用;芝麻素可使骨髓有核细胞数和外周血白细胞数明显回升,与CTX联合应用于肿瘤治疗可在增效的同时,对CTX有一定的减毒作用。
表6 芝麻素对荷S180小鼠CTX的减毒作用(±s)
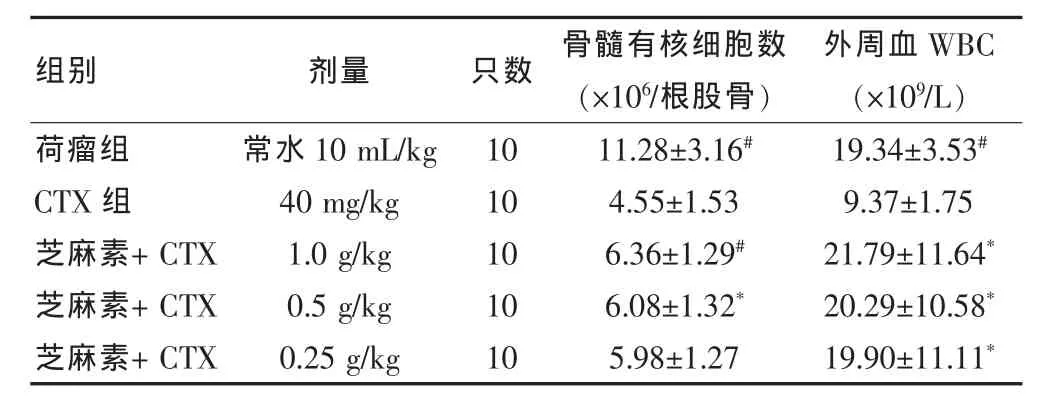
表6 芝麻素对荷S180小鼠CTX的减毒作用(±s)
注:与 CTX 组相比, *P<0.05,#P<0.01;CTX:环磷酰胺
荷瘤组CTX组芝麻素+CTX芝麻素+CTX芝麻素+CTX常水10 mL/kg 40 mg/kg 1.0 g/kg 0.5 g/kg 0.25 g/kg 10 10 10 10 10 11.28±3.16#4.55±1.53 6.36±1.29#6.08±1.32*5.98±1.27 19.34±3.53#9.37±1.75 21.79±11.64*20.29±10.58*19.90±11.11*组别 剂量 只数 骨髓有核细胞数(×106/根股骨)外周血WBC(×109/L)
芝麻作为天然植物在我国分布广泛、资源丰富,《神农本草经》记载,芝麻具有“伤中虚赢,补五内、益气力、长肌肉、填精益髓”的作用,我国自古以来就有将芝麻作为保健品用于食疗的习俗,但作为治疗药物使用的研究极少。目前芝麻素的提取纯度已高达99%,日后芝麻素的临床研究及应用会日益深入。
[1]张世卿,张永城.芝麻素的研究进展[J].氨基酸和生物资源,2005,27(3):1-20.
[2]沈旭丽.芝麻的营养成分及保健价值[J].中国食物与营养,2006,(7):51-55.
[3]宋延平,姚养正,朱自平,等.万锁消癌胶囊抗肿瘤作用研究[J].西北药学杂志,2001,16(3):115-117.
[4]崔海兰,李佩文,贾立群,等.平肺口服液对肺癌恶病质小鼠的免疫调节作用[J].中医药学刊,2007,25(4):101-103.
[5]兰英,房金波,张维晶,等.核桃楸青果皮(GPJM)水提物诱生小鼠肿瘤坏死因子的实验研究[J].东北师大学报:自然科学版,2003,35(1):78-81.
[6]胡宝瑜,张炳舟,朱佑明,等.全血诱生TNF检测法[J].上海免疫学杂志,1991,11(1):58-60.
[7]叶加,钱百文.理气药对荷瘤小鼠TNF和NK细胞活性的影响[J].中草药,1995,(5):272-274.
[8]刘巍,张晓彬,李雅,等.苦马豆素的抑瘤和免疫增强作用[J].西北药学杂志,2006,21(6):258-260.
[9]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:750-782.
[10]周金黄.中药免疫药理学[M].北京:人民军医出版社,1994:266-269.
[11]陈金生.双灵固本散对恶性肿瘤放化疗的增效作用[J].浙江中医杂志,2007,4(4):241-244.
[12]袁国红,庞晓静,马鹤超.当归补血汤对荷瘤小鼠的影响及对环磷酰胺化疗的增效减毒作用[J].中西医结合学报,2008,6(1):83-88.
[13]田卫卫,李偶,黄映红,等.补虚化瘀方对联合化疗荷瘤小鼠骨髓造血功能的影响[J].中药新药与临床药理,2003,14(1):79-81.



