陈 晶 李 丽 叶月芳
杭州师范大学附属医院消化内科,浙江杭州310015
青蒿琥酯对非酒精性脂肪炎大鼠肝组织中过氧化物酶体增殖物激活受体γ和固醇调节元件结合蛋白-1c表达的影响
陈 晶 李 丽 叶月芳
杭州师范大学附属医院消化内科,浙江杭州310015
目的探讨青蒿琥酯对非酒精性脂肪性肝炎(NASH)大鼠肝组织过氧化物酶体增殖物激活受体γ(PPARγ)和固醇调节元件结合蛋白-1c(SREBP-1c)表达的影响。方法采用高脂饲料喂养的方法复制大鼠NASH模型,实验分正常组、模型组、易善复组、青蒿琥酯低剂量组、中剂量组和高剂量组。正常组每天予以标准饲料喂养,正常组和模型组给予同等剂量的生理盐水。给药治疗8周后,提取肝组织,运用免疫组化方法测定各组大鼠肝组织PPARγ、SREBP-1c蛋白表达情况;采用硫代巴比妥酸法测定丙二醛(MDA)含量;采用黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)含量;采用分光光度法测定谷胱甘肽-过氧化物酶(GSH-Px)含量;光镜观察肝脂肪变、炎症及纤维化程度。结果与正常组相比,在模型组中不仅PPARγ蛋白表达(1.67±1.01)明显减少,而且SREBP-1c蛋白表达(3.27±1.03)明显增多(均P<0.01);青蒿琥酯低中剂量组与模型组相比,PPARγ蛋白表达增多,SREBP-1c蛋白表达明显减少,并且呈剂量依赖性(均P<0.05),青蒿琥酯高剂量组PPARγ为(3.21±1.02),SREBP-1c为(1.32±0.77),与模型组相比,差异均有高度统计学意义(P<0.01)。与模型组相比,青蒿琥酯各剂量组能提高SOD和GSH-Px的含量,降低MDA的含量,并且呈剂量依赖性(均P<0.05);青蒿琥酯能明显改善大鼠肝组织脂肪变、炎症程度和肝纤维化程度。结论青蒿琥酯治疗大鼠NASH的机制可能与上调PPARγ和下调SREBP-1c的表达有关。
青蒿琥酯;非酒精性脂肪性肝炎;过氧化物酶体增殖物激活受体γ;固醇调节元件结合蛋白-1c
1 仪器与试药
1.1 仪器
Leica2235轮转式切片机(德国),Biofuge 28RS低温高速离心机(德国Heraeus公司),OlympasB41显微镜(日本Olympas),生物安全柜(Thermo scienrific,1384),数显立式高压灭菌锅(上海博讯实业有限公司,YXQ-LS-30SⅡ),低温冰箱(Thermo scientific,MDF-U538-C)和纯化水制水系统(象山和信制药设备有限公司,FST-2B型)。
1.2 试药
青蒿琥酯(广西桂林制药二厂,批号:010901)、易善复(赛诺菲安万特制药有限公司,批号:D1157),丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽-过氧化物酶(GSH-Px)试剂盒(南京建成生物工程研究所,批号分别为:A001-2,ba8150,20100107)。SREBP1兔抗(Santa Cruz Biotechnology,批号:C0907);Envision二步法免疫组化试剂盒(丹麦Dako公司,批号:00029661)。
1.3 实验动物
SPF级雄性SD大鼠购自浙江省医学科学院实验动物中心(动物许可证号SCXK浙-20080033)。大鼠普通饲料及高脂饲料由浙江省医学科学院实验动物中心加工生产,高脂饲料配方为:普通饲料82%、蛋黄粉5%、猪油10%、胆固醇2%、胆盐1%。
2 方法
2.1 实验分组
首先,在勘测设计全过程中,非数字化信息较多,主要包括外业勘测和勘探资料。内业设计中存在较多各专业之间、上下工序之间的接口资料,这些非数字化信息的影响与一体化和智能化目标的实现相差甚远,需要较多的时间和精力来进行整理。其次,勘测和设计数据尚未形成统一的格式和标准,各专业和工序之间存在独立性,很难实现统一管理和共享。最后,基于管理者视角,在整个勘测设计的计划管理和质量管理等方面,仍然采用传统的方法,计算机技术的优势尚未充分发挥出来[1]。
95只SD大鼠经适应性饲养1周后,随机分为正常组15只(每天予以标准饲料喂养),造模组80只(每天予以高脂饲料喂养),连续喂养12周;第12周结束后随机在造模组中处死5只。取肝脏进行病理切片检查HE染色法,评定非酒精性脂肪性肝炎程度,对已成模的大鼠分成5组,每组15只,分别是模型组、易善复组、青蒿琥酯低、中和高剂量组;青蒿琥酯低、中和高剂量组青蒿琥酯分别按5、15、45 mg/g剂量每日灌胃;易善复组给予易善复按300mg/g剂量每日灌胃;正常组和模型组给予同等剂量的生理盐水,给药治疗8周后,处死各组大鼠,迅速取肝右叶中部切取数块肝组织,立即投入液氮中冻存,3 h后移入-80℃冰箱中保存备用。
2.2 各组大鼠肝组织MDA、SOD和GSH-Px含量测定
过氧化脂质降解产物中的MDA可与硫代巴比妥酸缩合,形成红色产物,在532 nm处有最大吸收峰。取各组动物血清,严格按试剂盒说明书操作,稀释倍数为1倍,上样量为10μL,MDA含量公式为:血清中MDA的含量(nmol/mL)=标准品浓度(10 nmol/mL)+样本测试前稀释倍数。
通过黄嘌呤和XOD反应系统产生O2-,O2-氧化羟胺形成亚硝酸盐(NO2-),同时在显色剂的作用下呈现紫红色,测定其吸光度。通过公式计算出被测样品中SOD活力:血浆中总SOD活力(U/mL)=÷50%×反应体系的稀释倍数×样本测试前。
根据酶促反应中谷胱甘肽(GSH)的消耗,可以求出酶的活力然后取各组动物血清,严格按照说明书操作,稀释倍数为30倍,通过公式测定血清中GSH-PX含量。公式为:血清GSH-Px活力(U/mL)=×标准管浓度(20μmol/L)×稀释倍数(6)×样本测试前的稀释倍数。
2.3 肝组织病理
常规HE染色观察肝组织脂肪变、炎症及纤维化程度。病理诊断标准参考中华医学会学分会脂肪肝和酒精性肝病学组2006年2月修订的《酒精性肝病诊疗指南》[3]。
2.4 肝组织免疫组化
取上述石蜡标本切片,采用免疫组化二步法进行免疫组化染色。每张切片于阳性表达区域选择10个无重叠视野,阳性细胞表现为胞浆或胞核呈棕黄色颗粒。着色细胞阳性范围:无着色为0分,着色阳性细胞小于1/3为1分,着色阳性细胞1/3~1/2为2分,着色阳性细胞大于1/2为3分;将每张切片着色程度与着色细胞阳性范围得分各自相加取平均值为其最后计分。
2.5 统计学方法
采用统计软件SPSS 18.0对实验数据进行分析,计量资料数据以均数±标准差(x±s)表示,两组独立样本采用t检验,多组比较采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠肝组织MDA、SOD和GSH-Px含量测定结果
与正常组相比,模型组大鼠肝组织MDA显着增加,差异有统计学意义(P<0.05);与模型组比较,青蒿琥酯各剂量组大鼠肝组织MDA显着下降并且呈剂量依赖性,差异有统计学意义(P<0.05);与正常组比较,模型组大鼠肝组织SOD和GSH-Px显着降低,差异有统计学意义(P<0.05);与模型组比较,青蒿琥酯各剂量组大鼠肝组织SOD和GSH-Px显着增加并且呈剂量依赖性,差异有统计学意义(P<0.05)。结果见表1。
3.2 各组大鼠肝脏组织HE染色结果
光镜下,正常组大鼠肝脏肝小叶轮廓清晰,结构正常,细胞索排列整齐,肝细胞呈无明显病变,核结构清晰。模型组大鼠肝组织可见中到重度脂肪肝,肝索出现紊乱,胞质疏松可见大小不一的脂滴空泡,肝小叶内出现点状坏死,汇管区有炎症细胞浸润;青蒿琥酯组可见轻度到中度脂肪变,细胞肿胀,胞浆内可见大小不等的脂肪空泡,肝小叶未见明显炎症细胞浸润。见封三(图1)。
表1 青蒿琥酯对大鼠脂肪性肝炎肝组织指标的影响(±s)
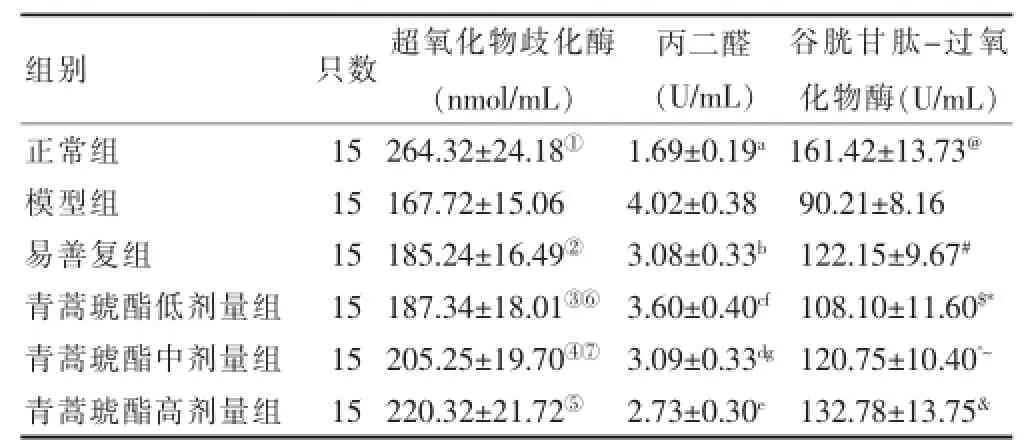
表1 青蒿琥酯对大鼠脂肪性肝炎肝组织指标的影响(±s)
注:超氧化物歧化酶:与模型组比较,t=0.423,①P=0.026<0.05;t= 27.58,②P=0.019<0.05;t=29.08,③P=0.041<0.05;t=71.2,④P=0.017<0.05;t=65.91,⑤P=0.027<0.05;与青蒿琥酯高剂量组比较,t=6.197,⑥P= 0.023<0.05;t=7.041,⑦P=0.011<0.05。丙二醛:与模型组比较,t= 0.278,aP=0.012<0.05;t=30.031,bP=0.020<0.05;t=30.08,cP=0.017<0.05;t=30.236,dP=0.033<0.05;t=30.872,eP=0.043<0.05;与青蒿琥酯高剂量组比较,t=1.226,fP=0.037<0.05;t=6038,gP=0.016<0.05。谷胱甘肽-过氧化物酶:与模型组比较,t=1.253,@P=0.044<0.05;t=13.006,#P= 0.035<0.05;t=12.305,$P=0.019<0.05;t=11.092,^P=0.017<0.05;t= 30.481,&P=0.010<0.05;与青蒿琥酯高剂量组比较,t=6.842,*P=0.031<0.05;t=7.041,~P=0.029<0.05
?
3.3 各组大鼠肝脏组织免疫组化结果
采用免疫组化二步法进行免疫组化染色,PPARγ主要定位于肝细胞核内,呈棕黄色颗粒主要分布在汇管区周围肝细胞胞核内;与正常组相比,模型组PPARγ阳性表达细胞明显减少(P<0.05);青蒿琥酯中、低剂量组与模型组相比,PPARγ阳性表达细胞增多,并且呈剂量依赖性(均P<0.05),青蒿琥酯高剂量组和模型组相比差异有高度统计学意义(P<0.01);SREBP-1c表达于胞浆质中,可见肝细胞质中散在分布浅黄色颗;与正常组相比,模型组SREBP-1c阳性表达增强细胞质中可见大量棕褐色颗粒沉积,同时大部分细胞核也呈阳性着色,两组比较差异有统计学意义(P<0.05);青蒿琥酯中、低剂量组与模型组相比,SREBP-1c阳性表达细胞减少,并且呈剂量依赖性减少,青蒿琥酯高剂量组和模型组相比差异有高度统计学意义(P<0.01)。见封三(图2、3),表2。
4 讨论
青蒿素是从植物黄花蒿中提取得到的一种内酯化合物。青蒿素及其衍生物具有抗病毒、抗肿瘤和免疫抑制等多方面药理作用。青蒿琥酯为青蒿素水溶性的衍生物[4]。有学者发现青蒿琥酯对醋氨酚(AAP)与四氯化碳(CCl4)引起的小鼠急性肝损伤有保护作用[5-6];来丽娜等[4]发现青蒿琥酯能降低牛血清白蛋白致大鼠肝纤维化程度。因此,本实验初步探讨青蒿琥酯是否能通过PPARγ和SREBP-1c途径阻断NASH的形成。
氧化应激与脂质过氧化是“二次打击”学说的核心环节。正常情况下肝线粒体与内质网在脂肪酸β氧化过程中产生大量的活性氧(reactive oxygen species,ROS),使氧化和抗氧化处于动态平衡。在病理情况下,肝细胞内一旦ROS的过量产生与抗氧化能力降低,能促使氧化物与抗氧化物之间的动态平衡失调,从而导致脂质过氧化,很容易导致氧化应激状态[7]。SOD是体内一种重要的自由基清除剂,能够平衡机体的ROS,避免超氧阴离子自由基浓度过高时引起的不良反应。脂质过氧化终产物MDA可形成蛋白加合物,刺激机体产生抗体介导的免疫损伤[8]。GSH-Px是机体内存在的一种含硒抗氧化酶,它能特异性地催化GSH对H2O2的还原反应,进而清除H2O2,从而起到保护细胞膜结构和功能完整的作用。如果过氧化氢酶(CAT)在肝脏中含量极高,可以促使H2O2分解为分子氧和水,从而使细胞免于遭受H2O2的损害[9]。因此,提高SOD、GSH-Px活性与降低肝MDA含量对抗氧应激状态,提高肝脏抗氧化能力。本研究结果表明青蒿琥酯可通过增加机体SOD和GSH-Px活性,增强机体抗氧化能力,加速自由基的清除,抑制脂质过氧化反应,清除过量的MDA,从而保护肝脏的结构和功能。
表2 各组大鼠肝组织过氧化物酶体增殖物激活受体γ和固醇调节元件结合蛋白-1c蛋白表达(s)
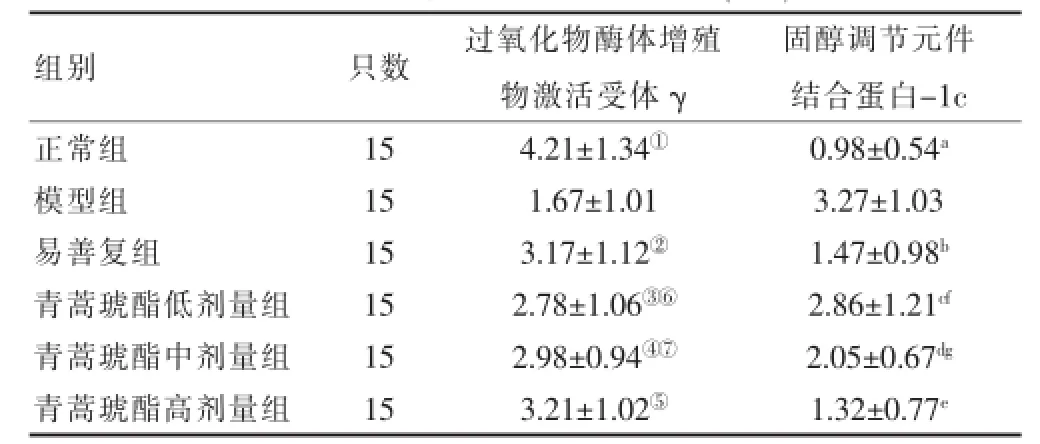
表2 各组大鼠肝组织过氧化物酶体增殖物激活受体γ和固醇调节元件结合蛋白-1c蛋白表达(s)
注:过氧化物酶体增殖物激活受体γ:与模型组比较,t=0.116,①P= 0.028<0.05;t=2.307,②P=0.015<0.05;t=2.025,③P=0.013<0.05;t= 5.062,④P=0.042<0.05;t=3.801,⑤P=0.0012<0.01;与青蒿琥酯高剂量组比较,t=0.402,⑥P=0.016<0.05;t=0.019,⑦P=0.013<0.05。固醇调节元件结合蛋白-1c:与模型组比较,t=0.231,aP=0.014<0.05;t=3.046,bP= 0.025<0.05;t=10.905,cP=0.038<0.05;t=11.206,dP=0.022<0.05;t= 9.401,eP=0.0025<0.01;与青蒿琥酯高剂量组比较,t=0.146,fP=0.015<0.05;t=0.401,gP=0.042<0.05
组别只数过氧化物酶体增殖物激活受体γ固醇调节元件结合蛋白-1c正常组模型组易善复组青蒿琥酯低剂量组青蒿琥酯中剂量组青蒿琥酯高剂量组15 15 15 15 15 15 4.21±1.34①1.67±1.01 3.17±1.12②2.78±1.06③⑥2.98±0.94④⑦3.21±1.02⑤0.98±0.54a3.27±1.03 1.47±0.98b2.86±1.21cf2.05±0.67dg1.32±0.77e
PPAR有3种亚型分别为α、β、γ,其中PPARγ是由多种脂肪酸及其衍生物激活,是胰岛素细胞间信号传递和脂肪细胞基因表达的主要调控者,参与了脂代谢的调节及脂肪细胞分化,因此在NAFLD中起着重要作用[10]。SREBPs是一类膜连接蛋白,其位于内质网上。SREBP-1也是一种核转录因子,SREBP-1c是其中一个亚型,它主要参与糖代谢和脂肪酸的代谢,是脂肪合成基因转录的主要调节因子,与脂肪变性有密切联系[11]。本实验从蛋白水平结果显示:PRARγ和SREBP-lc与肝细胞病变程度有很好的一致性关系,两者可能协同作用参与并促进了非酒精性脂肪性肝病的发生、发展。进一步验证青蒿琥酯抑制PRARγ和SREBP-lc的不适当表达可能是预防和治疗NASH的一条有效途径。
[1]Duvnjak M,Leroti I,BarsiN,etal.Pathogenesisandmanagementissues for nonalcoholic fatty liver disease[J].World J Gastroenterol,2007,1(3):4539-4550.
[2]Day CP.Pathogenesis of steatohepatitis[J].Best Pract Res Clin Gastroenterol,2002,1(6):663-678.
[3]中华医学会肝病学分会脂肪肝和酒精性肝病学组.酒精性肝病诊疗指南[J].中华肝脏病杂志,2006,14(3):164-166.
[4]来丽娜,任泽恩,宋晓亮,等.青蒿琥酯对肝纤维化大鼠肝脏基质金属蛋白酶-2表达的影响[J].中国实验方剂学杂志,2013,19(11):264-267.
[5]Arthur MJ.Matrix degradation in the liver[J].In liver,1990,10(1):47-55.
[6]Herbst H,Wege T,Milani S,et al.Tissue inhibitor ofmetalloproteinase-1 and-2 RNA expression in rat and human liver fibrosis[J].Am JPathol,1997,150:1647-1659.
[7]郑海音,赵锦燕,刘艳,等.粗叶悬钩子总生物碱对大鼠非酒精性脂肪肝病的抗氧化作用研究[J].中国中药杂志,2011,36(17):2383-2387.
[8]王一平,谭华炳,王记红,等.非酒精性脂肪性肝病兔肝组织甘油三酯、丙二醛、超氧化物歧化酶与血浆内皮素的关系[J].中华临床医师杂志,2011,5(4):971-974.
[9]王晶宇,马笑燕,夏苗,等.藏药柳茶提取物对非酒精性脂肪肝病大鼠肝脏保护作用及其机制研究[J].中国临床药理学杂志,2011,27(3):191-194.
[10]Mcirhacghc A,Fajas I,Gouilleux F,etal.A functionalpolymorphism in a STA5B site ofhuman PPAR gamma 3 gene promoter affects height and lipid metabolism in a French population[J].Arterioscler Thromb Vasc Biol,2003,23(2):289.
[11]Shimomura I,Shimano H,Horton JD,etal.Differentialexpression of exons la and lc in Mrna for sterol regulatory element binding protein-1 in human and moumse organs and cultured cells[J].JClin Invest,1997,9(9):838.
Effects of artesunate on expressions of peroxisome proliferators activated receptorγand sterol regulatory element binding protein-1c in the hepatic tissue of the ratsw ith nonalcoholic steatohepatitis
CHEN Jing LILi YE Yuefang
Department of Gastroenterology,the Affiliated Hospital of Hangzhou Normal University,Zhejiang Province,Hangzhou 310015,China
Objective To explore the influence of artesunate upon expressions of peroxisome proliferator-activated receptorγ(PPARγ)and sterol regulatory element binding protein-1c(SREBP-1c)in the hepatic tissue of the rats with nonalcoholic steatohepatitis(NASH).M ethods High-fat diets were used in male SD rats to induce NASH.Rats were divided into six groups:normal group,model group,Essentiale Forte N group,artesunate low-dose group,moderatedose group and high-dose group.Standard feed was used to the normal group every day.Equal volume of normal saline was applied to the normal group and themodel group.After artesunate treatment for 8 weeks,the hepatic tissues of the rats were extracted,and the expressions of PPARγand SREBP-1c in them were detected by immunohistochemistry assay.The contents ofmalondialdehyde(MDA)wasmeasured with thiobarbituric acid assay,the contents of superoxide dismutase(SOD)was measured by xanthine oxidase assay,and the contents of GSH-Px was measured by spectrophotometry.The presence of hepatic fatty degeneration and the degree of inflammation and fibrosis were observed with lightmicroscope.Resu lts Not noly the expression of PPARγdecreased(1.67±1.01)significantly but also the expression of SREBP-1c increased(3.27±1.03)significantly in themodel group compared with those of the normal group(all P<0.05).The expression of PPARγincreased and the expression of SREBP-1c decreased in a dosedependentmanner in the artesunate low and moderate-dose groups compared with those of themodel group.The expression of PPARγwas(3.21±1.02)and the expression of SREBP-1c was(1.32±0.77)in the artesunate high-dose group,which had significant differences compared to those of the model group(all P<0.01).In the artesunate groups,both the contents of SOD and GSH-Px increased and the content of MDA decreased in a dose-dependent manner compared to those of the model group.Both the fatty degeneration and the degree of inflammation and hepatic fibrosis in rats were improved markedly by artesunate. Conclusion The mechanism of artesunate curing rat NASH may be associated with the up-regulation of PPARγ expression and the down-regulation of SREBP-1c expression.
Artesunate;Nonalcoholic steatohepatitis;Peroxisome proliferator-activated receptorsγ;Sterol regulatory element binding protein-1c
R575.1
A
1673-7210(2014)08(b)-0004-04
2014-04-30本文编辑:卫轲)
国家自然科学基金资助项目(编号81200284)。
李丽(1961.11-),女,河北石家庄人,主任医师;研究方向:消化道出血的诊断和治疗。



