常静 马明 林莉莉
[摘要] 目的 探讨缺血性脑卒中与4-羟基壬烯醛(4-HNE)的相关性。 方法 选择脑卒中倾向的自发性高血压大鼠和自发性高血压大鼠,检测4-HNE在大脑皮层和血清中的表达水平,观察其与大鼠生存时间的关系;同时检测缺血性脑卒中患者和对照人群血浆4-HNE水平及其在急性期和慢性期的变化。 结果 与自发性高血压大鼠相比,脑卒中倾向的自发性高血压大鼠大脑皮层和血清的4-HNE表达明显升高(P < 0.01),且4-HNE水平与大鼠生存时间呈负相关(r=-0.602 08,P < 0.01);脑卒中患者血浆4-HNE水平较正常人群升高(P < 0.01),且慢性期患者较急性期患者有降低的趋势(P < 0.05)。 结论 缺血性脑卒中时4-HNE升高,4-HNE水平与缺血性脑卒中具有相关性。
[关键词] 4-羟基壬烯醛;缺血性脑卒中;脑卒中倾向自发性高血压大鼠
[中图分类号] R363 [文献标识码] A [文章编号] 1673-7210(2015)09(c)-0026-04
[Abstract] Objective To investigate the correlation between ischemic stroke and 4-hydroxynonenal (4-HNE). Methods Stroke prone spontaneously hypertensive rat (SHR-SP) and spontaneously hypertensive rat (SHR) were observed in this research. 4-HNE was detected in cerebral cortex and serum, and the relationship between 4-HNE level and lifespan was observed. Also the changes of plasma 4-HNE in patient with ischemic stroke in acute-period and chronic-period and control person were detected. Results Compared to SHR rats, the cortex and serum 4-HNE levels were significantly higher in SHR-SP rats (P < 0.01). Serum 4-HNE level significantly and inversely correlated with the survival time of SHR-SP (r=-0.602 08,P < 0.01). Stroke patients in acute period and chronic period had significantly elevated levels of 4-HNE than the control subjects (P < 0.01). 4-HNE in chronic stroke patients was lower than acute stroke patients (P < 0.05). Conclusion 4-HNE increases in ischemic stroke and there is a correlation between ischemic stroke and 4-HNE.
[Key words] 4-hydroxynonenal; Ischemic stroke; Stroke prone spontaneously hypertensive rat
脑缺血时病理过程极为复杂,缺血损伤后脑组织发生能量代谢紊乱、中枢神经递质紊乱、氧化应激损伤、炎性反应等改变,使神经元发生复杂病理生理改变而凋亡[1-3]。近年来,氧化应激学说已成为缺血性卒中研究的热点,缺氧可使组织生成大量氧自由基,作用于细胞膜上的不饱和脂肪酸,使膜脂质产生过氧化反应,进而导致细胞损伤,并形成脂质过氧化物。4-羟基壬烯醛(4-hydroxynonenal,4-HNE)是脂质过氧化反应醛基产物中最具代表性的物质[4],在脑缺血时4-HNE如何变化,其是否是脑缺血损伤的危险因素?目前研究甚少,本课题就缺血性脑卒中与4-HNE的相关性进行了基础和临床研究,对临床采取有效的防治措施有重要意义。
1 材料与方法
1.1 实验动物与试剂
雄性京都种大鼠(Wistar Kyoto rat,WKY rat),体重250~300 g,购自上海斯莱克动物实验中心,清洁级,动物合格证号SCXK(沪)2007-0005;自发性高血压大鼠(spontaneously hypertensive rat,SHR)以及脑卒中倾向的自发性高血压大鼠(stroke prone spontaneously hypertensive rat,SHR-SP)均由第二军医大学药理教研室赠予。4-HNE标准品和人4-HNE一抗购自Sigma公司,大鼠4-HNE酶联免疫吸附测定(ELISA)试剂盒购自WEIAO生物技术有限公司。实验动物按种属不同分为WKY组、SHR组和SHR-SP组。
1.2 人群选择
以无锡市人民医院脑梗死发生后0~3 d为脑卒中急性期患者(23例),脑梗死发生后3~6个月为慢性期患者(13例),以年龄、性别等基本社会特征及健康信息相匹配人群为对照(30名),观察脑梗死患者及对照人群血浆4-HNE水平。
1.3 Western blot分析
取6月龄WKY、SHR和SHR-SP大鼠的大脑皮层组织,提取蛋白定量后,各组取等量蛋白加入上样缓冲液并变性,行SDS-PAGE垂直电泳、转膜、牛奶封闭,分别加4-HNE一抗(内参照为GAPDH抗体),4℃孵育过夜,二抗孵育,奥德赛红外扫膜仪扫描定量,观察4-HNE在WKY、SHR和SHR-SP大鼠大脑皮层中的表达。
1.4 大鼠血清4-HNE检测
3、6月龄大鼠眼眶取血约1.5 mL,3000 r/min离心15 min,取上清。每孔加入底物工作液100 μL和酶标抗体工作液10 μL,各孔加入标准品或待测样品20 μL。振荡混匀后将反应板置37℃ 15 min后,每孔加入100 μL终止液,混匀,30 min内用酶标仪在490 nm处测吸光值。以标准品4000、2000、1000、500、250、125、62.5、0 ng/mL为横坐标,OD值为纵坐标,绘出标准曲线。根据样品OD值计算出相应4-HNE含量。
1.5 人血浆中4-HNE检测
BCA测定血浆蛋白浓度,用PBS调整浓度至10 μg/mL。每孔加入100 μL样品或标准品,4℃过夜,PBS清洗3次,甩干;每孔再加入200 μL Assay Diluent,摇床摇晃1~2 h,Wash Buffer 清洗3次,甩干;每孔加入100 μL抗4-HNE抗体,室温孵育1 h,PBS清洗3次,每孔加入100 μL二抗HRP conjugate,室温孵育1 h,PBS清洗3次;每孔加入100 μL底物反应液,孵育10 min。密切观察颜色变化,当颜色变化很快时,立即加入100 μL反应终止液。立即置于酶标仪上,450 nm处读取吸光度值,根据标准曲线计算出样品4-HNE浓度。
1.6 统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;采用Pearson相关进行相关性分析。以P < 0.05为差异有统计学意义。
2 结果
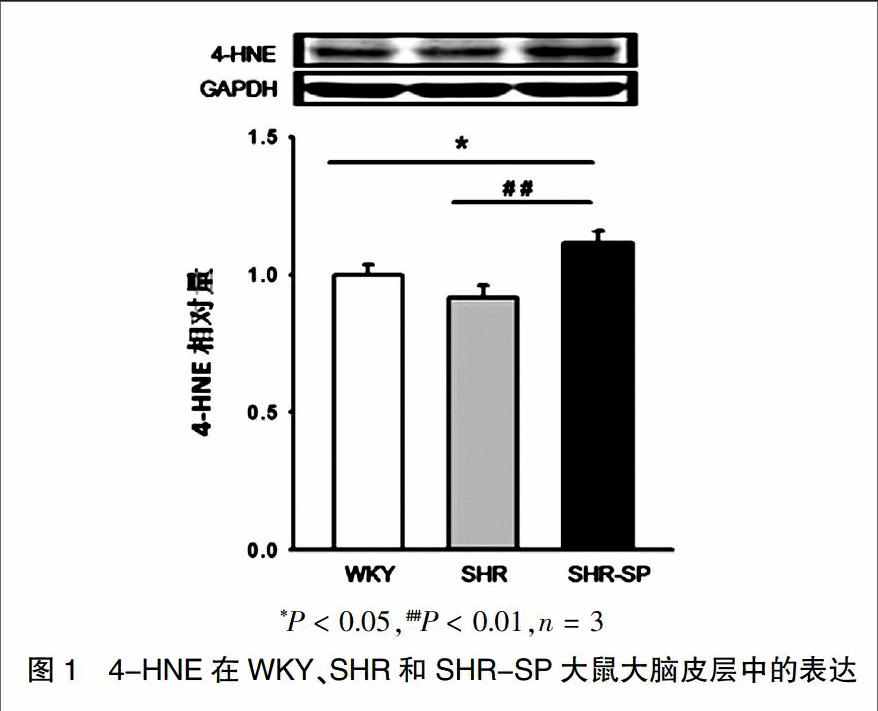
2.1 4-HNE在WKY、SHR和SHR-SP大鼠大脑皮层中的表达
雄性SHR-SP一般在8~12月龄内会发生脑卒中而死亡,其中75%是缺血性脑卒中。利用Western blot的方法测定6月龄的WKY、SHR、SHR-SP大鼠大脑皮层4-HNE的表达,结果显示,与WKY相比,SHR-SP大鼠大脑皮层4-HNE表达增高[(1.000±0.093)比(1.180±0.125)],差异有统计学意义(P < 0.05);与SHR相比,SHR-SP大鼠大脑皮层4-HNE表达显着增高[(0.910±0.113)比(1.180±0.125)],差异有高度统计学意义(P < 0.01),而SHR与WKY相比,差异无统计学意义(P > 0.05)。见图1。
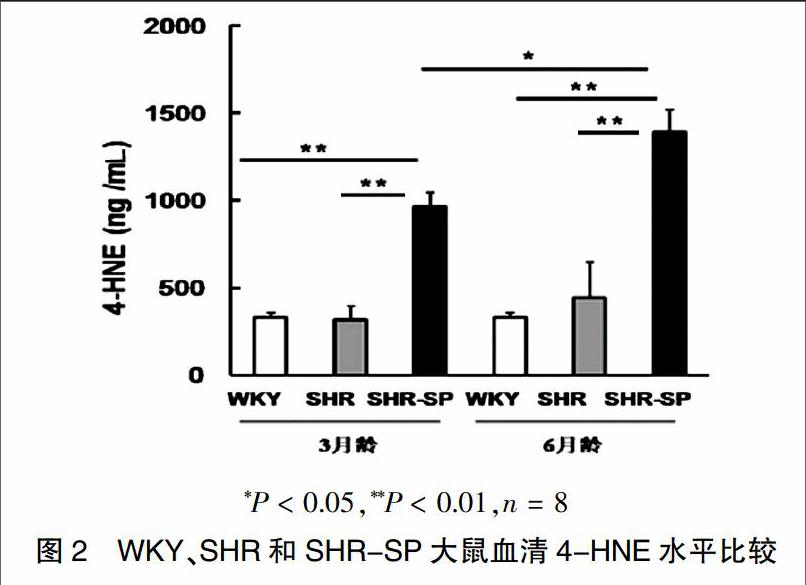
2.2 WKY、SHR和SHR-SP大鼠血清4-HNE水平比较
本研究分别检测了3月龄和6月龄的WKY、SHR、SHR-SP三种大鼠外周血清中4-HNE的含量,结果显示,不管是3月龄还是6月龄,SHR-SP大鼠的血清4-HNE水平较SHR与WKY大鼠均显着升高[3月龄SHR-SP、SHR、WKY大鼠4-HNE水平分别为(963.8±144.7)、(318.6±55.7)、(330.9±40.9)ng/mL,P < 0.01;6月龄SHR-SP、SHR、WKY大鼠4-HNE水平分别为(1392.1±200.9)、(444.5±178.1)、(330.9±40.9)ng/mL,P < 0.01],而SHR与WKY大鼠血清4-HNE水平差异无统计学意义(P > 0.05)。随着SHR-SP大鼠月龄的增长,血清4-HNE的水平也逐渐升高,6月龄大鼠较3月龄相比,差异有统计学意义(P < 0.05)。见图2。
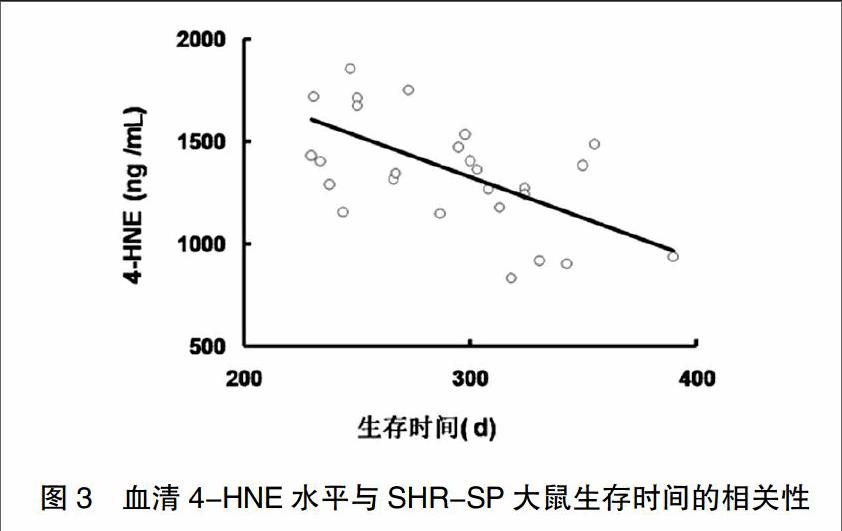
2.3 4-HNE水平与SHR-SP大鼠生存时间的相关性
27只8月龄雄性SHR-SP大鼠眼眶取血,测定血清4-HNE水平,动物放回动物房继续饲养,记录死亡情况。统计4-HNE与SHR-SP大鼠生存时间的相关性。结果显示,SHR-SP大鼠的生存时间与血浆4-HNE水平呈负相关(r=-0.602 08,P=0.0009)。见图3。
2.4 缺血性脑卒中患者血浆4-HNE水平
通过临床进一步观察4-HNE与脑卒中的关系,以年龄、血压、血脂等基本信息相匹配人群为对照,测定缺血性脑卒中急性期(0~3 d,23例)和慢性期(3~6个月,13例)患者及对照人群血浆4-HNE水平。结果显示,各人群组间总胆固醇及肌酐差异有统计学意义(P < 0.05),但总胆固醇与肌酐水平均在正常范围内。见表1。不管是急性期还是慢性期,脑卒中患者血浆4-HNE水平均高于对照人群[(14.9±2.5)、(12.9±2.6)比(9.6±2.0)mg/mL],差异有高度统计学意义(P < 0.01);慢性期患者血浆4-HNE水平较急性期低,差异有统计学意义(P < 0.05)。见图4。
3 讨论
氧化应激是脑缺血的基本病理生理改变之一,脑缺血缺氧时,体内或细胞内活性氧的产生与抗氧化之间失衡,导致活性氧在体内蓄积,并引起一系列生物反应的过程。过多的氧自由基攻击生物膜磷脂中的多不饱和脂肪酸引发脂质过氧化反应[5]。研究发现,ω-6多不饱和脂肪酸,如亚油酸和花生四烯酸可以分解为4-HNE[6],与自由基相比,醛基产物更稳定,醛基还可与亲核性物质(如DNA、蛋白质和磷脂)反应,干扰细胞的正常功能,损伤细胞组分,从而引发疾病[7-9]。
多项研究证实,过多的4-HNE通过多种途径对细胞产生严重的生物毒性,如4-HNE能对含巯基蛋白质相关的位点进行修饰,引起蛋白质分子内和分子间交联,抑制蛋白、DNA合成,或改变酶活性[10-11];4-HNE也可以作为内源性凋亡诱导因子,抑制AKP等信号通路而诱发细胞凋亡作用[12-13];4-HNE与细胞内谷胱甘肽的巯基结合,造成谷胱甘肽消耗性降低,使细胞内抗氧化能力减弱,进一步并加重细胞内的氧化应激[14-15];4-HNE作为脂质过氧化的终末产物,能诱导巨噬细胞聚集活化,诱导炎症因子表达,促进炎症的发生[16-17]。上述机制使4-HNE参与多种疾病的发生、发展。近年来尚有研究表明,在心肌缺血的病理情况下,血浆4-HNE明显升高,提示4-HNE与缺血性疾病的发生密切相关[18-19]。
SHR-SP和SHR大鼠均来自WKY大鼠,雄性的SHR-SP大鼠在5~12周龄时血压快速上升,形成严重的高血压,75%左右的SHR-SP大鼠因缺血性脑卒中而死亡[20]。通过对比6月龄的SHR-SP、SHR和WKY大鼠发现,SHR-SP大鼠大脑皮层4-HNE水平明显高于SHR和WKY大鼠,但SHR和WKY大鼠无明显区别,血浆中4-HNE水平也呈现同样趋势,且随年龄增长而升高。4-HNE仅在SHR-SP大鼠中升高,这意味着4-HNE的改变与血压无明显关系,4-HNE的增加可能会促进脑卒中发生。
脑缺血后,脑内氧化应激增加,代谢紊乱,4-HNE、丙二醛(MDA)等物质大量增加,被认为是缺血性脑卒中的结果。研究发现,SHR-SP大鼠血清4-HNE水平在脑卒中发生前就开始升高,一直到卒中后恢复期逐渐下降,但短期内难以降至正常水平;大脑皮层的4-HNE也在脑卒中发生前表达上调,较SHR和WKY大鼠均有显着差异,且与SHR-SP大鼠生存时间呈负相关[20]。本研究发现,缺血性脑卒中患者,无论急性期还是慢性期,血浆4-HNE水平均高于正常人群,即使在卒中发生后几个月仍维持在较高的水平;随时间推移,4-HNE逐渐下降,慢性期患者血浆的4-HNE水平比急性期患者低。基于这些可以认为,血浆4-HNE可能是缺血性脑卒中发生的危险因素之一。当然,这还有待更广泛和深入的研究,下一步研究将通过检测志愿者血浆4-HNE水平,随访志愿者脑卒中的发生率,观察是否高水平4-HNE的人群更容易发生脑卒中。对于脑卒中的高危人群(高血压、脑卒中家族史及60岁以上老年人)监测其血浆4-HNE具有积极的临床意义,可以作为预测脑卒中发生的一个指标。
[参考文献]
[1] Tuttolomondo A,Sciacca RD,Raimondo DD,et al. Neuron protection as a therapeutic target in acute ischemic stroke [J]. Current Topics in Medicinal Chemistry,2009,9(14):1317-1334.
[2] Mdzinarishvili A. Ginkgo extract EGb761 confers neuroprotection by reduction of glutamate release in ischemic brain [J]. J Pharm Pharm Sci,2012,15(1):94-102.
[3] Yang M. NMR analysis of the rat neurochemical changes induced by middle cerebral artery occlusion [J]. Talanta,2012, 88(1):136–144.
[4] Zheng R. Modulation of keratinocyte expression of antioxidants by 4-hydroxynonenal,a lipid peroxidation end product [J]. Toxicol Appl Pharmacol,2014,275(2):113–121.
[5] 王鹏,王丽华,李星晶.高压氧治疗急性缺血性脑卒中对氧化亚氮、神经元特异性烯醇酶和内皮素-1的影响[J].中国医药导报,2013,10(10):17-18.
[6] Zheng R,Po I,Mishin V,et al. The generation of 4-hydroxynonenal,an electrophilic lipid peroxidation end product,in rabbit cornea organ cultures treated with UVB light and nitrogen mustard [J]. Toxicology & Applied Pharmacology,2013,272(2):345-355.
[7] Siddiqui MA,Kashyap MP,Khanna VK,et al. NGF induced differentiated PC12 cells as in vitro tool to study 4-hydroxynonenal induced cellular damage [J]. Toxicology in Vitro,2010,24(6):1681-1688.
[8] 李丹,张岐山,周立娜,等.敲减AKR1A1基因对H2O2及4-羟基壬烯醛诱导的1321N1脑星形细胞瘤细胞损伤的影响[J].细胞与分子免疫学杂志,2014,29(3):273-276.
[9] 陈海娥,金晓盛,宋冬,等.P38丝裂原活化蛋白激酶在促红细胞生成素后处理减轻再灌注损伤肺细胞凋亡中的作用[J].中国药学杂志,2014,49(10):833-836.
[10] Choudhury S,Dyba M,Pan J,et al. Repair kinetics of acrolein- and(E)-4-hydroxy-2-nonenal-derived DNA adducts in human colon cell extracts [J]. Mutation Research,2013,751(5):15-23.
[11] Vatsyayan R,Kothari H,Pendurthi UR,et al. 4-Hydroxy-2-nonenal enhances tissue factor activity in human monocytic cells via p38 mitogen-activated protein kinase Activation-dependent phosphatidylserine exposure [J]. Arteriosclerosis Thrombosis & Vascular Biology,2013,33(7):1601-1611.
[12] Cumaoglu A,Arlcloglu A,Karasu C. Redox status related activation of endoplasmic reticulum stress and apoptosis caused by 4-hydroxynonenal exposure in INS-1 cells [J]. Toxicology Mechanisms & Methods,2014,24(5):362-367.
[13] Ji GR,Yu NC,Xue X,et al. 4-Hydroxy-2-nonenal induces apoptosis by inhibiting AKT signaling in human osteosarcoma cells [J]. Scientific World Journal,2014,2014(1):873525.
[14] Benedetti E,D'Angelo B,Cristiano L,et al. Involvement of peroxisome proliferator-activated receptor β/δ(PPAR β/δ)in BDNF signaling during aging and in Alzheimer disease: possible role of 4-hydroxynonenal(4-HNE)[J]. Cell Cycle,2014,13(8):1335-1344.
[15] Mcelhanon KE,Bose C,Sharma R,et al. Gsta4 null mouse embryonic fibroblasts exhibit enhanced sensitivity to oxidants: role of 4-hydroxynonenal in oxidant toxicity[J]. Open Journal of Apoptosis,2013,2(1):1-11.
[16] Wang X,Yang Y,Moore DR,et al. 4-hydroxy-2-nonenal mediates genotoxicity and bystander effects caused by Enterococcus faecalis-infected macrophages [J]. Gastroenterology,2012,142(3):543-551.
[17] Mcgrath CE,Tallman KA,Porter NA,et al. Structure-activity analysis of diffusible lipid electrophiles associated with phospholipid peroxidation: 4-hydroxynonenal and 4-oxononenal analogues [J]. Chemical Research in Toxicology,2011,24(3):357-370.
[18] Hill BG. Myocardial ischaemia inhibits mitochondrial metabolism of 4-hydroxy-trans-2-nonenal [J]. Biochemical Journal,2009,417(2):513-524.
[19] Mali VR,Palaniyandi SS. Regulation and therapeutic strategies of 4-hydroxy-2-nonenal metabolism in heart disease [J]. Free Radical Research,2014,48(3):251-263.
[20] Robinson TG. Cardiac baroreceptor sensitivity predicts long-term outcome after acute ischemic stroke [J]. Stroke,2003,34(3):705-711.
(收稿日期:2015-06-03 本文编辑:程 铭)



