栾仲秋 向月 李秋红 王继坤


[摘要] 目的 探讨槐米提取物对类风湿关节炎大鼠辅助性T细胞/调节性T细胞(Th17/Treg)细胞平衡调节作用。方法 将50只雄性SD大鼠适应性饲养7 d后,选取合格大鼠,并将其随机分为正常组、模型组、槐米组,每组15只。建立Ⅱ型胶原诱导性关节炎大鼠模型,槐米组于造模第21天开始灌胃给予槐米提取液300mg/(kg·d),1次/d。治疗4周后,采用酶联免疫吸附测定法检测各组血清中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、IL-10、IL-17、IL-21、IL-23、IL-27水平,采用流式细胞术检测外周血中Th17/Treg的比率,通过病理切片观察踝关节病理学变化。 结果 与模型组比较,槐米组大鼠血清中TNF-α、IL-6、IL-17、IL-21、IL-23含量明显下降,IL-10、IL-27水平明显上调,外周血中Th17/Treg比率显着降低,差异有高度统计学意义(P < 0.01)。 结论 槐米能够通过调控相关免疫细胞因子水平,诱导Treg细胞生成的同时干预Th17细胞分化,改善Th17/Treg失衡状态,从而起到治疗类风湿关节炎的作用。
[关键词] 槐米;类风湿关节炎;辅助性T细胞/调节性T细胞;调节作用
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-7210(2019)07(b)-0025-04
Regulation of Sophora japonica extract on Th17/Treg cell balance in rheumatoid arthritis rats
LUAN Zhongqiu1 XIANG Yue2 LI Qiuhong3 WANG Jikun1
1.Department of Nephrology, the First Affiliated Hospital of Heilongjiang University of Chinese Medicine, Heilongjiang Province, Harbin 150040, China; 2.Graduate School, Heilongjiang University of Chinese Medicine, Heilongjiang Province, Harbin 150040, China; 3.Library, Heilongjiang University of Chinese Medicine, Heilongjiang Province, Harbin 150040, China
[Abstract] Objective To investigate the effect of Sophora japonica extract on the balance of helper T cells/regulatory T cells (Th17/Treg) in rheumatoid arthritis rats. Methods Fifty male SD rats were fed adaptively for 7 days. Qualified rats were selected and randomly divided into normal group, model group and Sophora japonica group, with 15 rats in each group. A rat model of type Ⅱ collagen induced arthritis was established. Sophora japonica group was given 300 mg/(kg·d) of Sophora japonica extract by gastric perfusion on the 21st day of model establishment, once a day. After 4 weeks of treatment, serum levels of tumor necrosis factor-α (TNF-α), interleukin (IL)-6, IL-10, IL-17, IL-21, IL-23 and IL-27 were measured by ELISA. The ratio of Th17/Treg in peripheral blood was detected by flow cytometry. The pathological changes of ankle joint were observed by pathological section. Results Compared with the model group, the levels of TNF-α, IL-6, IL-17, IL-21 and IL-23 in the serum of rats in Sophora japonica group decreased significantly, the levels of IL-10 and IL-27 increased significantly, and the ratio of Th17/Treg in peripheral blood decreased significantly (P < 0.01). Conclusion Sophora japonica can induce cytopoiesis of Tregs while interfering with the differentiation of Th17 by regulating the related immunocytokines, which improves Th17/Treg imbalance, thus exerting therapeutic effect for rheumatoid arthritis.
[Key words] Sophora japonica; Rheumatoid arthritis; Helper T cells/regulatory T cells; Regulation
类风湿关节炎(RA)是一种以对称性关节周围肿痛,甚则以屈伸困难为主要表现的慢性全身性自身免疫性疾病[1-2]。由于该病呈慢性进展,发作与缓解交替,对人体体力消耗大,致残率高,给患者造成长期折磨和巨大痛苦,也加重了家庭的经济负担,因此RA防治研究意义重大[3-4]。中药在治疗免疫性疾病方面具有效果好、副作用少、低价格等优点,槐米的主要有效物质为黄酮类成分,且目前黄酮类中药单体化合物治疗RA的研究成果颇丰,为探寻中药现代化应用提供了新方向[5-6]。此外,槐米具有抗氧化、抗肿瘤、抗炎等作用[7]。为进一步探索评价RA治疗效果的客观指标及扩展槐米的临床应用,本研究采用槐米提取物干预Ⅱ型胶原诱导性关节炎(CIA)模型大鼠,探讨其对大鼠辅助性T细胞/调节性T细胞(Th17/Treg)细胞平衡调节作用,以期为槐米治疗RA提供实践理论,同时为RA患者的治疗提供新的靶点。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠50只,由黑龙江中医药大学实验动物中心提供(许可证号:SCXK鲁20140001),体重为230~270 g,年龄40~45 d。
1.2 仪器与试药
DNM-9602型酶标仪[北京普朗(集团)有限公司];Coulter Epics-XL4流式细胞仪(美国贝克曼库尔特);TF型光热测痛仪(中国医学科学院);2135型切片机(德国徕卡);Moticam 3000型成像系统(美国麦克奥迪)。
槐米提取物(由黑龙江中医药大学实验中心制备,含生药100 mg/mL);牛Ⅱ型胶原及弗氏不完全佐剂(美国sigma公司)。
1.3 Ⅱ型胶原诱导性关节炎模型制备
将50只大鼠适应性饲养7 d后,随机选取15只作为正常组,其余大鼠用10%水合氯醛进行腹腔麻醉。取牛Ⅱ型胶原溶于0.1 mol/L的乙酸中(2 mg胶原/mL),在4℃下过夜消溶,再在冰浴下与等量福氏不完全佐剂制成乳剂。在麻醉大鼠的颈、背部5个不同部位进行皮内注射,每个部位注射0.1 mL乳剂。第21天后,同法再加强注射1次。建模完成后,通过病理学观察显示关节滑膜组织异常增生、充血,伴见炎症细胞浸润,模型大鼠血清肿瘤坏死因子-α(TNF-α)水平异常升高,提示CIA模型复制成功。实验过程中对动物的处置严格遵守国家科技部《关于善待实验动物的指导意见》的规定。
1.4 实验分组及给药方法
将制备成功的大鼠模型随机分为模型组和槐米组,每组15只。槐米组于造模第21天开始灌胃,参照《人和动物间按体表面积折算的等效剂量比值表》确定给予槐米提取液300 mg/(kg·d),1次/d,连续治疗28 d。其余均给予等体积生理盐水。
1.5 观察指标及方法
1.5.1 大鼠血清细胞因子水平 治疗后28 d,大鼠麻醉后,采用真空采血管经右心室取静脉血,室温静置2 h后,3500 r/min,离心15 min,分离血清,并采用酶联免疫吸附测定法检测大鼠血清细胞因子水平。
1.5.2 流氏细胞仪检测外周血中Th17/Treg 细胞的比率 心脏取血,经乙二胺四乙酸抗凝,将外周血单个核细胞(PBMC)分离,采用磷酸盐缓冲液调整PBMC密度为5×106/100 μL。取上述细胞悬液100 μL,将CD3、CD4-FITC、CD4、CD25-PE单克隆抗体加入阳性管,将相应的同型对照抗体加入阴性管,在室温进行避光孵育1 h,生理盐水洗涤2次,弃上清液;加入白细胞介素-17(IL-17)和叉头样蛋白3(FoxP3)固定液1 mL,4℃避光孵育1 h;加入破膜液2 mL洗涤,1700 r/min、4℃离心5 min,弃上清液;加入破膜液100 μL,分别加入IL-17、叉头样蛋白3-藻红蛋白-花菁素荧光染料Cy5(Foxp3-PE-Cy5)和同型对照抗体,依然室温避光孵育1 h;再次加入破膜液2 mL洗涤2次,生理盐水洗涤2次,弃上清液;采用流式细胞仪检测Th17与Treg百分率,并计算Th17/Treg细胞比值。
1.5.3 踝关节病理学变化 治疗后28 d,大鼠麻醉后,取各大鼠右后足掌面、踝关节上大约1 cm的组织,常规固定,脱钙后常规脱水、透明、浸蜡和包埋,采用苏木精-伊红(HE)染色法进行检测,镜下观察各组大鼠关节组织病理学变化。
1.6 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用Dunnett′s t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠踝关节病理变化比较
正常组:大鼠关节结构正常,间隙均匀,关节周围表面润滑平坦无剥脱,软骨细胞形态正常无退变,骨髓腔内骨小梁及骨髓未见异常;关节滑膜组织完整,无充血、水肿,未见细胞增生、血管翳。模型组:关节间隙变窄,关节软骨表面剥落,软骨细胞出现固缩及空腔,骨小梁结构紊乱;滑膜组织明显增生、充血水肿,毛细血管增生,并可见炎细胞浸润。槐米组:可见枢纽关头结构趋于正常;滑膜增生显着减轻,血管数量形成减少,未见明显炎症细胞浸润,软骨表层轻度破坏。见图1。
2.2 各组大鼠血清中细胞因子水平比较
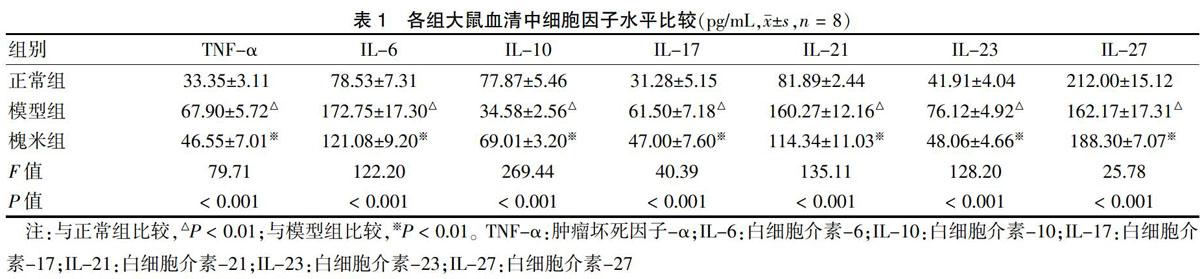
与正常组比较,模型组大鼠血清TNF-α、IL-6、IL-17、IL-21、IL-23水平组显着升高,IL-10、IL-27水平显着降低;与模型组比较,槐米组大鼠血清中TNF-α、IL-6、IL-17、IL-21、IL-23水平显着降低,IL-10、IL-27水平显着升高,差异均有高度统计学意义(P < 0.01)。见表1。
2.3 各组大鼠外周血中Th17/Treg细胞比率比较
与正常组比较,模型组大鼠外周血中CD4+ IL-17+ T细胞百分率和Th17/Treg比率显着升高,Foxp3+ CD4+ CD25+ Treg细胞百分率显着降低;与模型组比较,槐米组大鼠外周血中CD4+ IL-17+ T细胞百分率和Th17/Treg比率显着降低,Foxp3+ CD4+ CD25+ Treg细胞百分率显着升高,差异均有高度统计学意义(P < 0.01)。见表2。
3 讨论
RA的发病机制尚未完全明确,但CD4+ T细胞亚群的失衡在RA的关节炎性浸润、滑膜增殖、骨质及骨破坏过程中有着重要的影响[8-9]。Th17是Park等[10]在研究实验性自身免疫性脑脊髓炎和胶原诱导的关节炎两种自身免疫病模型时发现的一类新的CD4+ T细胞亚群,不仅可以分泌IL-17[11],使其参与自身免疫疾病,从而加重炎性反应,还可以分泌IL-21等细胞因子[12]。Treg细胞是一类特异表达转录因子Foxp3、具有免疫负性调节功能的CD4+ T细胞,其中具有免疫抑制作用的调节性T细胞中又以CD4+、CD25+为主[13-14]。细胞因子IL-6是由单核细胞、T淋巴细胞和纤维母细胞产生的,通过增强TNF-α的作用,间接刺激滑膜纤维母细胞和软骨细胞产生前列腺素E2(PGE2)和胶原酶,促进了骨质的破坏和骨吸收[15-16],而IL-10却通过干预NF-κB途径来抑制Th17细胞分泌TNF-α,较大可能地阻断了由TNF-α诱导产生的PGE2[17]。IL-23、IL-27均属于IL-12家族的一员,其中IL-27能够影响CD4+ T细胞分泌IL-10和IL-17,同时也能刺激Treg细胞分化,抑制Th17细胞的生成,在免疫疾病中起到促进免疫和抑制免疫的双重作用[18-19]。
本研究探讨槐米对CIA大鼠Th17/Treg细胞平衡的作用,结果显示,槐米能够显着改善CIA大鼠的关节滑膜病变,显着减轻滑膜增生,降低血清中IL-6、IL-17、IL-21、IL-23水平,上调IL-10、IL-27水平,即通过抑制Th17细胞分泌炎性因子,刺激Treg细胞的分化,从而实现对Th17/Treg细胞平衡的调节作用。这可能与槐米所含有的黄酮、槲皮素等化学成分关系密切[20]。
综上所述,槐米能够通过调控相关免疫细胞因子水平,诱导Treg细胞生成,同时干预Th17细胞分化,改善Th17/Treg失衡状态,从而对CIA模型起到治疗作用。这可能是槐米治疗类风湿关节炎、减缓病情发展的机制之一。本研究旨在对槐米提取物治疗RA的有效性及可能机制进行研究,并将在后续研究工作中进一步明确槐米提取物不同剂量对RA的疗效,并确定最佳治疗剂量。
[参考文献]
[1] 中华中医药学会风湿病分会.类风湿关节炎病证结合诊疗指南[J].中医杂志,2018,59(20):1794-1800.
[2] Bortoluzzi A,Furini F,Generali E,et al. One year in review 2018:novelties in the treatment of rheumatoid arthritis [J]. Clin Exp Rheumatol,2018,36(3):347-361.
[3] 曾小峰,朱松林,谭爱春,等.我国类风湿关节炎疾病负担和生存质量研究的系统评价[J].中国循证医学杂志,2013,13(3):300-307.
[4] 严家欣,王攀攀,张荣华.类风湿关节患者的中医证型与生存质量相关性分析[J].暨南大学学报:自然科学与医学版,2017,38(4):343-349.
[5] 王笑,王雨,张冰,等.槐不同药用部位本草学、化学成分和药理作用研究进展[J].中草药,2018,49(18):4461-4467.
[6] 孙承韬.龙须藤化学成分及抗类风湿性关节炎活性的研究[D].福州:福建中医药大学,2018.
[7] 李秋红,栾仲秋,王继坤.中药槐米的化学、炮制及药理作用研究[J].中医药学报,2017,45(3):112-115.
[8] 郭明,安高,封桂英,等.CD4+ T细胞亚群在类风湿性关节炎中的研究进展[J].细胞与分子免疫学杂志,2014,30(9):1004-1007.
[9] 王晓慧,潘文萍,孙素平,等.类风湿关节炎不同中医证型外周血Th17/Treg细胞表达特点研究[J].浙江中医杂志,2018,53(8):549-550.
[10] Park H,Li Z,Yang XO,et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin interleukin 17 [J]. Nat Immunol,2005,6(11):1133-1141.
[11] 洪梦琴,杨敏,范星宇.IL-17与RANKL/RANK/OPG通路在类风湿性关节炎发病机制中的研究进展[J].世界最新医学信息文摘,2018,18(98):90-92.
[12] 杨金娜,刘晓光,李覃,等.Th17/Treg平衡在类风湿关节炎中作用的研究进展[J].中国药理学通报,2013,29(8):1045-1048.
[13] 俞云,时乐,喻斌,等.栀子苷对类风湿性关节炎大鼠Th17/Treg平衡和局部炎症因子的影响[J].南京中医药大学学报,2018,34(5):499-503.
[14] Carrock S,North ME,Webster DB,et al. Determination of intracellular cytokins by flow-cytometry following whole-blood culture [J]. J Immunol Methods,1997,209(1):67-74.
[15] 邢洁,姜萍,姜月华,等.和痹方对类风湿关节炎大鼠α7nAChR、STAT3蛋白表达及TNF-α、IL-6、IL-17表达的影响[J].中华中医药杂志,2018,33(2):730-733.
[16] 杨兆文,曹金,张立民,等.托珠单抗在类风湿关节炎中的研究进展[J].世界临床药物,2014,35(9):523-526.
[17] 徐晓玲,梁瑞霞,黄君健,等.细胞因子在类风湿关节炎发病机制中的作用[J].生物技术通讯,2008,19(1):111-114.
[18] Pickens SR,Chamberlain ND,Volin MV,et al. Local expression of IL-27 ameliorates collagen induced arthritis [J]. Arthritis Rheum,2011,63(8):2289-2298.
[19] 陈爽,张庆镐,方芳.IL-27 p28基因多态性与中国汉族人群类风湿性关节炎的相关性研究[J].中国免疫学杂志,2014,30(1):117-120.
[20] 刘维,孙淳,吴沅皞.黄酮类中药单体成分治疗类风湿性关节炎作用机制研究进展[J].中草药,2014,45(19):2878-2882.



