李 洋 费洪新 张晓杰,3
1.佳木斯大学基础医学院,黑龙江佳木斯 154002;2.新余学院护理与康复学院,江西新余 338004;3.齐齐哈尔医学院病理学院,黑龙江齐齐哈尔 161006
阿尔茨海默病(Alzheimer′s disease,AD)是当今社会普遍存在的老年严重性疾病,β-淀粉样蛋白(βamyloid,Aβ)是其形成的重要因素[1-2]。小胶质细胞是神经系统的免疫细胞,炎症小体NOD 样受体蛋白3(nod-like receptor protein 3,NLRP3)是AD 激活的危险信号[3-4]。Aβ 可以刺激NLRP3,使小胶质细胞释放炎症介质,引起炎性反应的发生[5-6]。现代医学对于AD的治疗还不够完善,临床用药也有一定的毒副作用,但中医药方剂补肾益智方[7]、七福饮[8]、补阳还五汤[9]等却为AD 的治疗提供了有力的帮助。本实验在前期研究的芪苓益脑汤(QYD)的基础(专利号:ZL20151050 5180.3)上,通过实验检测小鼠大脑皮质区小胶质细胞NLRP3 的表达,从而探究QYD 对AD 小鼠大脑皮质区小胶质细胞NLRP3 表达的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级3 月龄,雄性,体重(23±2)g,APP/PS1 双转基因小鼠(24 只)和同窝同性别的野生小鼠(8 只)均购自于南京大学南京生物医药研究院[SCXK(苏)2015-0001]。所有小鼠按照清洁级标准在温度18~29℃、相对湿度达40%~70%、无菌、自由摄食饮水的条件下,由齐齐哈尔医学院动物实验中心进行饲养,小鼠灌胃、处死等基本操作均符合动物伦理学基本标准。
1.1.2 主要药品 盐酸多奈哌齐(陕西方舟制药有限公司,H20030583)。QYD 购买于黑龙江中医药大学附属第一医院(以下简称“我院”),QYD 基本组成包括黄芪20 g(1712068S)、山慈菇8 g(160910)、昆布9 g(170501)、大枣10 g(SC11741018400042)、川芎6 g(1705027S)、桂枝6 g(1712070S)、三棱8 g(1507027C)、牡蛎20 g(170901)、知母10 g(1703107S)、土茯苓35 g(1703052S)、白术3 g(1707034CH)、甘草6 g(1712001),每付一共141 g,共购买10 付。组成QYD的中药材由我院栗明副主任医师按照《中国中药材真伪鉴别图典》[10]鉴定为正品后方可配伍使用,QYD 是由齐齐哈尔医学院中医药研究院将组成QYD 的中药材经过浸泡、煮沸、过滤、蒸发等过程,提取浓缩液,制成的水煎剂,该中药组合物已经申请并授权专利(专利号:ZL201510505180.3)。
1.1.3 试剂和仪器 Aβ 抗体(Abcam 公司,ab201060);NLRP3 抗体(博士德公司,BA3677);Trizol(碧云天公司,R0016);HT7700 型透射电子显微镜(日立高新公司);HH-11420-BS 型电热恒温培养箱(上海五久自动化设备有限公司);DSX-280B 型手提式压力蒸汽灭菌器(北京慧龙环科环境仪器有限公司)。
1.2 方法
1.2.1 动物分组和给药 24 只APP/PS1 双转基因小鼠按照随机数字表法分为模型组、QYD 实验组和多奈哌齐组,每组8 只,另设同窝同性别的8 只野生小鼠作为对照组。按体表面积和剂量换算[11],QYD 实验组给予QYD(18.330 g/kg)、多奈哌齐组给予多奈哌齐(0.001 g/kg),模型组、对照组给予生理盐水(2 mL/次),每天灌胃1 次,持续灌胃30 d。
1.2.2 行为学检测 参考文献[12]进行行为学测试。Morris水迷宫实验设定的基本条件包括水深20 cm,高于平台1 cm,水温控制在(23±2)℃,水池内放适量奶粉,使其背景变为白色,将平台置于第4 象限,同时保持室内外参照物一致。小鼠先进行4 d 的训练测试,每次60 s。如果60 s 内小鼠搜寻不到平台则停留10 s。第5 天时进行定位航行测试,观察小鼠到达平台的潜伏期,评价小鼠的学习能力;空间探索实验时,实验人员移走平台,将小鼠放入池中,让它们自由游泳60 s,检测小鼠到达平台的游泳距离和穿越平台的次数,以此评价小鼠的记忆能力。
1.2.3 形态学观察 参考文献[13-14]进行形态学观察。透射电子显微镜观察海马区和小胶质细胞结构变化:将水迷宫测试后的小鼠置于超净台上,断颈法取1 mm3的海马组织块,依次完成戊二醛固定,包埋等操作,制成50~70 nm 的超薄切片,电镜观察,拍照存储图像。
1.2.4 蛋白水平检测 免疫组织化学法检测NLRP3、Aβ 表达。行为学检测结束后,将小鼠解剖后断头取脑组织。依次完成固定,包埋,切片,脱蜡,脱水,修复,滴加封闭液,一抗工作液(4℃过夜)等操作,随后辣根过氧化物酶(HRP)偶联的二抗孵育,苏木精复染。显微镜下观察,存储图像。应用Image-Pro Plus 6.0 软件计算平均光密度值(MOD)。
1.2.5 基因水平检测 采用实时定量聚合酶链式反应(RT-qPCR)方法检测NLRP3、Aβ 基因表达情况。取60 mg 脑组织,加600 μL 的Trizol 溶液,用研磨器迅速研磨,提取RNA。将RNA 反转录成cDNA,同时设计特异性引物Aβ 引物(F:5′-CTGGAGGTGCCCACTGATG-3′ ;R:3′ -GGGTCTGACTCCCATTTTCC -5′ )、NLRP3(F:5′-GAGCTGGACCTCAGTGACAATGC-3′;R:3′-ACCAATGCGAGATCCTGACAACAC-5′)、GAPDH(F:5′-CGTGCGTGACATCAAAGAGAA-3′;R:3′-AACCGCTCGTTGCCAATAGT-5′)。加入特殊SYBR GreenⅠ荧光材料,通过RT-qPCR 进行实时监测得到实验数据,所得实验数据结果均采用2-ΔΔCt法计算。
1.3 统计学方法
采用SPSS 22.0 统计学软件对所得数据进行分析,计量资料以均数±标准差()表示,采用单因素方差分析,组间比较采用LSD 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 QYD 对AD 小鼠行为学的影响
与对照组比较,模型组AD 小鼠潜伏期明显延长,游泳距离明显增加,穿越平台的次数明显减少,差异有统计学意义(均P <0.05);与模型组比较,多奈哌齐组和QYD 组AD 小鼠潜伏期均明显缩短,游泳距离明显减少,穿越平台的次数明显增加,差异有统计学意义(均P <0.05)。见表1。
表1 QYD 对AD 小鼠行为学的影响(,n=8)
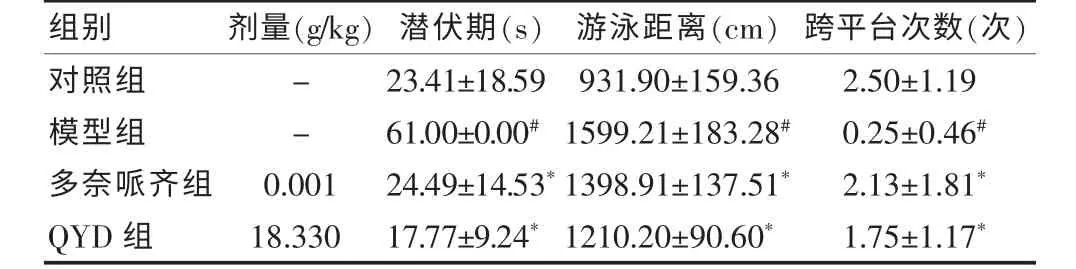
表1 QYD 对AD 小鼠行为学的影响(,n=8)
注:与对照组比较,#P <0.05;与模型组比较,*P <0.05。QYD:芪苓益脑汤;AD:阿尔茨海默病;“-”表示无数据
2.2 QYD 对AD 小鼠大脑皮质区小胶质细胞的影响
对照组小鼠大脑皮质区小胶质细胞形态完整,胞体小且椭圆状,细胞质丰富,小鼠大脑皮质区小胶质细胞结构正常;模型组AD 小鼠大脑皮质区小胶质形态较完整,内质网扩张,线粒体絮状变形,核固缩,有明显脂褐素沉着,小鼠大脑皮质区小胶质细胞结构异常;与模型组比较,多奈哌齐组和QYD 组AD 小鼠大脑皮质区小胶质细胞形态较规则,核固缩减轻,脂褐素少见,小鼠大脑皮质区小胶质细胞结构逐渐恢复。见图1。
2.3 QYD 对AD 小鼠大脑皮质区NLRP3 和海马Aβ表达的影响
与对照组比较,模型组AD 小鼠NLRP3 在部分大脑皮质小胶质细胞表达明显增多(P <0.05);与模型组比较,多奈哌齐组和QYD 组AD 小鼠NLRP3 在部分大脑皮质小胶质细胞的表达明显减少(P <0.05)。与对照组比较,模型组AD 小鼠海马区域Aβ 斑块数量明显增多(P <0.05);与模型组比较,多奈哌齐组和QYD 组AD 小鼠海马区域Aβ 斑块数量明显减少(P <0.05)。见表2、图2~3。
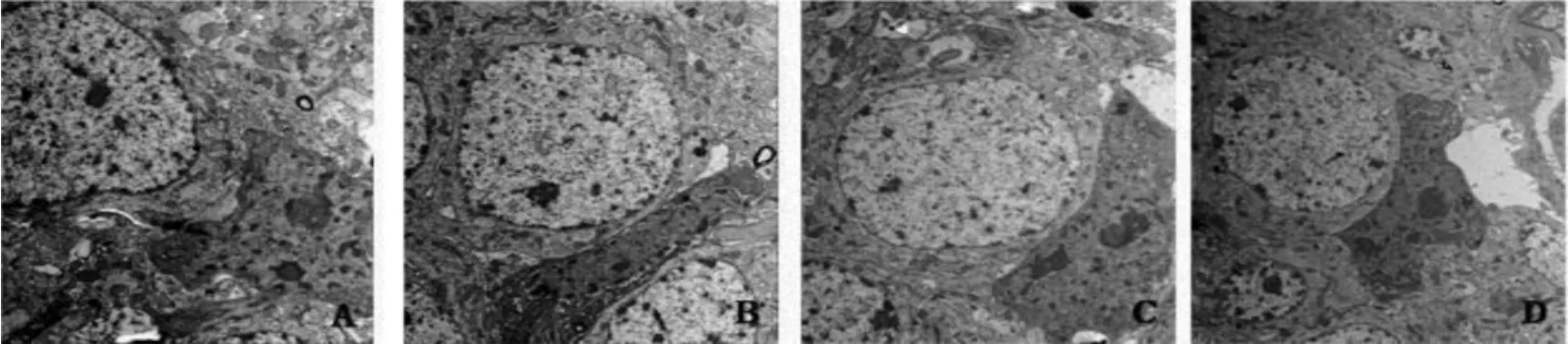
图1 脑组织内小胶质细胞结构(TEM,18 000×)
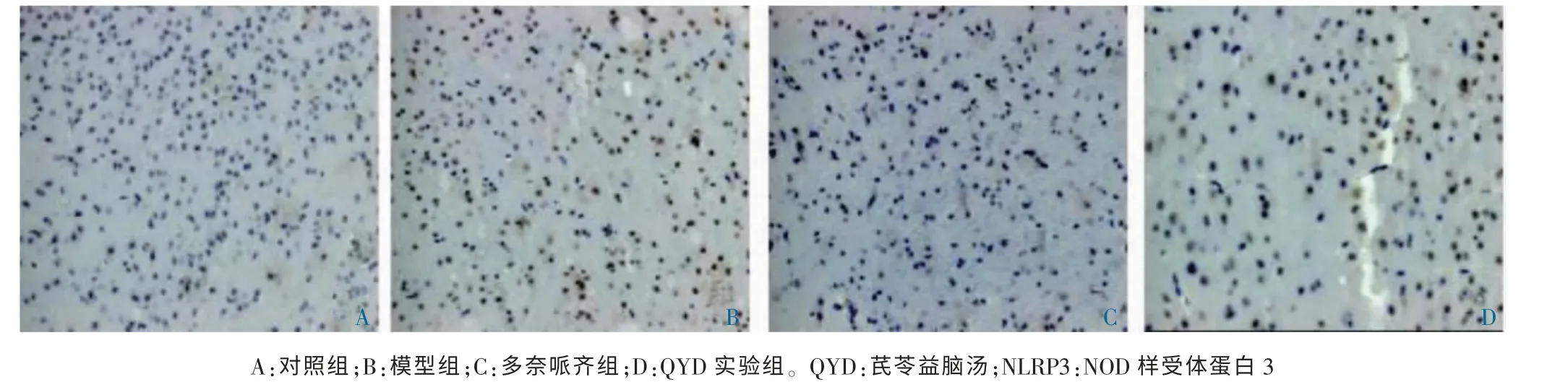
图2 各组小鼠小胶质细胞NLRP3 的表达(免疫组化,200×)
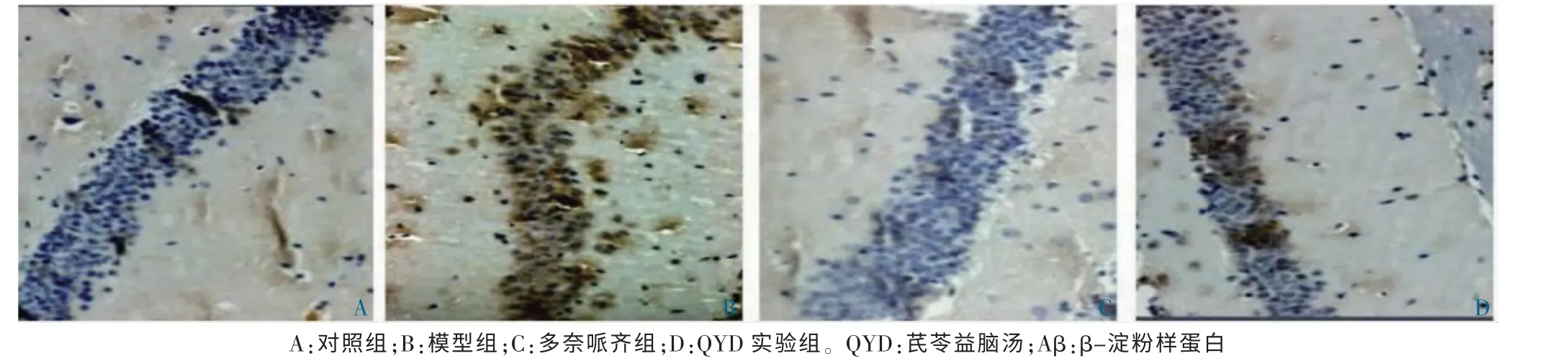
图3 各组小鼠海马内Aβ 的表达(免疫组化,200×)
表2 QYD 对AD 小鼠大脑皮质区NLRP3和海马Aβ 的影响(,n=8)
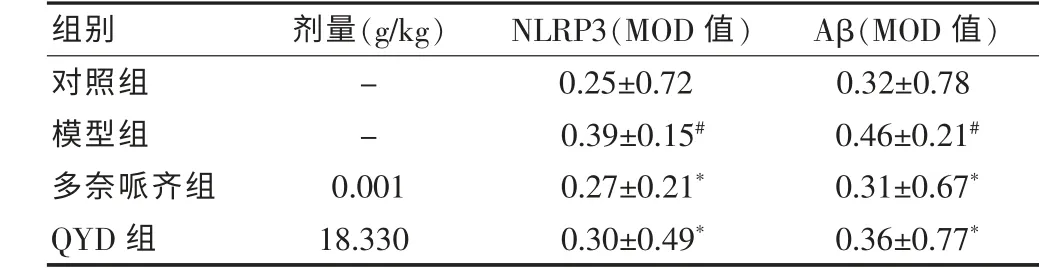
表2 QYD 对AD 小鼠大脑皮质区NLRP3和海马Aβ 的影响(,n=8)
注:与对照组比较,#P <0.05;与模型组比较,*P <0.05。QYD:芪苓益脑汤;AD:阿尔茨海默病;NLRP3:NOD 样受体蛋白3;Aβ:β-淀粉样蛋白;MOD:平均光密度值;“-”表示无数据
2.4 QYD 对AD 小鼠大脑皮质区NLRP3 和海马Aβ mRNA 的影响
与对照组比较,模型组AD 小鼠大脑皮质区NLRP3和海马Aβ mRNA 表达均明显升高,差异有统计学意义(均P <0.05);与模型组比较,多奈哌齐组、QYD 组AD 小鼠大脑皮质区NLRP3 和海马Aβ mRNA 表达均明显降低,差异有统计学意义(均P <0.05)。见表3。
表3 QYD 对AD 小鼠大脑皮质区NLRP3和海马Aβ mRNA 的影响(,n=8)
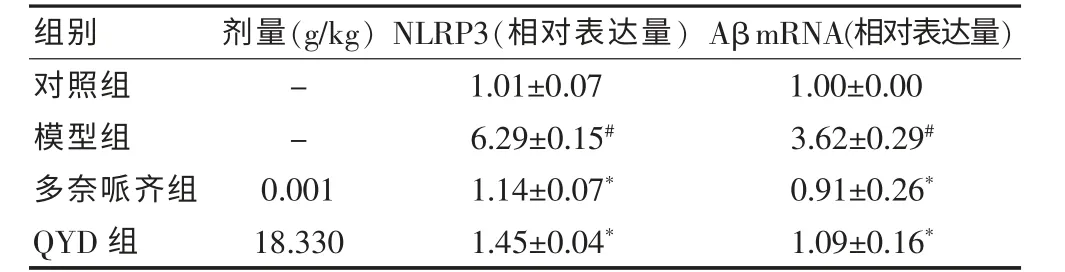
表3 QYD 对AD 小鼠大脑皮质区NLRP3和海马Aβ mRNA 的影响(,n=8)
注:与对照组比较,#P <0.05;与模型组比较,*P <0.05。QYD:芪苓益脑汤;AD:阿尔茨海默病;NLRP3:NOD 样受体蛋白3;Aβ:β-淀粉样蛋白;“-”表示无数据
3 讨论
AD 是一种常见的神经退行性疾病[15-16]。最近在AD 模型小鼠中,出现了大量与AD 相关的信息,其中对小胶质细胞特异性激活NLRP3 就有了新的研究[17]。被激活的NLRP3 炎症小体能够促进APP/PS1 模型小鼠脑组织内Aβ 沉积,NLRP3 炎症小体的活化是炎性疾病发展中的重要环节,抑制NLRP3 炎症小体的活化可以对AD 疾病进行有效的保护。因此本实验以APP/PS1 双转基因小鼠为模型,验证QYD 是否能够降低NLRP3 的表达,从而验证QYD 是否能增强小鼠学习记忆的能力。
资料显示[18],当归补血汤可以有效提高APP/PS1小鼠的学习记忆能力,当归补血汤与QYD 的君药相同,QYD 是由当归补血汤中的黄芪并配伍土茯苓等多种中药成分组合而成,具有多靶点性,前期对QYD的研究也已经证实了其对AD 的保护作用。本研究通过对AD 小鼠的水迷宫测试发现,QYD 可以改善AD小鼠的学习记忆能力,具有改善AD 小鼠的行为学的作用,同时由本实验的透射电子显微镜观察结果可知,QYD 也具有改善AD 小鼠大脑皮质区小胶质细胞结构的作用。研究表明,Aβ 及沉积物是导致NLRP3炎症小体增多和AD 疾病发展的重要环节[19-20]。炎症小体现已经成为近年来研究的热点领域,小胶质细胞激活后释放炎性因子也已成为研究热点问题[21-24]。在AD 的疾病研究过程中,Aβ 通过激活小胶质细胞使其释放炎症小体NLRP3,从而使学习记忆能力丧失。通过实验研究可知,QYD 能够有效地抑制AD 小鼠脑组织中的NLRP3 的表达,降低NLRP3 的活化水平。同时QYD 也可以减少小鼠脑组织内Aβ 的沉积,因此,本研究可认为NLRP3 的活化与Aβ 减少密切相关,NLRP3 的抑制可以在很大程度上保护AD 小鼠的记忆丧失和减少Aβ 沉积,QYD 作为抗炎药物,为AD 的疾病治疗提供了可靠的依据。
综上所述,本研究提示QYD 能够抑制NLRP3 活化,这与降低Aβ 沉积有关,验证了QYD 对AD 具有保护作用,这将为AD 的治疗奠定基础。



