石项天 徐亚楠 王 猛 乔桐杉 乔 山 王满仓 欧阳晓晖 苏秀兰
1.内蒙古自治区巴彦淖尔市医院肝胆胰脾外科,内蒙古巴彦淖尔 015002;2.内蒙古医科大学附属医院临床医学研究中心,内蒙古呼和浩特 010050
随着人们生活水平不断提高,食物能量摄入增加,生活习惯改变导致能量消耗减少,致使身体多余能量转化为游离脂肪酸(free fatty acid,FFA)储存在遍布全身的脂肪组织(adipose tissue,AT)内。能量过剩又会诱发如肥胖、2 型糖尿病(diabetes mellitus type 2,T2DM)、高脂血症、非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)等代谢疾病。研究证明,AT不仅储存能量,也具有内分泌功能,其分泌的多种脂肪因子,参与机体能量代谢和炎症调节[1]。脂肪因子参与能量稳态、脂肪细胞分化和胰岛素敏感性等能量代谢的调控,通过分泌促炎和抗炎分子、激活代谢和免疫信号的来调节炎症进展[2]。脂肪代谢紊乱会引起脂肪组织外其他器官脂肪沉积,脂肪因子参与肝脏的脂肪过度脂肪沉积即为NAFLD/非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)疾病发展的最重要因素。NAFLD 疾病发展过程中,伴随各种脂肪因子作用机制不断深入,更多的脂肪因子的作用机制在被不断阐明。现就脂联素、瘦素、抵抗素、内脂素、视黄醇结合蛋白4 等脂肪因子与NAFLD 相关性进行综述,旨在说明其在疾病进展过程中的作用机制。
1 NAFLD
NAFLD 是一种非过度饮酒导致肝脏脂肪过度脂肪堆积的引起变性的代谢综合征,涵盖了从肝良性脂肪变、NASH、肝纤维化、肝硬化等多种肝脏疾病[3]。研究发现,NAFLD 发病常与肥胖、2 型糖尿病、血脂异常和代谢综合征等代谢紊乱疾病相关。NAFLD 的发病机制包括脂毒性、肠道菌群构成、促炎细胞因子介导的炎症攻击、氧化应激等[4]。
NASH 是NAFLD 亚型之一,其病理以肝内脂肪堆积引起肝细胞损伤、炎性瘢痕愈合或纤维化等为特点,而持续的脂毒性、胰岛素抵抗(insulin resistant,IR)、炎症、氧化应激和胆汁酸毒性加剧了这个进程。人体脂肪组织中的甘油三酯脂解为FFA 经血转运至肝脏受胰岛素调控,而胰岛素受体受损(即IR)诱导过多的脂肪酸向肝脏输送,从而导致NASH[5]。机体炎症发生时,脂肪细胞的c-Jun N 末端激酶磷酸化会使胰岛素受体后信号传导受损[6]。因此,脂肪组织炎症和代谢紊乱被认为是NASH/NAFLD 发病的重要机制,但具体的作用机制还未完全被阐明[7]。
2 脂肪因子
脂肪组织的脂肪细胞储存着大量甘油三酯,其在禁食期间释放,用以发挥调节体温和保护机械器官的功能。目前发现,AT 具有合成和分泌许多激素及600 多种脂肪因子、细胞因子的功能[8]。它们由脂肪组织中脂肪细胞、巨噬细胞、泡沫细胞、中性粒细胞、成纤维细胞等细胞分泌,向中枢、消化、免疫、脉管等系统中目标发出脂肪组织功能状态信号,并参与调节食欲和饱腹感、脂肪分布、胰岛素分泌和敏感性、能量消耗、炎症[9]。目前已探知的脂肪因子家族包括瘦素、脂联素、视黄醇结合蛋白4(retinol-binding protein 4,RBP4)、抵抗素、内脂素等。脂肪组织功能障碍引起脂肪因子分泌比例失衡,可能导致一系列肥胖相关疾病。
肥胖人群中NAFLD 和NASH 的患病率高达90%,其原因在于肝脏在脂肪和葡萄糖能量代谢调节紊乱,导致异位脂肪在肝细胞积累。多项研究发现,AT 的脂解异常增加会使肝脏脂肪沉积;AT-肝脏信号轴为调节全身代谢稳态提供了基础,以脂肪因子为中心的角度理解脂肪组织和肝脏之间串扰是非常重要的[10]。尤其是各种脂肪因子在调节肝脏脂质代谢方面发挥着重要作用。
3 脂肪因子在NAFLD 中作用机制
肥胖者脂肪组织中脂肪细胞病理性增生和肥大,部分脂肪因子分泌异常,脂肪组织过度分解,FFA 增多及载脂蛋白异常,诱发全身低度炎症[11]。肝脏内多种脂肪因子相互作用失衡,导致脂肪代谢稳态被打乱,这些均与NAFLD 的肝脏脂肪过度累积、IR 和肝纤维化等密切相关。
3.1 脂联素
脂联素是一种脂肪细胞衍生通过两个受体(ADIPOR1、ADIPOR2)作用于AMP 活化蛋白激酶信号或可能受T-钙黏蛋白调节的抗炎介质。脂联素抑制脂肪中的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达,诱导人白细胞中白细胞介素(interleukin,IL)-1、IL-10 受体拮抗剂等抗炎基因的表达[12]。脂联素具有抗炎、抗胰岛素抵抗、抗纤维化和抗肿瘤作用,与NASH/NAFLD、IR、T2DM 及代谢紊乱等负相关,可增强葡萄糖和脂肪酸氧化,提高胰岛素敏感性,减少斑块形成,并增加醛固酮的产生[13]。在肝脏中,脂联素激活AMP 依赖的蛋白激酶[adenosine 5’-monophosphate(AMP)-activated protein kinase AMPK]和过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)通路,下调糖异生过程相关基因(即磷酸烯醇式丙酮酸羧化酶、葡萄糖-6-磷酸脱氢酶、乙酰辅酶A 羧化酶)抑制糖异生,并促进FFA 氧化并抑制脂肪生成[14]。研究显示,NAFLD 患者的脂联素水平与肝脏脂肪变性、坏死性炎症和纤维化的严重程度呈负相关。低脂联素血症可能在从NAFLD 到NASH 的进展的病理生理过程中发挥重要作用[15]。此外,脂联素缺乏使过氧化物酶体增殖物激活受体下调,而使高脂饮食小鼠TNF-α 和FFA 增加致葡萄糖耐受不良和肥胖。同样,高脂饮食的脂联素基因敲除小鼠肝脏TNF-α 表达显着增加,证明了脂联素的缺乏会促进肥胖、高脂血症、脂肪性肝炎、肝纤维化和腺瘤等疾病的发生和发展[16]。脂联素诱导肝脏星状细胞(hepatic stellate cell,HSC)凋亡并对其抑制,影响库普弗细胞的存活,从而改善肝纤维化[17]。因此,脂联素类似物可作为未来临床NASH/NAFLD 治疗一个具有潜在意义的方案。
3.2 瘦素
瘦素由具有分泌功能脂肪组织产生的一种类固醇激素,其表达受胰岛素和糖皮质激素的调控,在脂肪组织中表达并分泌到循环系统中发挥作用[18]。瘦素通过靶向下丘脑弓状核中表达瘦素受体B 型的神经元来介导脂肪-大脑交流,分泌神经肽Y 和阿片样肽黑素皮质激素原,并调节控制食欲和能量平衡[19]。在NAFLD 患者中,肥胖患者的血清瘦素水平显着升高,而通过减重手术6 个月后其血清瘦素水平明显降低[20]。我国一项研究表明,一些瘦素受体多态性也可能与代谢性肝病有关。瘦素受体K109R 和Q223R 的多态性可能会增加患NAFLD 和冠状动脉粥样硬化的风险,而血清瘦素水平升高也与肝脏炎症和纤维化的严重程度相关[21]。此外,瘦素具有一定促炎功能,能诱导炎症细胞因子的表达,这可能反过来使脂肪细胞释放瘦素。在肥胖症患者中,瘦素不能纠正高血糖,这可能与代谢失调和肥胖导致的“瘦素抵抗”有关,它最终导致进食过多、肥胖、IR 和脂肪肝[22]。
瘦素可诱导肝形状细胞激活和增殖,削弱肝纤维化的降解,同时抑制TRAIL 及FasL,并可通过诱导肝星状细胞中转化生长因子(transforming growth factor beta,TGF-β)和结缔组织生长因子的表达,使TGFβ1、血管生成素-1、血管内皮生长因子、Ⅰ型胶原蛋白转录增加,从而加重了NALFD 肝纤维化[23]。有研究提示,单纯性脂肪变性和NASH 患者的血清瘦素量与NAFLD 严重程度呈正相关。二甲双胍虽没有被证明是治疗人类NASH 的有效疗法,但其能够上调小鼠瘦素受体表达,同时降低甘油三酯水平,改善肝脂肪代谢[24]。
3.3 抵抗素
抵抗素是一种多由脂肪组织内单核/巨噬细胞分泌脂肪因子,其可能与IL-1、IL-6、IL-12 和TNF-α 等依赖核因子κB(nuclear factor kappa-B,NF-κB)促炎因子激活的炎症反应有关[25]。在一项针对NAFLD 者的肝脏活检NAFLD 活动评分,证明参与者的肝纤维化程度与血清中抵抗素、IL-8、单核细胞趋化蛋白1、可溶性IL-1 受体和TNF-α 水平升高有关[26]。Wen 等[27]研究表明,NAFLD 小鼠中,抵抗素与肥胖、IR 密切相关,肝脏组织中抵抗素明显增加可改变肝细胞线粒体形态,而通过AMPK/PGC-1α(过氧化物酶体增殖物激活受体-γ 共激活因子-1α)途径可加重雄性小鼠的肝脏脂肪变。它揭示了一条抵抗素诱导脂肪生成的新途径,并表明维持线粒体稳态可能是预防抵抗素诱导的NAFLD 进展的关键。
3.4 内脂素
内脂素又称为烟酰胺磷酸核糖转移酶,是一种在男性冠心病患者心外膜脂肪组织中发现高表达的脂肪细胞因子,它在全身多种细胞表达的前体B 细胞克隆增强子,具有促炎特性与IR 有关,可以导致胰岛素分泌缺陷[28]。而研究表明,内脂素激活胰岛素受体和ERK1/2 信号,使脂肪细胞和肌细胞摄糖增加,促IR[29]。HepG2 细胞中,内脂素通过抑制JAK2/STAT3 和IKK/NF-κB 信号的调节通路诱导促炎细胞因子的产生和抑制胰岛素信号传导[30]。内脂素在NAFLD 中的作用仍有争议,需要更深入的实验来澄清其机制。
3.5 视黄醇结合蛋白4
视黄醇结合蛋白4 是一种特定的视黄醇/维生素A 载体蛋白,属于脂质运载蛋白家族,其主要在肝脏中合成,也作为脂肪因子从脂肪组织中释放出来。全反式视黄醇结合诱导RBP4 分泌,维生素A 缺乏导致RBP4 在人肝脏中积累[31]。在NAFLD,肝脏维生素A稳态被破坏,这可能会导致疾病进展。国内Wang 等[32]针对我国大量NAFLD 者进行3.09 年随访,观察到血清RBP4 水平与NAFLD 的发生呈正相关。在NASH,肝脏RBP4 蛋白高表达与中、重度纤维化评分和小叶炎症评分呈正相关,而脂肪细胞RBP4 表达可能导致IR 和T2DM[33]。鉴于RBP4 的多效性、NAFLD 疾病阶段之间的差异和所研究的不同人群的特征等,RBP4作用机制仍不能被确定。
4 前景及展望
肝脏脂质沉积致肝脏受到脂毒性影响,导致肝细胞凋亡,肝内炎症细胞激活,其过程被认为是单纯脂肪肝向NASH/NAFLD 进展的关键。因此,了解脂质因子在肝-AT 轴调节过程,对于研究NAFLD 向晚期肝病演变至关重要。本文仅以目前研究较多脂肪因子着手,分析回顾了脂联素、瘦素、抵抗素、内脂素、视黄醇结合蛋白4 等脂质因子在NAFLD 疾病进展过程中表达水平及可能的作用机制(具体作用机制总结见图1)。其中,瘦素、抵抗素、内脂素、视黄醇结合蛋白4 等脂质因子与NAFLD 呈正相关,仅有脂联素与NAFLD 呈负相关,对NAFLD/NASH 疾病有改善效果。已有一些脂质因子的激动剂、类似物、抑制剂[24,34-35]等应用临床试验中,相信随着各种脂质因子大量的研究的不断推进,其相互间作用机制研究的完善,将会给NAFLD 相关肝脏疾病的治疗带来希望。
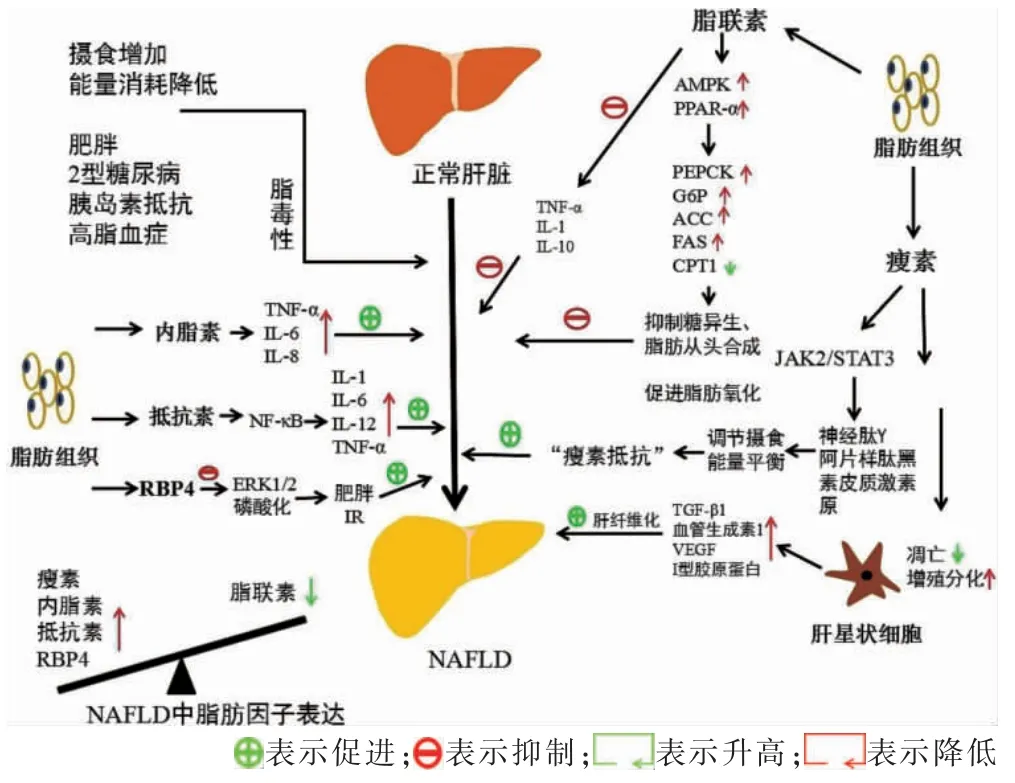
图1 脂肪因子的作用机制



