叶芳兵 朱宝菊
郑州大学第二附属医院妇产科,河南郑州 450014
侵入性胎盘是子宫内膜不全或损伤导致子宫蜕膜缺陷,使胎盘绒毛异常侵入甚至穿透子宫肌层的病理现象[1]。侵入性胎盘的主要发病因素包括剖宫产史和前置胎盘。随着剖宫产率的增加及子宫肌瘤剔除等宫腔操作手术的增加,全球范围内侵入性胎盘疾病的发病率持续增加,从40 年前的1/30 000 增加为1/300[2-3]。侵入性胎盘是导致产后出血、休克、子宫切除甚至死亡等产科严重并发症的重要原因[4]。而且侵入性胎盘起病隐匿,处理时被动且棘手,给产科医生带来了巨大挑战。了解侵入性胎盘疾病的具体发生机制,从分子水平上寻求该病的标志物,以期尽早发现、诊断甚至治疗该病有重大意义。
侵入性胎盘滋养细胞发生与肿瘤细胞侵袭类似的上皮间质转化(epithelialmesenchymaltransition,EMT)过程[5],推测侵入性胎盘疾病的具体发生机制可能与一系列具有EMT 特征性的因子调控相关。近年来国内外研究显示,基质金属蛋白酶2(matrix metallopeptidase 2,MMP2)、胰岛素样生长因子2 mRNA 结合蛋白2(insulin like growth factor 2 mRNA binding protein 2,IGF2BP2)及高迁移率族蛋白A2(high mobility group A2,HMGA2)不仅参与肿瘤细胞EMT 过程在其侵袭和转移过程中发挥重要作用,而且参与滋养细胞浸润迁移的调控。本研究通过检测以上3 种因子在侵入性胎盘组织中的表达,初步探讨其与侵入性胎盘疾病的发生关系,以便为该病的早期预测及诊疗提供新的医学思路及临床方法提供参考依据。
1 资料与方法
1.1 一般资料
选取2021 年3 月至12 月于郑州大学第二附属医院(以下简称“我院”)产科分娩并确诊为侵入性胎盘疾病的孕妇23 例为侵入性胎盘组,同期正常妊娠孕妇29 名为对照组。纳入标准:①符合侵入性胎盘诊断标准[1];②受试者及其家属知情同意。排除标准:①伴妊娠糖尿病、感染、免疫类疾病及妊娠高血压等并发症;②合并肿瘤、各器官功能障碍等。侵入性胎盘组分娩孕龄小于对照组,差异有统计学意义(P <0.05);两组年龄、孕次、宫腔操作次数(包括剖宫产、其他子宫手术、清宫术)比较,差异无统计学意义(P >0.05),见表1。本研究经我院医学伦理委员会批准(2021322)。
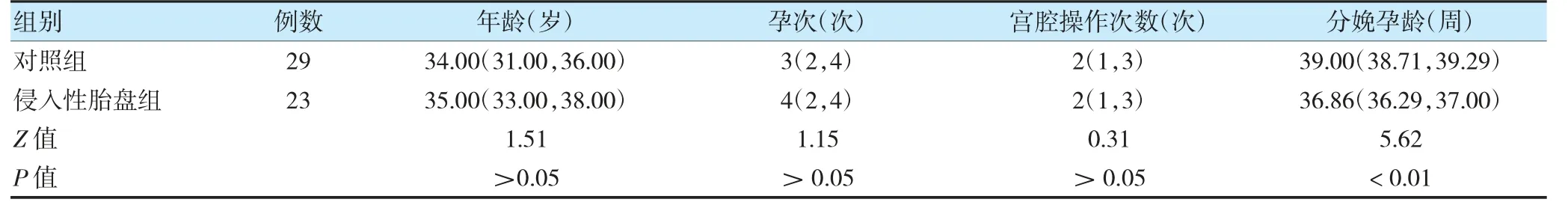
表1 两组一般资料比较[M(P25,P75)]
1.2 研究方法
两组于胎盘娩出30 min 内避开出血坏死、钙化区域,剪取粘连植入病灶中心区域或正常胎盘母体面靠近脐带的中央组织2 块,大小约1 cm×1 cm×1 cm,经无菌0.9%氯化钠液漂洗后,所有组织均保存在液氮中。
1.3 观察指标
1.3.1 Western blot 取适量待测样本,将其放在灭菌后的钵体中研磨,取准备好的磷酸盐缓冲液处理样本,取适量的细胞裂解液与处理后的样本混匀并破碎细胞;室温下12 000 r/min 离心15 min(离心半径为21 cm),取上清液。制备BCA 液进行蛋白浓度测定。应用SDS-PAGE 系统对获得的总蛋白电泳,电泳结束后进行PVDF 转膜。将PVDF 膜封闭1 h 加入一抗(1∶1 000 稀释)和二抗(1∶1 000 稀释),使用ECL 试剂盒处理后,放入化学发光成像系统成像并保存条带图像。
1.3.2 实时定量PCR 取适量待测样本加入液氮研磨粉碎,加入1 ml Trizol 提取总RNA,并进行RNA 浓度和纯度的检测。使用invitrogen 的逆转录试剂盒superscript Ⅲ合成cDNA,取2 μl cDNA 作为模板进行实时荧光定量检测。引物序列包括Actin 正向引物:5’-TCCTCCTGAGCGCAAGTACTCC-3’,反向引物:5’-CATACTCCTGCTTGCTGATCCAC-3’(22 bp);MMP2 正向引物:5’-AGTTTCCATTCCGCTTCCAG-3’,反向引物:5’-CACCTTCTGAGTTCCCACCAA-3’(20 bp);IGF2BP2正向引物:5’-GAAGCCTGTCACCATCCA-3’,反向引物:5’-GGTCTCATCTGCCTCTTTC-3’(18 bp);HMGA2正向引物:5’-TAGGAAATGGGCTGGAGTGG-3’,反向引物:5’-GGTGGTGGGTGCCTGTAATC-3’(20 bp)。反应条件:预变性95℃5 min;95℃10 s,58℃20 s,72℃20 s,40 个循环。
1.4 统计学方法
采用SPSS 26.0 软件进行数据分析。符合正态分布的计量资料用均数±标准差()表示,比较采用t检验;不符合正态分布的采用中位数(M)和四分位数(P25,P75)表示,比较采用Mann-Whitney U 检验。计数资料用例数表示。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组IGF2BP2、HMGA2、MMP2 蛋白表达比较
侵入性胎盘组IGF2BP2、HMGA2、MMP2 高于对照组,差异有统计学意义(P <0.05)。见图1。
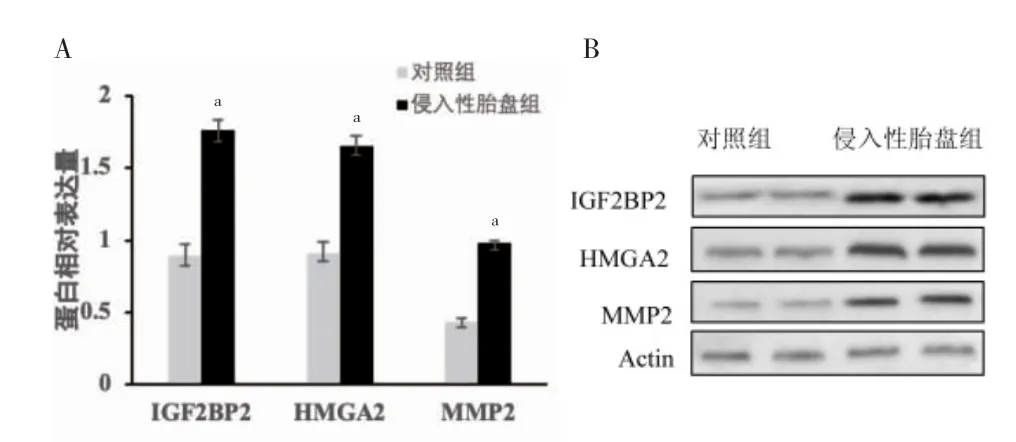
图1 两组IGF2BP2、HMGA2、MMP2 蛋白表达比较
2.2 两组IGF2BP2、HMGA2、MMP2 mRNA 比较
侵入性胎盘组IGF2BP2、HMGA2、MMP2 mRNA表达水平高于对照组,差异有统计学意义(P <0.05)。见图2。

图2 两组IGF2BP2、HMGA2、MMP2 mRNA 比较
3 讨论
3.1 MMP2 在侵入性胎盘组织中的表达及意义
MMP2 属于MMPs 家族,是一种锌依赖的人体内重要的蛋白水解酶,可以降解多种胶原蛋白,影响细胞的生长、增殖、迁移[6]。研究表明,MMP2 与肿瘤细胞增殖及侵袭转移的作用机制密切相关[7],MMP2 可由滋养细胞分泌,是酶解子宫内膜外基质和基底膜的关键调控因子,可促进滋养细胞入侵子宫内膜,是妊娠早期调控滋养细胞浸润过程的关键酶[8]。Ding 等[9]研究发现,MMP2 低表达会导致滋养细胞浸润能力下调,子宫螺旋动脉重铸不足,与子痫前期的发生有关。本研究结果与Kocarslan 等[10]研究结果相符。推测胎盘组织中MMP2 表达升高,滋养细胞侵袭性增强,细胞外基质的降解增多,促进滋养细胞侵入肌层,可能导致侵入性胎盘的发生。
3.2 IGF2BP2 在侵入性胎盘组织中的表达及意义
IGF2BP2 属于IGF2BP 结合蛋白家族,作为一种新发现的m6A 解读器,具有直接结合靶基因的mRNA稳定靶基因和促进靶基因mRNA 蛋白翻译的作用,参与多种生命活动,并促进相关疾病的发生发展[11]。IGF2BP2 可通过激活PI3K/Akt 信号通路,来增殖和抗凋亡癌细胞,促进肿瘤增殖[12]。研究表明,IGF2BP2在多种癌症如胆囊癌[13]、神经胶质瘤[14]等肿瘤组织中高表达,通过促进EMT 变化,在肿瘤细胞的侵袭迁移调控中发挥关键作用。研究显示,IGF2BP2 在卵母细胞和早期胚胎中高表达,与受精卵的着床、胚胎发育有关[15]。
Wu 等[16]研究发现,IGF2BP2 可以促进滋养层细胞的浸润和迁移,其蛋白水平在重度子痫前期患者胎盘中显着降低。本研究结果显示,侵入性胎盘组织中IGF2BP2 表达显着升高。由此推测,其可能增强了滋养细胞的浸润能力。Yang 等[17]研究发现,IGF2BP2 在子痫前期患者胎盘组织中表达降低,滋养细胞浸润能力减弱,胎盘浅着床。本研究与Yang 等[17]的研究结果相符。
3.3 HMGA2 在侵入性胎盘组织中的表达及意义
HMGA2 属于HMGA 家族,是一种非组蛋白结构的转录因子,其通过“AT-hook”结构与富含AT 的序列多种基因结合,并改变他们的染色质结构,进而调控转录活性,参与细胞凋亡、细胞周期、EMT 及端粒修复等生物过程[18-19]。研究显示,HMGA2 可在多种恶性肿瘤中高表达,通过促进EMT 变化来调控多种肿瘤细胞的侵袭和迁移,从而导致癌症的发生和进展[20-21]。Wei 等[22]研究发现,HMGA2 在子宫内膜样子宫内膜癌的早期促进EMT,是子宫内膜浆液性腺癌有用的生物标志物。HMGA2 在滋养层细胞的细胞核中表达,且在浸润母体蜕膜将胎盘体与子宫壁结合的高侵袭性的绒毛外细胞细胞质中表达最强[23]。研究发现,HMGA2 基因在人类滋养细胞祖细胞向绒毛外细胞分化的过程中发挥关键作用[24-25]。Abi Habib 等[26]研究发现,HMGA2-PLAG1-IGF2 通路的遗传破坏可导致胎儿生长受限。这些均提示HMGA2 可能参与滋养细胞浸润过程的调控。Burchardt 等[27]研究发现,HMGA2 在妊娠早期滋养细胞中高表达,而其在流产患者绒毛和蜕膜中表达降低,表明HMGA2 表达水平降低,可导致滋养细胞浸润性下降,血管重铸不足,与自然流产、胚胎停育等病理妊娠的发生有关。本研究结果显示,侵入性胎盘组织中HMGA2 表达水平显着升高。由此可知,HMGA2 在胎盘组织中高表达,可能与提高滋养细胞的侵袭能力及侵入性胎盘的形成有关。
综上所述,MMP2、IGF2BP2 及HMGA2 在侵入性胎盘组织中高表达,促进胎盘滋养细胞过度侵入子宫肌层,与侵入性胎盘的形成相关,可为侵入性胎盘的成因及临床预测提供参考依据。



