蔡姿秀 周国华 田 军
1.杭州市萧山区第一人民医院儿科,浙江杭州 311200;2.杭州市萧山区第三人民医院儿科,浙江杭州 311256
支气管哮喘(以下简称“哮喘”)是儿童常见的慢性呼吸道疾病。有研究显示,我国每十年哮喘患儿发病率上升20%~50%,严重影响患儿身心健康[1]。目前,哮喘发病机制尚不完全清楚,有研究认为维生素D(vitamin D,VitD)和体内微生物变化也是发病的重要因素[2]。VitD 能调节Th1/Th2 平衡,在免疫细胞分化和发育中起重要作用[3-7]。VitD 及其信号通路可通过影响肠道屏障完整性及微生物组成,进而影响肠道免疫反应[8-9]。本研究通过体外补充VitD 方式,观察哮喘幼鼠外周血T 淋巴细胞及肠道菌群改变,从而阐述哮喘患儿VitD、肠道菌群、免疫平衡三者的相互作用。
1 材料与方法
1.1 实验动物
7 d 龄体重4.09~6.13 g 的SPF 级野生型BALB/c雌性幼鼠,浙江中医药大学动物实验中心提供,许可证号:SCXK(沪)2018-0006,合格证号:20180006035029。本研究经浙江中医药大学实验动物管理与伦理委员会批准(IACUC-20211025-07)。动物饲养环境温度为21~25℃,湿度为50%~60%。
1.2 主要试剂及仪器
幼鼠Th1、Th2、Th17、调节性T 细胞(regulatoryTcell,Treg)流式细胞检测试剂盒(杭州联科生物技术股份有限公司,70-KTH201-25、70-KTH217-25、70-KTH219-25);卵清蛋白(ovalbumin,OVA)致敏液(Sigma,A5503-1G);氢氧化铝(Thermo,77161);磷酸盐缓冲液(Biosharp,BL302A);雾化器[百瑞医疗科技(常州)有限公司,BRM-077Ⅲ];显微镜(Leica,DM2000)。
1.3 动物分组和模型制备
动物常规饲养2 d 后开始实验,选取30 只幼鼠按随机数字表法分为哮喘模型组15 只,VitD 干预组15 只,另选10 只作为健康对照组。实验第1、7 天,哮喘模型组和VitD 干预组予10%OVA 致敏液200 μl腹腔注射;健康对照组注射等量生理盐水。实验第19天,将哮喘模型组和VitD 干预组置于20 cm×20 cm×30 cm的密闭容器内,给予3%OVA 溶液10 ml 雾化吸入20 min,健康对照组在相同条件下雾化吸入等量生理盐水。1 次/d,连续雾化6 d。幼鼠在雾化过程中有明显活动过多、搔耳桡鼻,证明造模成功[10]。
1.4 干预给药
实验第18 天,VitD 干预组给予VitD 滴剂[国药控股星鲨制药(厦门)有限公司]灌胃,给药剂量为35 μg/(kg·周),1 次/2 d,共2 周,其余两组均给予等体积磷酸盐缓冲液灌胃[11]。
1.5 标本采集
三组给药结束24 h 后摘除眼球取血至抗凝试管,4℃保存送检。取血后处死动物,打开胸腔暴露肺组织,取出右肺放入10%甲醛溶液中,常温固定72 h;剪开腹腔分离结肠,取出粪便放置于冻存管,加入液氮置于-80℃冰箱保存送检。
1.6 观察指标及检测方法
1.6.1 肺组织切片染色 肺组织经固定、脱水、包埋、切片并行苏木精-伊红染色,置于光学显微镜下观察肺组织病理改变。
1.6.2 流式细胞仪检测 取抗凝血裂解红细胞,制备单细胞悬液,采用流式细胞仪检测并计算三组外周血Th1/Th2 比值、Th17/Treg 比值,按照仪器及试剂盒说明书操作。
1.6.3 16S rDNA 测序 将三组粪便送至杭州联川生物科技股份有限公司行16S rDNA 测序。通过对基因序列剪切过滤,测得每份样品中基因序列条数,在门和属水平上分析物种丰富度,计算Alpha、Beta 多样性,并进行比较。Alpha 多样性可反映特定环境或生态系统内微生物群落的丰富度和多样性,Beta 多样性可用于分析物种间差异性。
1.7 统计学方法
采用SPSS 23.0 统计学软件进行数据分析。计量资料采用均数±标准差()表示,比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 三组肺组织病理学结果
健康对照组肺组织支气管壁及肺泡壁结构完整,肺泡腔内无渗出,肺泡上皮排列有序,肺泡壁厚度正常;哮喘模型组肺泡壁结构受损,肺泡上皮细胞破坏,气管平滑肌增厚,管腔狭窄,黏膜充血水肿,血管周围炎症细胞浸润。VitD 干预组与哮喘模型组比较,肺组织炎症反应明显减轻。见图1。
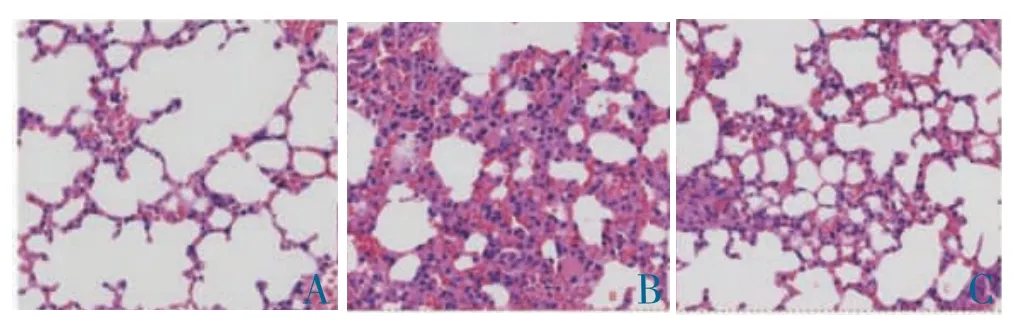
图1 三组肺组织苏木精-伊红染色(200×)
2.2 三组Th1/Th2 比值、Th17/Treg 比值比较
哮喘模型组外周血Th1/Th2 比值低于健康对照组,Th17/Treg 比值高于健康对照组,差异有统计学意义(P<0.05)。VitD 干预组Th1/Th2 比值高于健康对照组,Th17/Treg 比值低于健康对照组,差异有统计学意义(P<0.05)。见表1。
表1 三组Th1/Th2 比值、Th17/Treg 比值比较()
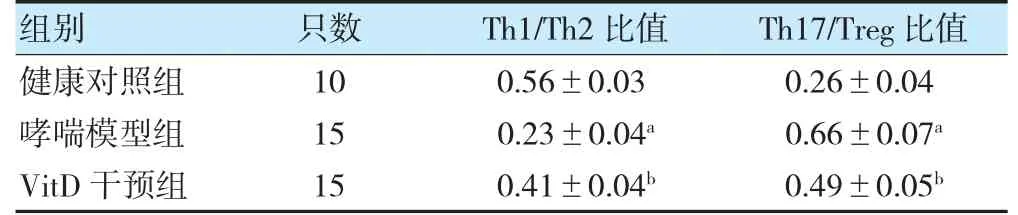
表1 三组Th1/Th2 比值、Th17/Treg 比值比较()
注 与健康对照组比较,aP<0.05;与哮喘模型组比较,bP<0.05。Treg:调节性T 细胞;VitD:维生素D
2.3 三组肠道菌群测序比较
2.3.1 三组肠道菌群Shannon 指数曲线分析 三组测序样本微生物物种Shannon 指数曲线趋平缓,提示数据量足够大,物种丰度高且分布均匀。见图2。

图2 三组肠道菌群Shannon 指数曲线
2.3.2 三组肠道菌群Alpha 多样性分析 Alpha 多样性分析显示,三组Simpson 指数比较,差异无统计学意义(P>0.05)。见图3。
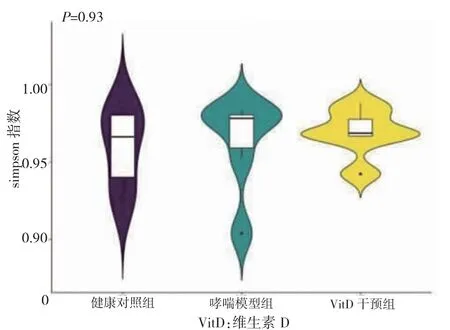
图3 三组肠道菌群Simpson 指数比较
2.3.3 三组肠道菌群Beta 多样性分析PCoA 图分析显示,各组组内样本呈现聚集倾向,而组间样本之间距离接近,组内样本均在95%置信区间内,其中哮喘模型组和健康对照组组间距离大,VitD 干预组与哮喘模型组组间距离近,差异有统计学意义(P=0.001)。见图4。
2.3.4 三组肠道菌群物种组成分析 门水平上包括15个门,Firmicutes 和Bacteroidota 是绝对优势菌群。哮喘组Actinobacteriota 丰度低于健康对照组,Proteobacteria 丰度高于健康对照组,VitD 干预组Actinobacteriota、Proteobacteria 丰度均高于哮喘模型组,差异有统计学意义(P<0.05)。见图5。属水平上包括23 个属,哮喘模型组Helicobacter、Colidextribacter 丰度低于健康对照组,Ligilactobacillus、Bacteroides 丰度高于健康对照组,VitD 干预组Helicobacter、Colidextribacter 丰度高于哮喘模型组,Ligilactobacillus、Bacteroides 丰度低于哮喘模型组,差异有统计学意义(P<0.05),与基于属水平的heatmap 分析结果一致。见图6~7。
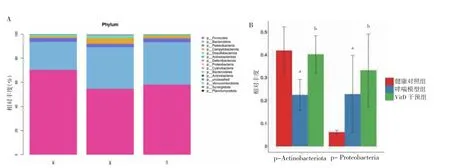
图5 三组肠道菌群门水平下物种组成分析
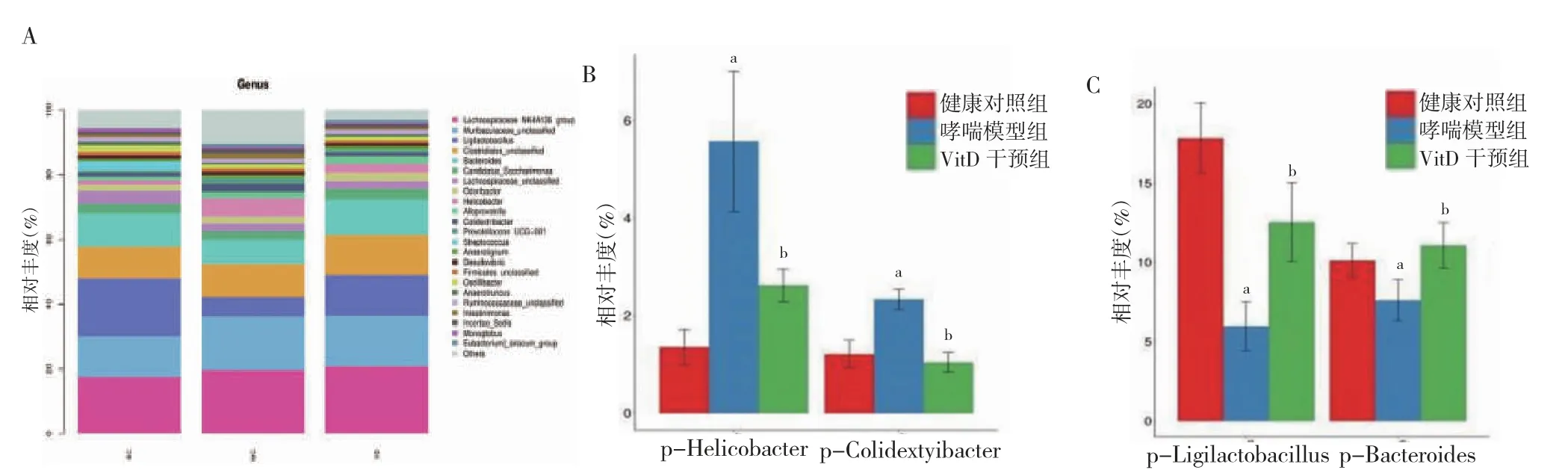
图6 三组肠道菌群属水平下物种组成分析
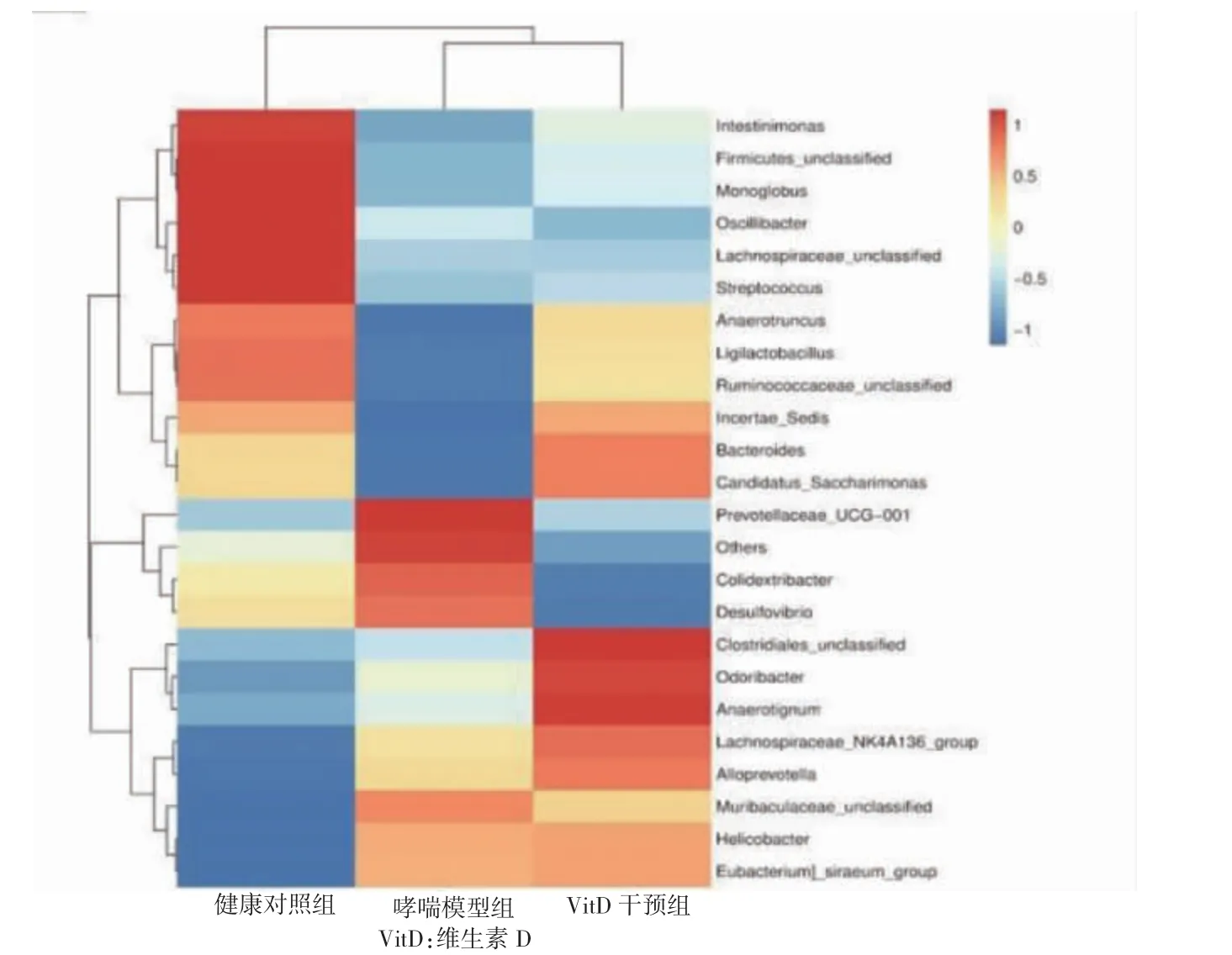
图7 三组肠道菌群属水平的heatmap 分析
3 讨论
经典Th1/Th2 细胞失衡被认为是哮喘主要发病机制,在炎症发展过程中起促进作用[12-13]。VitD 在体外抑制T 细胞产生白细胞介素-17 和γ 干扰素,可诱导肠道发挥免疫效应[14]。有研究发现,哮喘患儿中VitD水平普遍偏低,与哮喘严重程度呈负相关[15-16]。但Luo等[17]发现,补充VitD 后患儿哮喘发作率并没有改善。本研究给予VitD 干预的幼鼠血清Th1/Th2 水平较哮喘幼鼠上升,而Th17/Treg 水平下降,提示VitD 参与哮喘幼鼠免疫稳态。人类和啮齿动物的主要微生物群是Firmicutes 和Bacteroides[18],其为宿主提供营养、促进血管再生,增加IgA 表达,在能量代谢和免疫保护中发挥作用[19-22],同时肠道微生物可通过VitD 状态和/或暴露来改变[23]。有研究发现,补充VitD 会引起物种变化,使Bacteroides和Proteobacteria 增加[24-25]。本研究给予VitD 干预后发现,在VitD 干预组中Actinobacteriota、Proteobacteria 丰度较哮喘模型组增加,Helicobacter、Colidextribacter 丰度较哮喘模型组增加,而Ligilactobacillus、Bacteroides 较哮喘模型组丰度减少,上述结果与文献报道结果基本一致。
综上所述,本研究提示VitD 可调节哮喘失衡及改善肠道稳态,从一个新视角阐述“肺-肠轴”定义[26-28],但由于动物实验和临床存在差距,VitD 是否为肠道微生物群落影响肺免疫反应的推动因子这一推断及其可能的潜在机制仍需要更多研究来确认。



