刘翠翠 吴亚星 张淑婷 李向鑫 张 静
徐州医科大学徐州临床学院,江苏徐州 221000
牙周炎引起的牙槽骨吸收是造成牙齿松动甚至脱落的主要病因[1],临床上通过常规的牙周治疗较难完全恢复牙周组织的结构和功能,因此如何促进牙槽骨的修复及再生是治疗牙周炎的重要环节。
骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMMSC)近年来在修复牙周炎引起的骨组织缺损方面得到了广泛应用[2-5]。研究证实,BMMSC 发挥抗感染功能的一个重要机制是其能分泌可溶性因子,使BMMSC 与免疫细胞相互作用,诱导调节性T 细胞形成[6-7],调节性T 细胞通过调节损伤局部微环境、减少炎症因子分泌发挥其抗感染和免疫抑制作用[8-9]。近年研究显示,调节性T 细胞外泌体能够发挥与其同样的作用,是调节性T 细胞发挥生物功能不可或缺的组成部分[10]。前期研究证实炎性环境下BMMSC 上清液中高表达的转化生长因子(transforminggrowthfactor,TGF)-β1促进了BMMSC 内骨向分化标志物的表达[11]。然而调节性T 细胞是否参与了BMMSC 的骨向分化及其是否通过外泌体来调控BMMSC 的骨向分化目前仍不清楚。因此,本研究通过调节性T 细胞与BMMSC 共培养来明确其在BMMSC 骨向分化中的作用,同时对调节性T 细胞外泌体在骨向分化中的作用进行初步探讨。
1 材料与方法
1.1 主要材料
BMMSC(ScienCell,USA);CD4+T 细胞分离试剂盒(Miltenyi Biotec,GER);碱性磷酸酶(alkaline phosphatase,ALP)活性试剂盒;茜素红、ALP 染色试剂盒(Sigma-Aldrich);钙含量试剂盒(Sigma-Aldrich)。
1.2 实验方法
1.2.1 分离和诱导CD4+初始T 细胞分化为调节性T细胞 小鼠脾细胞用CD4+T 细胞分离试剂盒分离出幼稚CD4+初始T 细胞(CD4+naïve T cells,Th0)。采用抗CD3、抗CD28、TGF-β 和白细胞介素(interleukin,IL)-2激活分离的Th0。用FITC 偶联抗CD45RA 和APC 偶联抗CD4 抗体染色及PE 标记的抗Foxp3 抗体染色,流式细胞术鉴定。本研究经徐州医科大学附属徐州市中心医院伦理委员会批准(XZXY-LJ-20170217-003)。
1.2.2 分组方法 浆细胞分为对照组、实验组、抑制组。对照组:Th0 与BMMSC 共培养并矿化诱导;实验组:将Th0 诱导为调节性T 细胞后,与BMMSC 共培养并矿化诱导;抑制组:在实验组基础上加入10 μmol/L GW4869(外泌体抑制剂)并矿化诱导。三组分别于0、7 d 进行ALP 染色,7 d 进行ALP 活性检测,0 d 和21 d进行茜素红染色,21 d 进行钙含量分析及7 d 进行骨向分化基因的检测,所有实验均重复3 次。
1.2.3 ALP 染色及活性检测 在0、7 d 进行ALP 染色,染色面积应用Image J 软件定量分析;7 d 时用ALP活性试剂盒检测ALP 活性,酶标仪在520 nm 波长测定OD 值。
1.2.4 茜素红染色及钙含量分析 第0、21 天使用茜素红染色,镜下观察染色及矿化结节形成情况;第21 天使用钙含量试剂盒检测562 nm 波长处OD 值,确定钙浓度。
1.2.5 骨向分化基因的检测 在7 d 时提取总RNA,逆转录合成cDNA。PCR 反应体系总体积20 μl,加入SYNER Green qPCR Master Mix 10 μl,正反向引物各0.4 μl,相应cDNA 2 μl,Nuclease-Free water 补足至20 μl。按95℃预变性10 s;95℃5 s,60℃34 s,共40 个循环,以GAPDH 为内参基因,检测ALP、OCN、Runx2 成骨相关基因的表达。引物序列见表1。

表1 实时定量PCR 引物序列
1.3 统计学方法
采用GraphPad Prism 9.3.1 软件进行数据分析。计量资料采用均值±标准差()表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 流式细胞术鉴定调节性T 细胞
CD4+初始T 细胞经免疫磁珠分离后,CD4+阳性细胞比例为97.26%,Foxp3+阳性细胞比例为85.96%,纯度均>85%,根据免疫表型确定为调节性T 细胞。见图1。
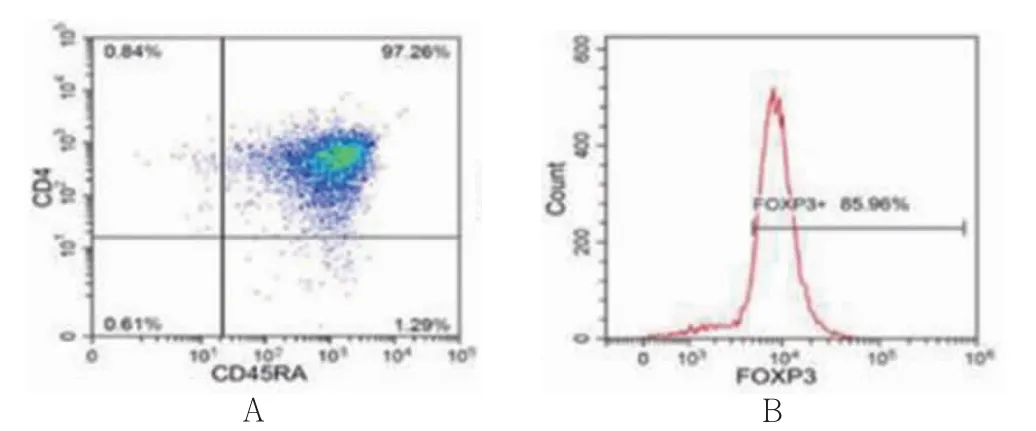
图1 流式细胞术鉴定调节性T 细胞(n=3)
2.2 ALP 染色及活性检测
实验组ALP 染色较对照组染色深,染色面积较大(P<0.05);抑制组ALP 染色面积小于实验组(P<0.01);实验组ALP 活性高于对照组(P<0.01),抑制组ALP 活性低于实验组(P<0.01)。见图2。
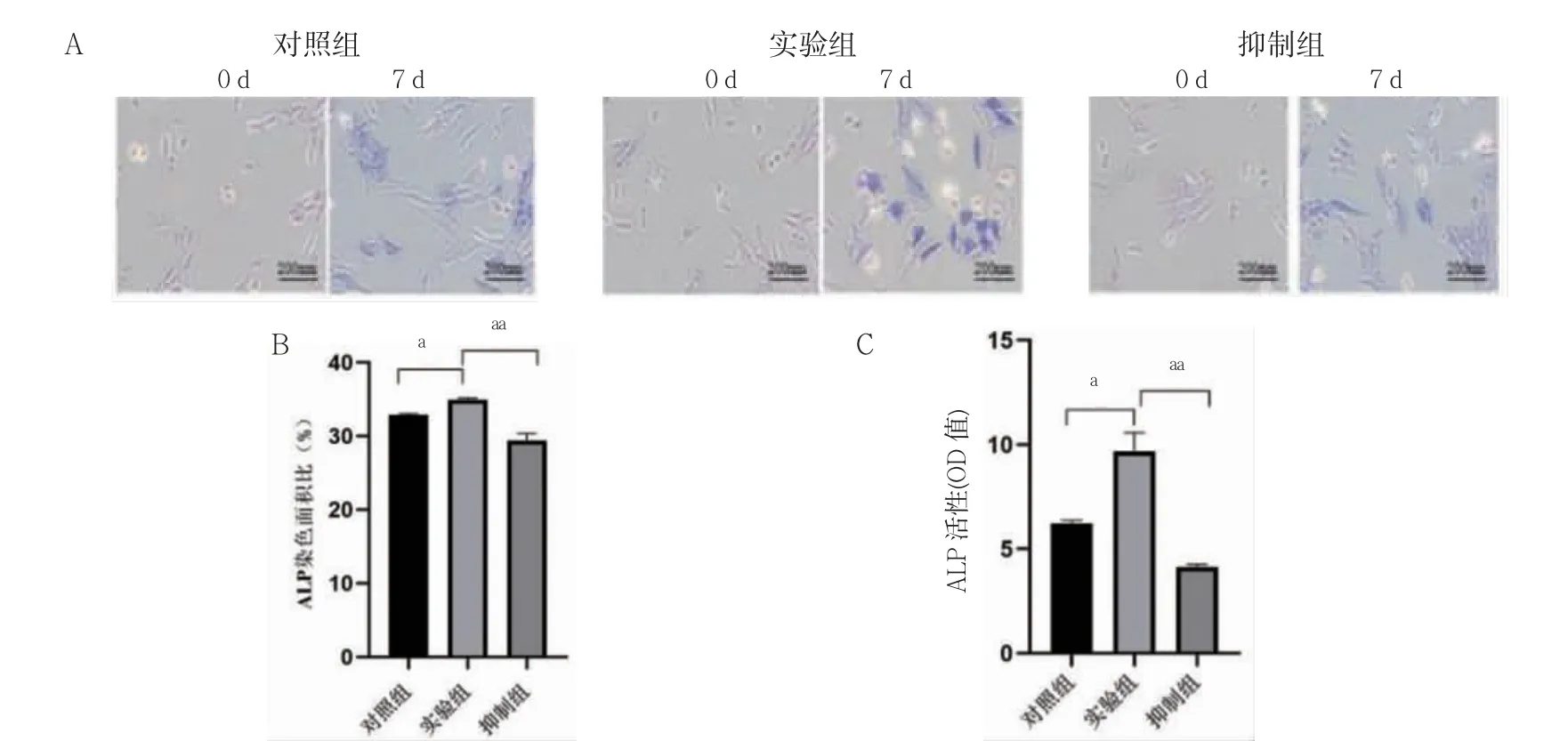
图2 ALP 染色及ALP 活性检测(n=3)
2.3 各组茜素红染色及钙含量分析
实验组较对照组矿化结节形成多,染色明显,抑制组比实验组矿化结节形成明显减少。实验组内钙含量高于对照组,抑制组钙含量低于实验组(P<0.01)。见图3。
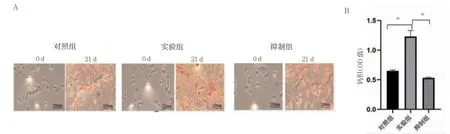
图3 各组茜素红染色及钙含量分析(n=3)
2.4 各组骨向分化基因相对表达量比较
实验组ALP、OCN、Runx2 mRNA 相对表达比对照组(P<0.01);抑制组ALP、OCN、Runx2 mRNA 相对表达量低于实验组(P<0.01)。见图4。
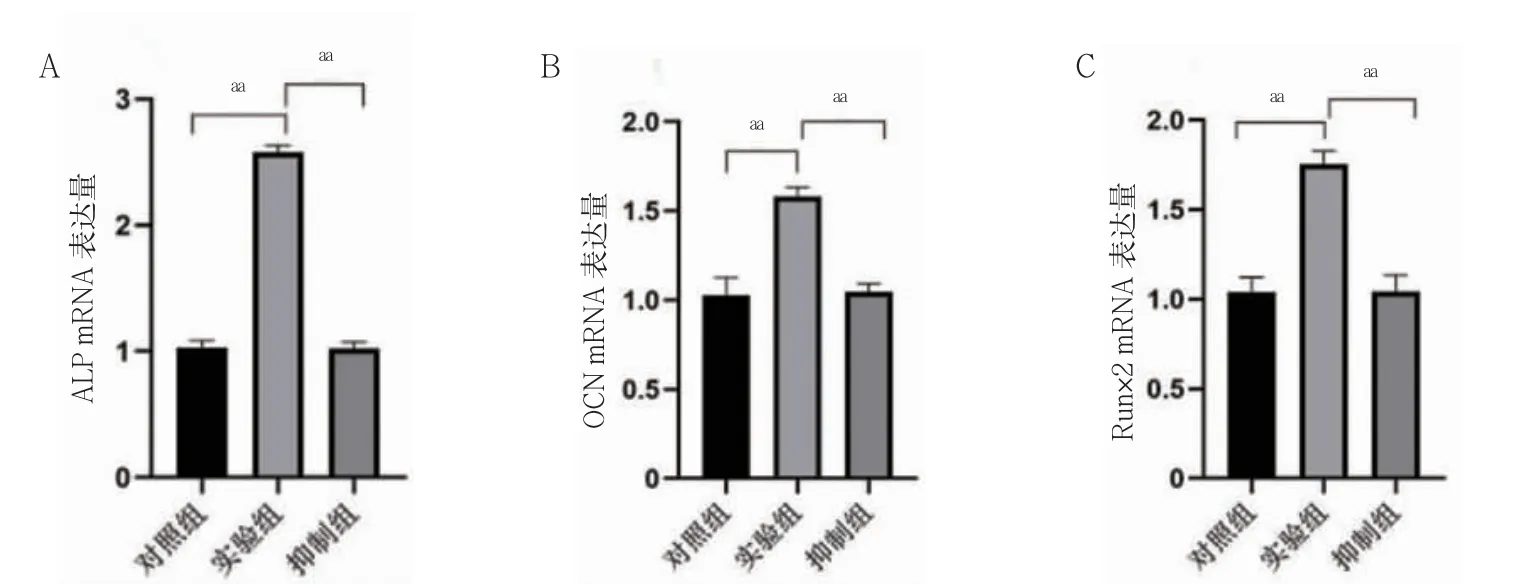
图4 各组骨向分化基因相对表达量比较(n=3)
3 讨论
干细胞的分化受其生存微环境的调控,涉及众多细胞、因子、基因等的表达,构成了影响干细胞定向分化的复杂网络系统[12]。研究证实调节性T 细胞在维持体内免疫稳态和炎症反应中发挥重要作用,是重要的免疫调节功能细胞[13-15]。调节性T 细胞和BMMSC 二者联合治疗能提高临床疗效[16-17]。Caplan 等[18]报道创伤性脑损伤后应用调节性T 细胞和BMMSC 联合治疗比单一疗法更有效减少神经和外周炎症反应。因此,研究调节性T 细胞在BMMSC 骨向分化中的作用对修复炎症导致的牙周骨缺损具有重要意义。
本研究将调节性T 细胞与BMMSC 共培养来观察其在BMMSC 骨向分化中的作用,表现为ALP 染色深,ALP 活性高,茜素红染色矿化结节形成较多和钙含量增高,成骨基因ALP、OCN 和Runx2 表达均显着高于对照组,证实调节性T 细胞能够促进BMMSC 骨向分化。与文献报道的调节性T 细胞提高BMMSC 介导的骨形成的结果一致[19-20]。
外泌体是由多种细胞合成并分泌至胞外的囊泡,包含多种生物活性物质,可传递细胞间信息及物质交换,在免疫应答、炎症反应等过程中发挥重要的调节作用[21]。调节性T 细胞外泌体影响T 效应细胞因子的产生并防止人体皮肤同种异体移植损伤[22];调节性T细胞外泌体在脑缺血性卒中治疗中通过激活PI3K/Akt信号传导对小胶质细胞引起的OGD/R 损伤具有保护作用[23]。研究证实调节性T 细胞来源外泌体内miR-709 能够减轻脊髓损伤后小胶质细胞焦下垂并促进运动功能恢复[24]。使用CD4+T 细胞外泌体可作为新型抗肿瘤治疗的策略[25]。本研究发现在调节性T 细胞与BMMSC 共培养中加入外泌体抑制剂GW4869后,BMMSC 成骨分化能力明显降低。因此,初步推测调节性T 细胞可能是通过其分泌的外泌体参与调节BMMSC 的骨向分化。然而,调节性T 细胞来源的外泌体是如何参与BMMSC 的骨向分化过程,其机制有待进一步研究与探讨。



