黎嘉茗 张万青 刘潇潇
【摘 要】目的:建立孕康口服液中驴皮源及牛皮源成分的专属性检测方法。方法:选用胰蛋白酶技术对孕康口服液中胶类成分进行处理,利用超高效液相色谱-三重四极杆质谱(UPLC-QQQ-MS)对驴皮源及牛皮源成分的专属性特征分子离子峰进行检测。结果:10批样品均检出驴皮源成分的特征离子峰,并且均未检出牛皮源成分的特征离子峰。结论:该方法操作简便、准确、快速,灵敏度高,可用于孕康口服液中驴皮源的鉴别及牛皮源的检查。
【关键词】超高效液相色谱-三重四极杆质谱;孕康口服液;驴皮源;牛皮源;特征肽
【中图分类号】
R284.1 【文献标志码】 A【文章编号】1007-8517(2024)06-0043-04
DOI:10.3969/j.issn.1007-8517.2024.06.zgmzmjyyzz202406010
Determination of Donkey Skin and Bovine Skin in Yunkang Oral Liquid by UPLC-QQQ-MS
LI Jiaming ZHANG Wanqing LIU Xiaoxiao*
Guangdong Institute for Drug Control,Guangzhou 510663,China
Abstract:Objective To establish a specific method for determination of donkey skin and bovine skin in Yunkang oral liquid.Methods The trypsin technology was used to treat the gum components in Yunkang oral liquid,the specific molecular ion peaks of the components from donkey skin and bovine skin were detected by UPLC-QQQ-MS.Results The characteristic ion peaks of donkey skin components were detected in all 10 samples,and no characteristic ion peaks of bovine skin components were detected.Conclusion The method is simple,accurate,rapid and highly sensitive.It can be used for the identification of donkey skin source in Yunkang oral liquid and the examination of cow skin source.
Key words:UPLC-QQQ-MS;Yunkang Oral Liquid;Donkey Skin Source;Cow Skin Source;Characteristic Peptide
目前,市场上驴皮资源紧缺且价格高昂,少数药品企业可能会为了寻求更高的经济效益,将牛皮充当阿胶投料或掺伪,影响用药安全,为了保证药品的质量及提高检测的专属性,药品监管部门颁布了一系列胶类原料和制剂的检测方法[1-4]。孕康口服液作为临床常用药,由山药、续断、阿胶等二十三味中药材组成,具有健脾固肾,养血安胎的功效,临床用于肾虚型和气血虚弱型先兆流产和习惯性流产,该药收载于中国药典2020年版一部[2],但是正文项下并无胶类成分的检测项目。这种由中药材中的阿胶专属性检测方法的缺失,使以掺伪阿胶投料或少投料、不投料生产中成药的现象有了存在的空间。为了保证药品的质量及提高检测的专属性,作者结合相关研究[5-8],以超高效液相-三重四极杆质谱仪建立了含胶类中药孕康口服液中驴皮源及牛皮源成分的专属性检测方法,并进行了相关方法学验证,现报道如下。
1 仪器与材料
1.1 仪器 Waters XevoTQ-S三重四级杆质谱联用仪;DK-8D型电热恒温水槽;KQ-300DE型超声清洗器;sartorius CP225D电子天平;100 μL BRAND移液枪;10 μL BRAND移液枪。
1.2 对照品 阿胶对照药材(批号:121274-201703,中国食品药品检定研究院),黄明胶对照药材(批号:121695-201301,中国食品药品检定研究院)。
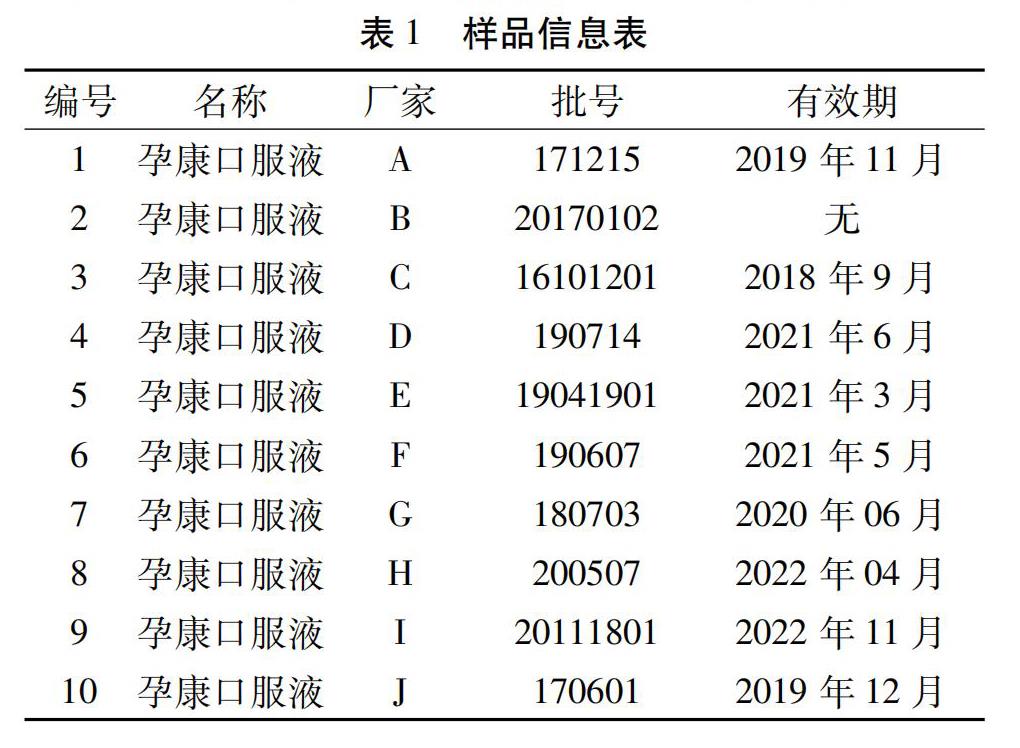
1.3 试药与试剂 孕康口服液样品10批,样品均为线上药店采购,详见样品信息表1。乙腈(批号:A801556)、甲酸(批号:A543804)均购自默沙东公司;碳酸氢铵(批号:20221001)购自广州化学试剂厂;胰蛋白酶(批号:0000138466)购于普洛麦格(北京)生物科技有限公司。水为纯化水。
2 方法与结果
2.1 色谱-质谱条件
2.1.1 色谱条件 照高效液相色谱-质谱法(中国药典2020年版通则0512、0431),以ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm)为色谱柱;以乙腈为流动相A,以0.1%甲酸溶液为流动相B,按表2进行梯度洗脱;流速为0.3 mL/min;进样量为5 μL。
2.1.2 质谱条件 采用质谱检测器,电喷雾正离子模式(ESI+),喷雾电压为3.1 kV,鞘气为20 Arb,辅助气为8 Arb,离子传输管温度350 ℃,蒸发温度350 ℃,扫描模式为 MRM,多反应监测(MRM),选择2020年版《中国药典》一部阿胶[2]项下的检测离子对与m/z 641.3(双电荷)→726.2和m/z 641.3(双电荷)→783.3作为检测离子对,碰撞能量分别为16 V和20 V,要求检测离子对测定的MRM色谱峰的信噪比大于10∶1。牛皮源质谱参数详见表3。
2.2 溶液的制备
2.2.1 供试品溶液制备 取本品4.0 mL,精密量取,置50 mL量瓶中,加1%碳酸氢铵溶液40 mL,超声处理30 min,加1%碳酸氢铵溶液稀释至刻度,摇匀,取上清液,用0.22 μm微孔滤膜滤过,精密量取续滤液100 μL,置微量进样瓶中,加胰蛋白酶溶液10 μL,摇匀,37 ℃恒温酶解12 h,即得。
2.2.2 阴性样品溶液制备 取不含牛皮源的样品,精密称定,照供试品溶液制备方法制得。
2.2.3 黄明胶对照药材溶液制备 取黄明胶对照药材粉末0.1 g,置50 mL量瓶中,加1%碳酸氢铵溶液40 mL,超声处理30 min,加1%碳酸氢铵溶液稀释至刻度,摇匀,用0.22 μm微孔滤膜滤过,精密量取续滤液100 μL,置微量进样瓶中,加胰蛋白酶溶液10 μL,摇匀,37 ℃恒温酶解12 h,即得。
2.2.4 阿胶对照药材溶液制备 取阿胶对照药材粉末0.1 g,自“置50 mL量瓶中”起,同黄明胶对照药材溶液制备的制备方法。
2.2.5 牛皮源参比溶液制备 取黄明胶对照药材0.10 g,精密称定,置50 mL量瓶中,加1%碳酸氢铵溶液40 mL,超声处理30 min,加1%碳酸氢铵溶液稀释至刻度,摇匀。精密量取上述溶液 5 mL,置100 mL量瓶中,加阿胶对照药材粉末0.20 g,加1%碳酸氢铵溶液80 mL,超声处理30 min,再加1%碳酸氢铵溶液稀释至刻度,摇匀,用0.22 μm微孔滤膜滤过,取续滤液100 μL,置微量进样瓶中,加胰蛋白酶溶液10 μL,摇匀,37 ℃ 恒温酶解12 h,即得。
2.2.6 胰蛋白酶溶液的制备 取序列分析级胰蛋白酶适量,加1%碳酸氢铵溶液制成每1 mL中含1 mg的溶液,作为胰蛋白酶溶液。本溶液临用新配。
2.3 方法学考察
2.3.1 专属性考察 以m/z 641.3(双电荷)→726.2,783.3作为检测离子对,按检测条件,分别检测合格样品、阴性样品、阿胶对照药材、黄明胶对照药材,结果发现阴性样品未检测出牛皮源特征离子对,说明孕康口服液中其它药味对牛皮源的检测无干扰。如图1、图2所示。
2.3.2 基质效应 取1 mL黄明胶对照药材溶液4份,置20 mL容量瓶中,分别以1%碳酸氢铵溶液、阿胶基质溶液、自制样品溶液稀释至刻度,摇匀,用0.22 μm微孔滤膜滤过,精密量取续滤液100 μL,置微量进样瓶中,加胰蛋白酶溶液10 μL,摇匀,37 ℃恒温酶解12 h,即得。
结果表明,以自制样品基质比以阿胶基质的响应值略小。本检查方法以阿胶基质代替自制样品基质制备参比溶液,相当于适当放宽检出限度。详见表4。
2.3.3 线性关系 取黄明胶0.1 g,置50 mL量瓶中,加1% 碳酸氢铵溶液至刻度,摇匀。吸取上述对照品溶液0.2 mL、0.4 mL、1 mL、2 mL、4 mL、10 mL,置20 mL量瓶中,加0.69 g自制样品(相当于含0.04 g阿胶的样品量),分别制得0.02 mg/mL、0.04 mg/mL、0.1 mg/mL、0.2 mg/mL、0.4 mg/mL、1 mg/mL黄明胶的系列对照药材溶液(相当于投料的阿胶中掺入1%、2%、5%、10%、20%、50%的黄明胶),按上述色谱条件,注入液相色谱仪,测得峰面积。以峰面积值为纵坐标,阿胶中掺入黄明胶的量为横坐标,绘制标准曲线。计算回归方程:m/z 641.3(双电荷)→783.3:Y=58834X-33.48,r2=0.995;m/z 641.3(双电荷)→762.2:Y=80995X-410.4,r2=0.995,在1%~10%范围内,黄明胶掺入量与色谱峰面积成正比关系。结果见表5和如图3、图4所示。
2.3.4 检测限 以m/z 641.3(双电荷)→726.2,783.3作为检测离子对,取黄明胶对照药材溶液,用自制样品溶液逐级稀释。浓度为0.001 mg/mL黄明胶溶液(相当于投料的阿胶中掺入0.05%黄明胶)特征峰m/z 641.3→783.3的信噪比为3.51,满足信噪比3的要求,作为本次试验的检测限。
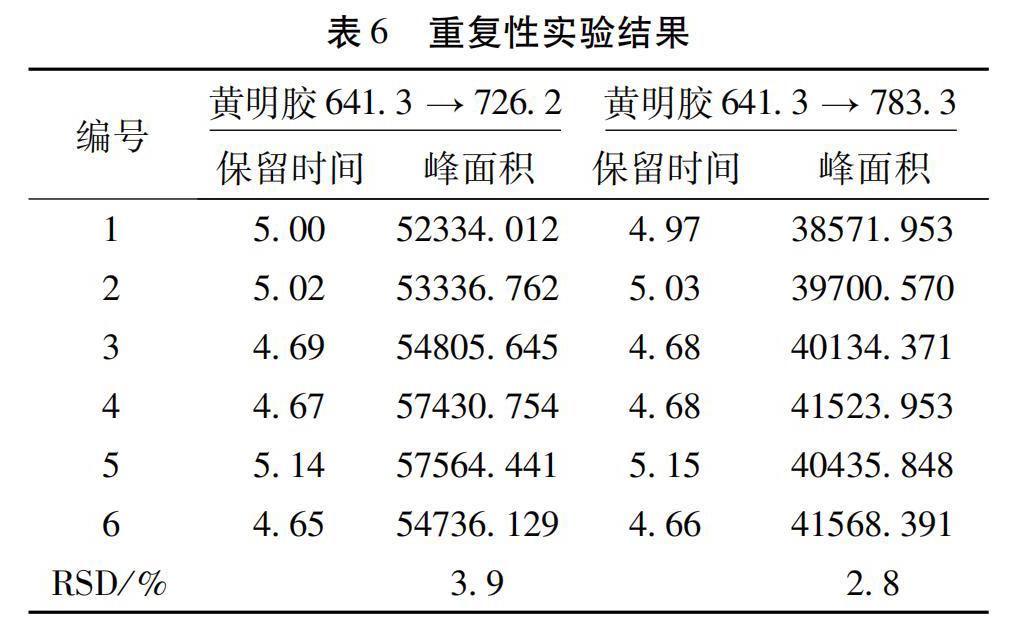
2.3.5 重复性试验 取供试品(批号:170601)平行制备6份,以黄明胶特征分子离子峰m/z 641.3→726.2,783.3作为检测离子对进行测定,比较峰面积。结果6份样品均检出相应的黄明胶特征分子离子峰。结果见表6,峰面积和保留时间的RSD均<10%,说明该法重复性良好。
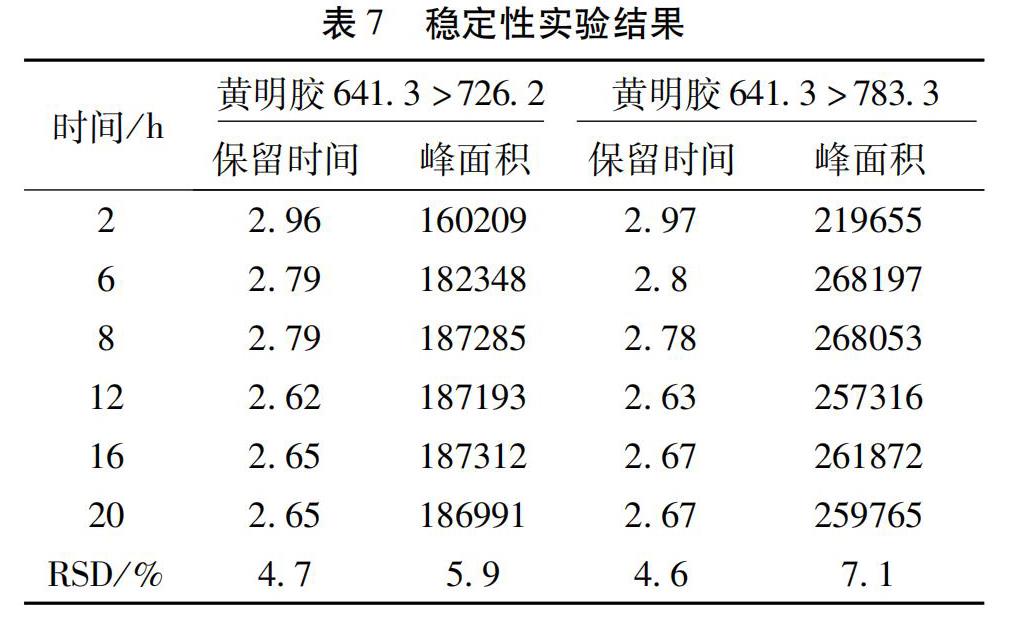
2.3.6 稳定性试验 取供试品(批号:170601),按拟定方法制备供试品溶液,分别于2 h、6 h、8 h、12 h、16 h、20 h内进样测定,提取黄明胶特征分子离子峰m/z 641.3→726.2,783.3,比较保留时间和峰面积(表7)。结果表明,样品在24 h内符合黄明胶检查的要求。
2.4 样品测定结果 10批孕康口服液均检出驴皮源成分,并且均未检出牛皮源成分。见表8。
3 讨论
分别采用Waters XevoTMTQ-S、Agilent G6460 Triple Quad两台质谱检测器,ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm)、Agilent SB-C1(2.1 mm×100 mm,1.8 μm)两根色谱柱,以m/z 641.3→726.2,783.3作为选择离子进行检测,考察该法的耐用性。结果参比溶液的信噪比均大于10,可满足检验要求。
制剂阿胶掺伪主要为牛皮源,本品种暂缺乏相关研究。本次项目组研究驴皮源与牛皮源的掺伪检测方法,采用三重四级杆质谱检测器结合本次研究的方法对10批孕康口服液进行检验,检测是否混入杂皮药材生产孕康口服液。该方法的建立,为进一步了解相关产品的质量状况提供了基础数据和方法依据。
综上,本研究建立的专属性检测方法,经过对多批次产品的验证,阴性无干扰,方法的专属性较强。能有效控制孕康口服液的投料,对孕康口服液中驴皮源及牛皮源成分的检测提供了一个有效的补充方法。
参考文献
[1]国家食品药品监督管理总局.药品检验补充检验方法和检验项目批准件2012001[S].北京,2012.
[2]中华人民共和国国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2020:197.
[3]国家食品药品监督管理总局,药品检验补充检验方法和检验项目批准件2014013[S].北京,2014.
[4]国家食品药品监督管理总局,药品检验补充检验方法和检验项目批准件2014014[S].北京,2014.
[5]程显隆,李文杰,魏锋,等.动物胶类药材的鉴别方法研究进展[J].亚太传统医药,2011,7(3):167-169.
[6]陈蕊,袁千,王凌.动物胶类药材质量评价方法研究进展[J].中国现代应用药学,2018,35(11):157-161.
[7]阳洪波,王韦达,李意,等.基于特征肽段的液相色谱-质谱技术鉴定胶原蛋白的物种来源[J].分析测试学报,2018,47(11):12-19.
[8]程显隆.胶类药材质量控制关键技术研究[D].北京:北京中医药大学,2014.
(收稿日期:2023-07-02 编辑:陶希睿)



