汪秀红,陈丽娟,张汉鑫,刘庆南
(1.庆阳市人民医院放疗中心,甘肃 庆阳 745000;2.庆阳市人民医院妇产科,甘肃 庆阳 745000)
宫颈癌是妇产科临床常见的女性恶性肿瘤之一,在女性恶性肿瘤中的发病率仅次于乳腺癌居第二位,中年妇女多发,全球每年确诊患者约46.6万,其发展中国家约占80%,我国约占发展中国家患者的1/3,约占亚洲国家总数的22%[1-2]。宫颈癌不仅给患者及其家庭造成心理和身体创伤,也给我国带来沉重卫生费用负担。目前,药物治疗、放化疗以及手术治疗仍是宫颈癌的主要治疗方法,药物、放化疗常伴有严重毒副作用,而部分患者确诊时已发生其他部位转移,已失去手术机会或手术治疗局限,治疗效果欠佳[3]。重组人血管内皮抑素(恩度)是我国学者在内皮抑素基础上自主研发的新型抑制血管生成抗肿瘤靶向药物,研究证实,该药物不仅对肺癌、胃癌、胸水等疾病有效,而且对卵巢癌、宫颈癌等妇科肿瘤有一定治疗作用[4-5],为此,本研究观察重组人血管内皮抑制素联合同步放化疗治疗中晚期宫颈癌患者临床效果,现报告如下。
1 资料与方法
1.1一般资料:选取2019年4月~2020年5月我院收治的56例中晚期宫颈癌患者作为本次研究患者,按照就诊顺序分为对照组和联合组,对照组31例,联合组25例,两组患者按FIGO分期[6]均为Ⅱb~Ⅳa期。对照组患者年龄38~65岁,平均(52.3±5.6)岁,其中26例为鳞癌,5例为腺癌;菜花型15例,溃疡型16例;Ⅱb期12例,Ⅲa期11例,Ⅲb期5例,Ⅴa期3例;联合组年龄40~66岁,平均(54.1±6.2)岁,其中21例为鳞癌,4例为腺癌;菜花型11例,溃疡型14例;Ⅱb期9例,Ⅲa期11例,Ⅲb期3例,Ⅴa期2例;两组患者的年龄、分型、分期等一般资料的比较,差异均无统计学意义(P>0.05),有可比性。本研究经伦理委员会审查并批准后实施。
诊断标准:参照2019年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)公布了《2019 NCCN宫颈癌临床实践指南》[7]中的诊断标准。纳入标准:①符合上述诊断标准的患者;②所有纳入研究的患者均行宫颈组织活检;③纳入研究的患者同意目前治疗方案并签署治疗知情同意书且具有较好的依从性。排除标准:①对蛋白类生物制品有过敏史者;②合并严重糖尿病、高血压等疾病控制不佳及心﹑肺、肾等功能不全者;③孕妇、哺乳期患者;④精神类疾病等不能配合治疗者。
1.2治疗方法:两组患者均给予必要的吸氧、心电监护、止吐、止泻、补液等对症治疗,对照组采用同步放化疗、放疗:使用我国山东新华医疗器械股份有限公司生产的XHA1400型电子直线加速器,15 MeVX线外放疗+Ir192高剂量率放疗,先给予盆腔中心照射每4周40 Gy/20f,接着同时进行腔内后装与盆腔四野体外照射,每周进行1次腔内照射,每次6 Gy,总计量18~30 Gy,同时盆腔四野照射宫旁4~16 Gy,每次DT2 Gy,腔内照射当日停外照射,体外照射上界在1.4~1.5水平,下界位于闭孔下缘,外缘为骨盆外2.5 cm;化疗:顺铂,按照25 mg/m2给予,每周1次;联合组在对照组治疗基础上再给予重组人血管内皮抑素(规格:每支15 mg/3 ml,批号:S20050088,山东先声麦得津生物制药有限公司),放疗第一条开始使用该药物,每天按照7.5 mg/m2给药一次,连续使用14 d,停止给药7 d,再继续下一周期治疗,共治疗5周。
1.3观察指标:放化疗前后监测所有患者的三大常规、电解质、肝肾功能、凝血功能、心电图等。近期疗效采用2000年欧洲癌症研究与治疗协会发布的实体瘤的疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST),分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和进展(progressive disease,PD),总有效率(RR)=(CR+PR)÷总例数×100%。随访并统计两组患者的无进展生存期(progression-free survival,PFS),无进展生存期规定为从开始治疗至第一次转移或由于任何原因致使患者死亡的时间;采用癌症患者生命质量测定量表体系中的宫颈癌量表(QLICP-CE)[8]对评价两组患者治疗结束后的生活质量,得分越高说明生活质量越差;治疗期间及治疗结束后使用RTOG急性放射损伤分级[9]评估患者不良反应,包扣皮肤、上消化道(恶心、呕吐和腹部不适)、下消化道(大便次数或习惯改变)、心脏、骨髓抑制反应(白细胞、血小板和血红蛋白)等副作用情况。
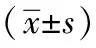
2 结果
2.1两组患者的近期疗效情况:治疗结束后,对照组患者中完全缓解2例,部分缓解7例,总有效率29.03%;联合组患者中完全缓解5例,部分缓解12例,总有效率68.0%,两组总有效率比较,差异有统计学意义(P<0.05)。见表1。
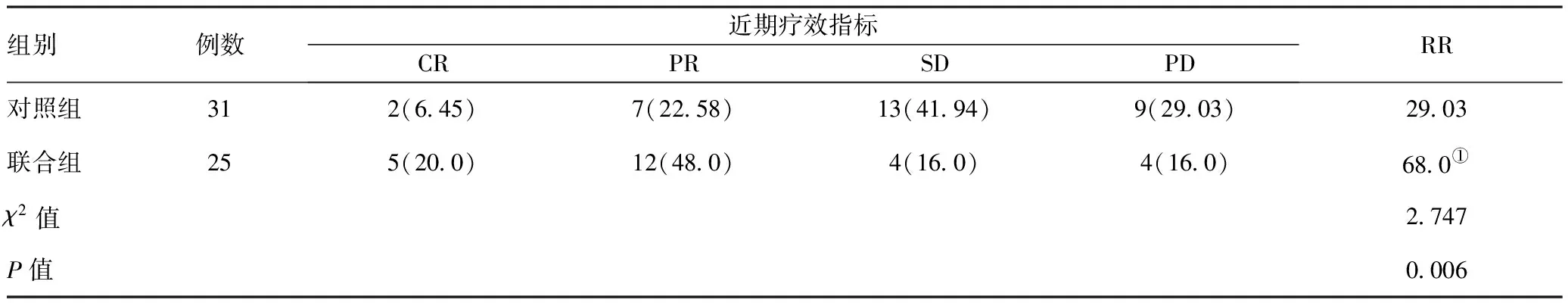
表1 两组患者近期疗效的比较[例(%)]
2.2两组患者的生存分析:联合组患者无进展中位生存时间为5.8个月,对照组为4.1个月,两组患者累积无进展生存率相比较,差异有统计学意义(P<0.05),见图1。
2.3两组患者的生活质量情况:治疗结束后,两组患者生活质量有一定程度改善,两组患者躯体功能、心理功能与同组治疗前比较,差异均有统计学意义(P<0.05);社会功能、共性症状和特异模块治疗前后无明显改善,见表2。
2.4两组患者的不良反应情况:两组患者的不良反应以上消化道(恶心、呕吐和腹部不适)、下消化道(大便次数或习惯改变)、生殖泌尿道(排尿困难、尿急)、骨髓抑制反应(白细胞、血小板和血红蛋白)为主,皮肤、眼、心脏、中枢神经系统反应较少,见表3。

图1 两组患者累积无进展生存率曲线
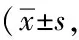
表2 两组患者生活质量的比较分)

表3 两组患者的不良反应情况[例(%)]
3 讨论
宫颈癌在我国的发病率呈现不断上升的趋势,对于中晚期的宫颈癌患者放化疗仍是首选且主要的治疗方法。近年来,放化疗方案、放疗设备与技术一直在不断优化、改进,但部分患者的治疗效果未能获得满意,研究显示,瘤体内在乏氧的状态下促使新生血管生成,肿瘤细胞出现再增殖现象,导致同步放化疗后肿瘤再次复发,放疗敏感性降低,射野范围外的病灶得不到有效治疗等是放疗后肿瘤扩散或复发的根本原因[10-11]。因此,探索新的、有效的治疗方案是临床医生最迫切的需要。
1994年,国外学者首次发现了血管抑制素,随后又从小鼠的内皮细胞中成功分离并提取了内皮抑制素。重组人血管内皮抑制素(recombinant human endostatin ,rh-ES)商品名恩度,其在内皮抑素序列的N端添加9个氨基酸重组而成,作为完全自主知识产权的新型血管内皮抑制剂,2005年国家食品药品监督管理总局正式批准其用于晚期非小细胞肺癌的靶向治疗。随着研究的深入,rh-ES已不仅仅限于治疗肺癌,治疗宫颈癌、结肠癌、恶性腹腔积液等也显示了良好的疗效[12-14]。实验研究已证实其能特异性阻断瘤体组织新生血管的生成,调控血管生长因子的释放、迁移和表达,如基质金属蛋白酶-2,缺氧诱导因子-1,同时能抑制细胞凋亡关键蛋白的表达,如bcl-2蛋白、CyclinD 1蛋白等,从而促使肿瘤细胞的凋亡发挥抑制肿瘤生长的作用[15-16]。此外,rh-ES还可以改善肿瘤对放化疗的敏感性,与化疗药物联合使用达到协同增效的作用[15]。
本研究结果表明,对照组完全缓解者2例、联合组完全缓解者5例,对照组部分缓解者7例,联合组部分缓解者12例,联合组完全缓解和部分缓解的例数均多于对照组,说明rh-ES联合同步放化疗治疗中晚期宫颈癌多数患者可缓解肿瘤进展;对照组总有效率29.03%,联合组总有效率68.0%,治疗的有效率明显优于对照组,说明rh-ES联合同步放化疗治疗中晚期宫颈癌效果较好;对照组疾病稳定者13例,联合组疾病稳定者4例,可见对照组治疗后多数患者处于疾病稳定状态;治疗后,对照组患者无进展中位生存时间为4.1个月,低于联合组的5.8个月,可见,rh-ES联合同步放化疗能改善中晚期宫颈癌患者的中位无进展生存期,近期治疗效果显着。罗菊玉采用rh-ES联合放化疗治疗33例中晚期宫颈癌患者,治疗结束后,联合使用rh-ES的观察组1、2 年生存率分别为84.8%、69.7%,显着高于对照组的78.8%和42.4%[17];另一项研究表明,rh-ES联合同步放化疗治疗1年、2年、3年后患者生存率分别为98%、91%、82%,而对照组患者生存率为94%、81%和70%,随访第3年后对照组患者生存率明显降低[18],说明rh-ES联合同步放化疗治疗中晚期宫颈癌远期疗效也很显着。在生活质量方面,两组患者与同组治疗前比较,躯体功能、心理功能均有一定程度改善;而社会功能、共性症状和特异模块治疗前后无明显变化;不良反应则以恶心、呕吐、大便习惯改变、白细胞降低、血小板减少等为主,危及生命的不良反应未出现,这些不良反应与放化疗后常见的不良反应无明显区别,说明rh-ES联合同步放化疗的治疗方案是相对安全的。
综上可知,rh-ES联合同步放化疗治疗中晚期宫颈癌临床效果明确,能够增加患者无进展中位生存时间,改善患者的生活质量,未出现严重的不良反应。



