徐艳琼,唐 铭,杨承纲
(1.昆明医科大学第三附属医院病理科,云南 昆明 650100;2.云南省第一人民医院,云南 昆明 650034)
甲状腺癌(thyroid cancer)是一种增殖率最高的内分泌系统肿瘤,近年来发病率不断升高[1,2]。由滤泡细胞产生的分化型甲状腺癌(DTC)进一步细分为乳头状甲状腺癌(PTC)、滤泡性甲状腺癌(FTC)和许特尔细胞癌(HTC),其中PTC 是最常见的组织学类型[3]。DNA 甲基化是恶性肿瘤常见的表观遗传修饰,抑癌基因的甲基化可以影响基因的表达水平,从而有利于肿瘤的发生发展。对肿瘤甲基化的检测,有助于制定肿瘤的治疗方案以及预后评估[4]。近年来研究显示,多个基因与甲状腺肿瘤的发生发展相关。Khatami F 等[5]报道CDH1 和SCL5A8 基因与甲状腺癌的发生风险相关;谢小红等[6]发现PCDH8 基因甲基化与乳头状甲状腺的发生发展相关。乙酰辅酶A羧化酶β(ACACB)是乙酰辅酶A 的一种亚型蛋白,能阻碍脂肪酸的β 氧化过程,在脂质代谢中起重要作用的基因[7]。在肿瘤细胞中,95%的脂肪酸是从头合成的,会有脂肪酸的积累,积累到一定程度时会形成乳腺肿瘤组织的膜脂质,影响细胞的信号传导,进而影响机体的生命活动[8]。对ACACB 进行生物信息学分析发现,其在喉部鳞状细胞癌、三阴性乳腺癌、视网膜母细胞瘤、黑色素瘤中低表达。有研究报道对调控PTC 进程的基因进行生物信息学分析,发现与脂肪代谢密切相关的ACACB 表达量显着下调,并被预测为是与PTC 患者预后相关的基因[9]。ACACB 在甲状腺乳头状癌中表达水平降低可能与其甲基化有关[10]。本研究通过对甲状腺乳头状癌患者进行研究,旨在检测ACACB 在甲状腺乳头状癌患者中的甲基化和蛋白表达水平,探讨其作为预后和生存指标的可能性,为临床精准治疗提供新的思路。
1 材料与方法
1.1 材料来源 于2020 年11 月-2021 年3 月在云南省第一人民医院采集10 例乳头状甲状腺癌患者的肿瘤组织和癌旁正常组织样本,所有组织采集后保存在-80 ℃冰箱,以备后续实验使用。
1.2 主要试剂 ACACB 多克隆抗体(货号:PA5-52309;品牌:Thermo Fisher)和TaqManTM 逆转录试剂(货号:N8 080234;品牌:Thermo Fisher)购买自赛默飞世尔科技(中国)有限公司;血液/细胞/组织基因组DNA 提取试剂盒(货号:DP304-02;品牌:TIANGEN)购买自云南表达科技有限公司;蛋白提取试剂盒(货号:ab 270054;品牌:abcam)购买自昆明贝尔吉科技有限公司;引物合成自昆明擎科生物科技有限公司。
1.3 ACACB 基因启动子甲基化检测 按照DNA 提取试剂盒说明书提取癌和癌旁组织基因组总DNA,甲基化特异性PCR(MSP)上游引物MF1:AATTTTGAAGAGAATGTGGTAAT 和下游引物:MR1:TTTAAAAAACAAACCCCCATTAAA;甲基化非特异性 PCR(USP)上游引物:UF1:TGGGTTGGGTATTGTGTAGGTA 和下游引物UR1:AACCCTCAAATCACACCAC。甲基化检测PCR 扩增条件为:95 ℃预变性3 min,后续30 个循环扩增(95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸50 s),循环结束,72 ℃延伸2 min,最后4 ℃保持。
1.4 实时荧光定量PCR(qRT-PCR)提取乳头状患者癌细胞中的RNA,使用TaqManTM 逆转录试剂逆转录成CDNA 后,使用上游引物ACACB F1:AAAGAAACACGGGCTTGAGTTGG 和下游引物 ACACBR1:TGATCTTTAGGCACCTGTGTGCT 进 行q RT-PCR。β-actin 最为内参,其上游引物序列:5'-ACACTGTGCCCATCTACGAGG-3',下游引物序列:5'-AGGGGCCGGACTCGTCATACT-3'。PCR 程序ACACB:95 ℃预变性3 min,30 个循环(94 ℃变性30 s、60 ℃退火25 s、72 ℃延伸30 s)72 ℃延伸5 min。β-actin:95 ℃预变性3 min,28 个扩增循环(94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸30 s),最后72 ℃延伸5 min,随后4 ℃保持。
1.5 蛋白质免疫印迹分析(WB)提取乳头状甲状腺癌和癌旁组织总蛋白质,定量变性后,进行SDSPAGE 电泳,转膜后进行脱脂牛奶孵育2 h,孵育结束后PBST 洗膜3 次,每次5 min,按照1∶1000 稀释ACACB 抗体,过夜孵育后进行显影检测,每组进行3 次重复实验。
1.6 数据分析 使用软件Image J 计算WB 图片每个条带的灰度值,随后将各组灰度值输入软件Graph-Pad Prism 8 进行柱状图绘制。
2 结果
2.1 ACACB 基因mRNA 表达量分析 与癌旁正常组织相比,乳头状甲状腺癌组织中ACACB 基因mRNA 水平均下调,且不同乳头状甲状腺癌样本中ACACB 水平下调水平差异较大,2、5、31 和28 号样本中乳头状甲状腺癌组织和癌旁正常组织的ACACB基因mRNA 表达水平差异最大;25、26 和27 号样本中乳头状甲状腺癌组织和癌旁正常组织的ACACB基因mRNA 表达水平差异最小,见图1。
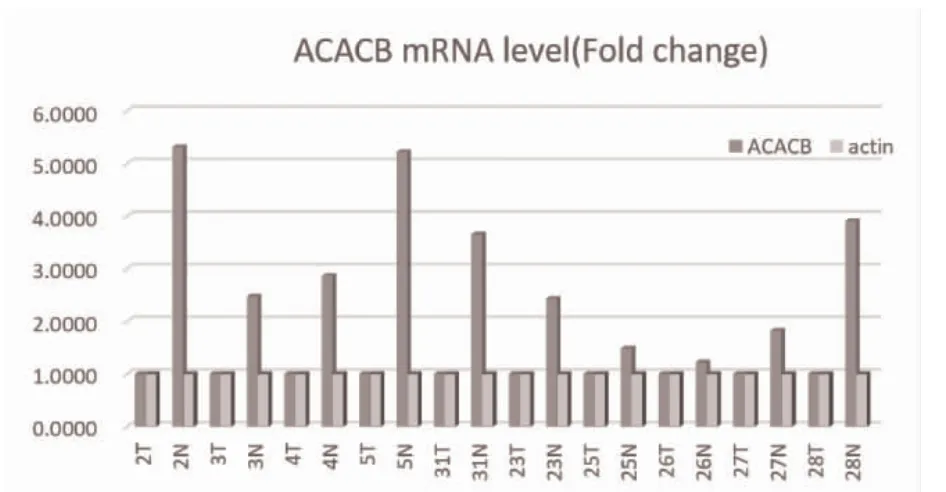
图1 乳头状甲状腺癌组织和癌旁正常组织中ACACB 基因mRNA 表达量比较
2.2 ACACB 蛋白在乳头状甲状腺癌组织中的表达WB 检测显示,8 例患者的ACACB 基因蛋白水平低于癌旁正常组织,仅2 例患者(2 号和3 号样本)ACACB 基因的蛋白表达水平高于癌旁正常组织,ACACB 的表达量与乳头状甲状腺癌的发生密切相关,见图2。
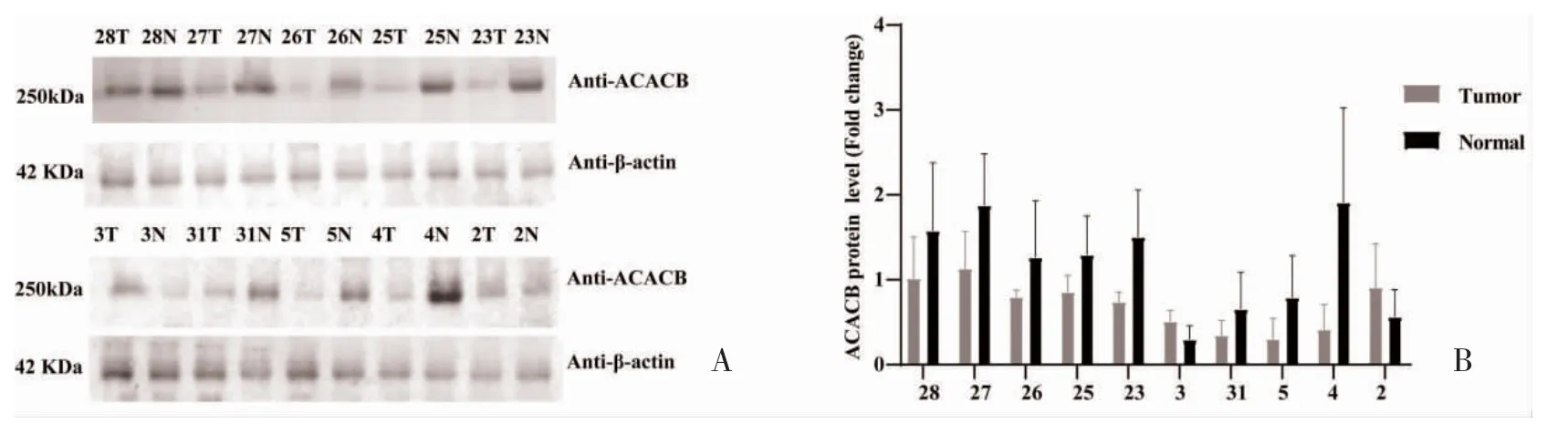
图2 ACACB 蛋白在乳头状甲状腺癌组织中的表达
2.3 ACACB 基因启动子甲基化水平 甲基化特异性PCR 检测显示,在乳头状甲状腺癌组中ACACB 基因发生启动子甲基化的比率为60.00%(6/10),正常样本中ACACB 基因发生启动子甲基化的比率为30.00%(3/10);另外有20.00%(2/10)的甲状腺癌组织和癌旁正常组织同时发生甲基化,见图3。

图3 ACACB 基因启动子甲基化水平
3 讨论
多个报道显示,在乳头状甲状腺癌中,癌组织中ACACB 基因mRNA 表达水平低于对应癌旁正常组织[11,12],但其对于乳头状甲状腺癌的调控机制以及ACACB 基于表达异常的机制尚不清楚。本研究显示,不同来源样本的乳头状甲状腺组织中,癌组织和癌旁正常组织中ACACB 基因的mRNA 表达水平存在不同程度的差异。但WB 结果显示,8 例乳头状甲状腺癌组织的ACACB 基因蛋白水平低于对应癌旁组织,仅2 例乳头状甲状腺癌组织中ACACB 基因蛋白存在高表达;与此同时,60.00%的乳头状甲状腺癌组织存在启动子甲基化。因此,在乳头状甲状腺癌中ACACB 基因启动子甲基化会降低ACACB基因转录。
Li X 等[10]研究认为,乳头状甲状腺癌中ACACB基因mRNA 水平下降可能与其甲基化水平相关。本研究中,存在ACACB 基因启动子甲基化的癌组织中ACACB 基因的mRNA 水平均降低,25、26 和27号样本癌组织存在较低甲基化水平,同时其癌组织中ACACB 基因mRNA 水平与癌旁组织相差最小。
本研究不足之处:本次通过对乳头状甲状腺癌组织中ACACB 基因的表达水平及甲基化水平的研究,发现ACACB 基因表达异常与其甲基化水平相关,但ACACB 基因表达异常与甲状腺癌发生发展的关系仍不明确。与此同时,在少数样本中ACACB基因蛋白水平有一定程度上升,其原因尚不清楚,后续仍需在细胞层面对其调控机制进行探究。
综上所述,乳头状甲状腺癌中存在较高比例的ACACB 基因启动子甲基化,启动子甲基化的发生影响了基因的转录活性,同时其蛋白水平相应下降,但具体机制尚不清楚。



