白冰,郭亚春,石凯行
(1.承德医学院基础医学院,河北 承德 067000;2.承德医学院附属医院皮肤科,河北 承德 067000)
肝脏是人体内物质代谢和起生物转化作用的重要器官,急性肝损伤(acute hepatic injury,AHI)是指由于酒精、病毒、化学药物等一种或多种因素导致的短时间内肝功能急剧损伤,损伤严重还可能导致肝功能衰竭伴有很多并发症,具有很高的致死率[1]。对于治疗肝损伤,目前国内外并没有合适的药物,因此寻找在临床上能够有效治疗肝损伤的药物成为研究热点。中药黄芩性苦寒,具有清热泻火、燥湿解毒之效,可以治疗黄疸[2]。黄芩主要成分为黄芩苷,具有抗炎、抗氧化等药理作用。据文献报道,黄芩苷对非酒精性脂肪性肝炎具有一定的治疗作用[3],还对对乙酰氨基酚诱导的急性肝损伤小鼠具有保护作用[4]。由于水溶性差的特点,致使黄芩苷临床应用受到限制,而水溶性及稳定性极好的黄芩苷镁解决了这一问题[5]。脂多糖(lipopolysaccharide,LPS)联合D-氨基半乳糖(D-Galactosamine,D-GalN)制备急性肝损伤模型是国内外公认的经典方法[6],其诱导的急性肝损伤病理变化与临床乙肝病理变化类似[7],主要是由炎症介导的免疫性肝损伤。当中毒、感染等内外因素刺激下,免疫调节作用失控,二者比例失衡,活化的免疫细胞分泌大量炎症因子,就可能会引起免疫功能紊乱,进而造成肝细胞损伤[8]。有报道D-GalN 致急性肝衰竭大鼠模型中存在Th 细胞分泌的炎症因子失衡[9],在肝损伤的过程中IL-6、IFN-γ、TNF-α 等Th1 类细胞因子发挥主要作用[8]。因此,本研究拟通过检测炎症因子水平来探究黄芩苷镁尾静脉给药对LPS/D-GalN 诱导急性肝损伤大鼠的影响。
1 材料与方法
1.1 材料与试剂 54 只SPF 级雄性SD 大鼠购于维通利华,许可证号SCXK(京)2016-0006,5 周龄,重(170±10)g,本研究已通过我校伦理委员会审批,批准文号:CDMULAC-20181219-006。大鼠饲养于SPF级环境。试剂及仪器:LPS、D-GalN(Sigma-Aldrich),异甘草酸镁(正大天晴药业),黄芩苷镁(纯度为85%,由承德医学院刘翠哲教授课题组提供),红帽负压液体采集管(不抗凝)国产(Bebolabs),大鼠IL-1β、IL-6、IFN-γ、TNF-α 试剂盒(联科生物),SIM-F124 制冰机(日本SANYO 公司),PrimeScript RT Master Mix(Perfect Real Time)(TaKaRa),DEPC处理水(DNase、RNase free)(Beyotime),普通RIPA(组织/细胞)裂解液(附PMSF 1.5 ml)(Solarbio),引物(TaKaRa),PCR 仪(BIO-RAD)。
1.2 方法
1.2.1 动物分组及处理 大鼠适应性饲养1 周,按照随机数字表法分为模型组、正常组、黄芩苷镁(BAMg)高、中、低剂量组(100、50、25 mg/kg),异甘草酸镁组(MgIG)(18 mg/kg),每组9 只。给药组尾静脉注射相应浓度的药物连续7 d,1 次/d,模型及正常组以相同方法给予等量生理盐水。根据前期实验结果,确定造模条件为20 μg/kg LPS 联合400 mg/kg D-GalN,于12 h 后取材[8]。
1.2.2 ELISA 法检测血清炎症因子 取材,大鼠血液离心后得到血清置于冰上备用;在标准品孔中,分别加入呈比例稀释的标准品100 μl 作为标准曲线,加100 μl 标准品稀释液于空白孔内作为空白对照,在样本孔中,加入样本溶液20 μl、1×检测缓冲液80 μl;然后所有孔加入稀释好的检测抗体溶液50 μl;37 ℃孵育1.5 h;冲洗6 次;加辣根酶标记的链霉亲和素100 μl/孔;37 ℃孵育30 min;冲洗6 次;避光加入显色底物100 μl/孔,避光室温孵育30 min;加终止液100 μl/孔;30 min 内,上机检测450 nm 条件下的OD 值;处理数据,检测血清样本中IL-6、IL-1β、TNF-α、IFN-γ 含量。
1.3 统计学方法 应用SPSS 24.0 统计软件分析数据,计量资料采用(±s)表示,使用单因素方差分析LSD 或Games-Howell 进行检验;计数资料采用[n(%)]表示,行χ2检验;设置检验水准α=0.05,P<0.05 表示差异有统计学意义。
2 结果
模型组血清IL-6、IL-1β、TNF-α、IFN-γ 水平高于正常组,差异有统计学意义(P<0.05);黄芩苷镁高、中剂量组、异甘草酸镁组血清IL-6、IL-1β、IFN-γ水平低于模型组,差异有统计学意义(P<0.05);黄芩苷镁低剂量组血清IFN-γ 水平低于模型组,差异有统计学意义(P<0.05);黄芩苷镁低剂量组血清IL-6、IL-1β、TNF-α 水平与模型组比较,差异无统计学意义(P>0.05);黄芩苷镁中、低剂量组血清IL-6、IL-1β、IFN-γ 水平高于异甘草酸镁组,差异有统计学意义(P<0.05);黄芩苷镁高剂量组血清IL-6、IL-1β、IFN-γ 水平与异甘草酸镁组比较,差异无统计学意义(P>0.05);黄芩苷镁高、中、低剂量组血清TNF-α水平与异甘草酸镁组比较,差异无统计学意义(P>0.05),见表1。
表1 各组血清IL-6、IL-1β、TNF-α、IFN-γ 水平比较(±s,pg/ml)
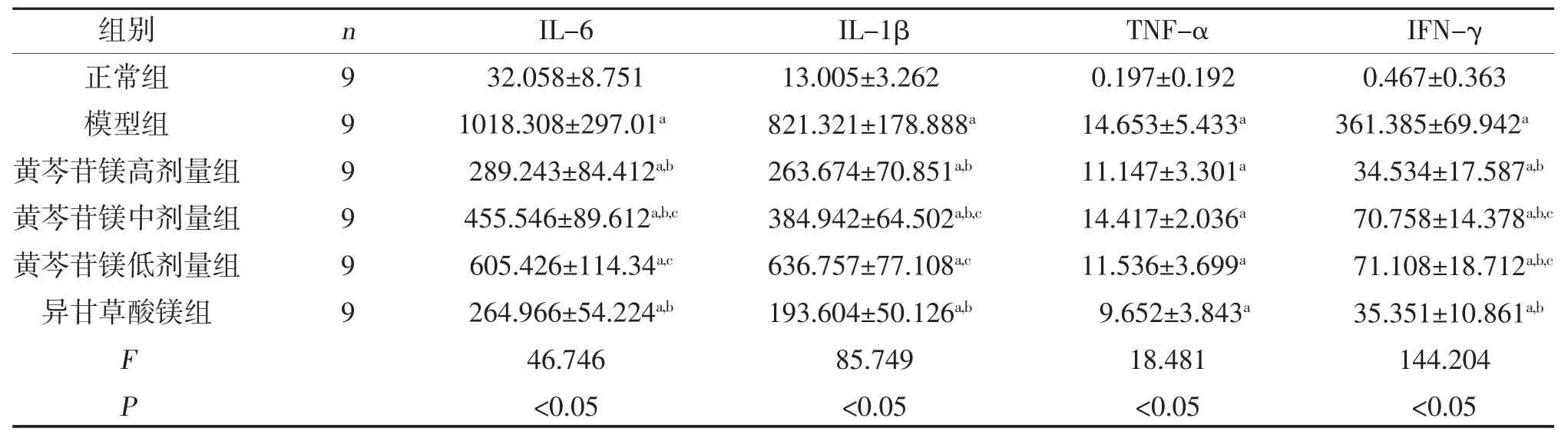
表1 各组血清IL-6、IL-1β、TNF-α、IFN-γ 水平比较(±s,pg/ml)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与异甘草酸镁组比较,cP<0.05
3 讨论
黄芩苷镁是黄芩苷与镁离子耦合形成的水溶性化合物,它是黄芩苷在植物中的主要存在形式[10]。有文献报告黄芩苷在肾损伤、心肌损伤、脊髓损伤、肺损伤等方面均有一定的治疗作用[11-14]。课题组前期研究发现BA-Mg 可改善CCl4诱发的大鼠急性肝损伤[15],其可能通过Nrf2/ARE 信号通路抑制氧化应激反应发挥保护作用[16]。有研究报道了黄芩苷镁对急性肺损伤小鼠就有一定保护作用[17]。因此本研究通过BA-Mg 预处理大鼠1 周后,进行LPS/D-GalN 诱导急性肝损伤[7],研究BA-Mg 对LPS/D-GalN 诱导急性肝损伤是否有保护作用。
免疫应答是机体免疫系统识别并清除“非己”物质的整个过程,需要T、B 细胞及多种固有免疫细胞相互协调、共同作用完成[18]。T 细胞来源于骨髓造血干细胞,在胸腺发育成熟后定居在外周淋巴器官中的胸腺依赖区,当受到某些特定的抗原刺激后就会被激活、增殖,并分化为发挥效应的T 细胞和具有记忆作用的T 细胞,通过淋巴细胞再循环周游全身发挥免疫调节和细胞免疫功能[19]。依据T 细胞在免疫应答中的功能,将其分为辅助性T 细胞(Th 细胞)、细胞毒性T 细胞(Tc 细胞)和调节性T 细胞(Treg 细胞)。Th 细胞主要分为Th1、Th2 细胞,其中Th1 细胞活化分泌IL-1、IL-2、IFN-γ、TNF-α 等因子,Th2 细胞活化分泌IL-4、IL-6、IL-10 等因子。正常生理状态下,Th1/Th2 细胞处于动态平衡,调节机体正常免疫应答,在肝损伤状态下导致二者比例失衡,促炎因子大量分泌,进而可能会引起免疫功能紊乱[8]。由此,实验研究检测了大鼠血清中促炎因子IL-6、IL-1β、TNF-α、IFN-γ 含量。
本研究发现,AHI 大鼠血清IL-6、IL-1β、TNF-α、IFN-γ 水平高于正常组(P<0.05),与文献报道相一致[20,21],提示LPS/D-GalN 诱导的AHI 过程中,可能使Th1 细胞过度活化,大量分泌IL-6、IL-1β、TNF-α、IFN-γ 等因子,进而导致炎症反应。黄芩苷镁高、中、低剂量组可以降低LPS 联合D-GalN 致急性肝损伤大鼠血清中IL-6、IL-1β、IFN-γ的水平,其中以黄芩苷镁高、中剂量组较为突出(P<0.05)。黄芩苷镁高、中、低剂量组血清中TNF-α 水平有下降的趋势,与模型组比较,差异无统计学意义(P>0.05),提示TNF-α 可能并不是BA-Mg 影响的主要因子。因此,BA-Mg 可能通过抑制Th1 细胞的过度活化,进而抑制分泌促炎因子,发挥抗炎作用。黄芩苷镁高剂量组血清炎症因子IL-6、IL-1β、IFN-γ 水平与异甘草酸镁组比较,差异无统计学意义(P>0.05),黄芩苷镁中、低剂量组血清炎症因子IL-6、IL-1β、IFN-γ水平较异甘草酸镁组高(P<0.05),提示高浓度BA-Mg 可能与MgIG的抗炎效果一致。
综上所述,LPS 联合D-氨基半乳糖可造成急性肝损伤,释放大量炎症因子。基于前期AHI 模型建立的条件,黄芩苷镁可以通过抑制炎症因子产生来发挥保肝作用,但黄芩苷镁是否通过影响Th1、Th2细胞增殖来抑制炎症因子产生,有待进一步研究。



