常钰朋 耿茜茜 火睿 孙侃 常向云 李军 朱凌云 董玉洁 罗丽娜

【摘要】 背景 醛固酮瘤(APA)是原发性醛固酮增多症的常见类型。对于单侧肾上腺腺瘤者,虽然共识推荐血浆醛固酮与肾素比值(ARR)作为APA的筛查指标,由于缺乏统一的检测方法和诊断流程,ARR切点值范围变化大。因此临床需要一种可靠、快捷的预测模型协助鉴别APA。目的 探讨肾小球滤过率(GFR)与APA的相关性,基于此构建APA的列线图预测模型并验证。方法 收集2012—2022年石河子大学第一附属医院经肾上腺内分泌激素评估后行手术治疗病理回报为单侧肾上腺肿物患者493例,根据APA和肾上腺无功能腺瘤的诊断标准,最终纳入APA组155例,无功能腺瘤合并原发性高血压组113例。收集患者的病史资料、生化资料等。按照GFR四分位数水平将患者分组,分析GFR与APA的相关性。通过多因素Logistic回归分析筛选APA的危险因素并构建列线图预测模型。采用受试者工作特征(ROC)曲线分析预测模型的区分度,一致性指数(C-index)评价模型的预测精准度,Hosmer-Lemeshow检测模型的拟合度,运用决策曲线与临床获益曲线评价模型的诊断效能。结果 按照GFR四分位数进行分组(Q1~Q4组),Q1组:≥107.4 mL·min-1·(1.73 m2)-1(n=67),Q2组:99.7~107.3 mL·min-1·(1.73 m2)-1(n=67),Q3组:88.6~99.6 mL·min-1·(1.73 m2)-1(n=67),Q4组:≤88.5 mL·min-1·(1.73 m2)-1(n=67),各组APA发生率分别为47.8%(32/67)、53.7%(36/67)、58.2%(39/67)、71.6%(48/67)。Logistic回归趋势性检验提示随着GFR水平降低,APA患病风险呈趋势性升高(P<0.05)。多因素Logistic回归分析结果显示:收缩压>160 mmHg(OR=5.209,95%CI=2.531~10.720)、高血压病程≥59个月(OR=4.326,95%CI=1.950~9.595)、血钾<3.25 mmol/L(OR=4.714,95%CI=2.046~10.860)、GFR[Q4组:≤88.5 mL·min-1·(1.73 m2)-1](OR=4.106,95%CI=1.492~11.300)、基础血浆醛固酮>13.42 ng/dL(OR=8.756,95%CI=4.320~17.749)为APA发生的独立危险因素(P<0.050)。根据多因素筛选的变量构建列线图预测模型,该模型ROC曲线下面积为0.898(95%CI=0.859~0.936),以此建立的列线图预测模型C-index为0.898,模型有较好的预测精度。Hosmer-Lemeshow检验显示该模型有较好的拟合度(χ2=14.059,P=0.080)。预测概率阈值在0.10~0.90时该模型具有显着的预测效能。结论 随着GFR水平降低,APA患病风险呈趋势性升高。基于收缩压、高血压病程、血钾、GFR四分位分组、基础血浆醛固酮5种因素构建的APA预测模型具有较好的预测性、一致性和临床实用性,可帮助识别APA,有助于临床决策。
【关键词】 原发性醛固酮增多症;醛固酮瘤;肾小球滤过率;列线图;预测模型
【中图分类号】 R 586.24 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0436
Construction and Verification the Nomogram Prediction Model for Primary Aldosteronism Based on Glomerular Filtration Rate
CHANG Yupeng1,GENG Xixi1,HUO Rui1*,SUN Kan1,CHANG Xiangyun1,LI Jun1,ZHU Lingyun1,DONG Yujie1,LUO Lina2
1.Department of Endocrinology,First Affiliated Hospital,Shihezi University,Shihezi 832000,China
2.The School of Medicine,Shihezi University,Shihezi 832000,China
*Corresponding author:HUO Rui,Associate professor;E-mail:huodoctor@163.com
【Abstract】 Background Aldosterone-producing adenoma(APA) is a common type of primary aldosteronism. For those with unilateral adrenocortical adenoma,although expert consensus recommends plasma aldosterone-to-renin ratio(ARR) as a screening indicator for APA,the range of ARR cut-off values varies widely due to the lack of unified detection method and diagnostic process. Therefore,there is a clinical need for a reliable and rapid predictive model to assist in identifying APA. Objective To explore the correlation between glomerular filtration rate(GFR) and APA,construct and validate the nomogram prediction model of APA. Methods A total of 493 patients with with pathologic results of unilateral adrenal mass who underwent surgical treatment after evaluation of adrenal endocrine hormones in the first affiliated hospital of Shihezi University from 2012 to 2022 were collected,155 patients were ultimately included in the APA group and 113 patients in nonfunctioning adrenal adenoma combined with essential hypertension group according to the diagnostic criteria of APA and nonfunctioning adrenal adenoma. The patients' clinical data and biochemical data were collected. The patients were grouped according to GFR quartiles,and the correlation between GFR and APA was analyzed. The risk factors for APA were screened by multivariate Logistic regression analysis and a nomogram prediction model was constructed. Receiver operating characteristic(ROC) curve was used to analyze the discrimination of the prediction model,a consistency index(C-index) was used to evaluate the predictive accuracy of the model,Hosmer Lemeshow test was used to verify the fit of model,and the diagnostic efficacy of the model was evaluated using decision curve and clinical benefit curve. Results The patients were grouped according to GFR quartiles (Q1 to Q4 groups),Q1 group:≥107.4 mL·min-1·(1.73 m2)-1(n=67),Q2 group:99.7-107.3 mL·min-1·(1.73 m2)-1(n=67),Q3 group:88.6-99.6 mL·min-1·(1.73 m2)-1(n=67) and Q4 group:≤88.5 mL·min-1·(1.73 m2)-1(n=67),and the proportion of APA in each group was 47.8%(32/67),53.7%(36/67),58.2%(39/67) and 71.6%(48/67). Logistic regression trend test suggested that the risk of APA tended to increase as GFR levels decreased(P<0.05). Multivariate Logistic regression analysis showed that systolic blood pressure >160 mmHg(OR=5.209,95%CI=2.531-10.720),hypertension duration≥59 months(OR=4.326,95%CI=1.950-9.595),blood potassium<3.25mmol/L(OR=4.714,95%CI=2.046-10.860),GFR[Q4 gourp:≤88.5 mL·min-1·(1.73 m2)-1](OR=4.106,95%CI=1.492-11.300),basal aldosterone>13.42 ng/dL(OR=8.756,95%CI=4.320-17.749) were independent risk factors for the occurrence of APA(P<0.050). The Nomogram prediction model was constructed based on the above variables of multivariate regression with an AUC of 0.898(95%CI=0.859-0.936) and a C-index of 0.898,indicating a good prediction accuracy. The Hosmer-Lemeshow test showed that the model had a good fit(χ2=14.059,P=0.080). The model had a significant predictive efficacy at prediction probability thresholds of 0.10 to 0.90. Conclusion The risk of APA prevalence tends to increase with decreasing GFR levels. The APA prediction model constructed based on five factors,including systolic blood pressure,hypertension course,blood potassium,GFR quartile grouping and basal aldosterone,has good predictability,consistency and clinical practicality,which can help identify APA and contribute to clinical decision making.
【Key words】 Primary hyperaldosteronism;Aldosterone-producing adenoma;Glomerular filtration rate;Nomogram;Predictive model
原发性醛固酮增多症(primary aldosteronism,PA)是继发性高血压最常见的病因[1],而醛固酮瘤(aldosterone-producing adenoma,APA)是PA常见的类型,约占PA的35%[2]。对于单侧肾上腺腺瘤患者,《原发性醛固酮增多症诊断治疗的专家共识(2020版)》推荐血浆醛固酮与肾素比值(aldosterone to rennin ratio,ARR)作为APA的筛查指标[2],由于缺乏统一的检测方法和诊断流程,导致ARR最佳截断值变化范围非常大,成为临床实际应用中较棘手的问题。该共识也指出单纯影像学检查不能区分肾上腺无功能腺瘤和APA,肾上腺静脉采血(adrenal venous sampling,AVS)是明确PA最可靠、最准确的方法[2-3],但AVS为有创检查且价格昂贵,耗时、费力且技术要求高,目前国内常规开展AVS的医院或机构为数不多[4]。因此需要一种简便、快捷的临床应用模型协助区分APA与无功能腺瘤。临床中部分APA患者存在肾小球滤过率(glomerular filtration rate,GFR)降低的情况,APA患者的肾脏损害程度比原发性高血压更严重[2]。本研究通过对APA与GFR的相关性进行探索,构建基于GFR和临床资料的APA列线图预测模型,进而帮助临床诊治。
1 对象与方法
1.1 研究对象
收集2012—2022年石河子大学第一附属医院经肾上腺内分泌激素评估后行手术治疗病理回报为单侧肾上腺肿物患者493例,排除库欣综合征65例、嗜铬细胞瘤58例、肾上腺转移癌16例、肾上腺皮质癌2例、肾上腺囊肿33例、髓性脂肪瘤8例、节细胞神经瘤6例、肾上腺海绵状血管瘤8例、淋巴瘤1例、资料不全者21例,最终纳入APA 155例,无功能腺瘤120例,其中无功能腺瘤合并原发性高血压者113例。APA的诊断标准参照《原发性醛固酮增多症诊断治疗的专家共识(2020版)》[2]:(1)筛查试验阳性判定:醛固酮单位为ng/dL,肾素浓度单位为mU/L时ARR截断值为3.7,肾素活性单位为ng·mL-1·h-1时ARR截断值为30;(2)确诊试验判定:生理盐水试验后血醛固酮>10 ng/dL或卡托普利试验后血醛固酮浓度下降<30%;(3)CT检查显示单侧肾上腺结节且对侧肾上腺无异常;(4)术后病理诊断为肾上腺皮质腺瘤,术后血钾、血压改善,使用降压药物的种类或剂量减少。肾上腺无功能腺瘤诊断标准:经术后病理回报为肾上腺皮质腺瘤,同时排除其他功能性腺瘤。本研究经石河子大学第一附属医院伦理委员会审批(审批号:KJX-2021-055-01)。所有患者已签署知情同意书。
1.2 研究方法
收集患者性别、年龄、BMI、收缩压(SBP)、舒张压(DBP)、糖尿病等病史资料;电解质、CO2结合力(CO2CP)、血清葡萄糖(GLU)、GFR等生化指标,计算血清钙与血清磷乘积(Ca-P产物)[5];基础血浆醛固酮和基础血浆肾素浓度;平扫及动脉期CT值、肿瘤直径(CT下最大横断面上的最大直径)等。
1.3 统计学分析
运用SPSS 26.0、R语言(4.22版)及R studio统计软件对数据进行分析。符合正态分布的计量资料以(x-±s)表示,两组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用秩和检验;计数资料的分析采用χ2检验。按照GFR四分位数水平将患者分组,并采用Logistic回归分析探讨GFR与APA的相关性。将单变量分析中有统计学意义的临床资料以最优分箱和最佳截断值的方式转换分类变量,经单因素Logistic回归分析后,用向后逐步回归法行多因素Logistic回归分析筛选APA发生的危险因素并绘制列线图预测模型。利用受试者工作特征(ROC)曲线分析预测模型的区分度,一致性指数(C-index)评价模型的预测精度,Hosmer-Lemeshow和校准曲线分别验证模型的拟合度及校准度。采用Bootstrap进行内部数据抽样验证,最后以决策曲线和临床影响曲线分析评估模型临床净收益。以P<0.05为差异有统计学意义。
2 结果
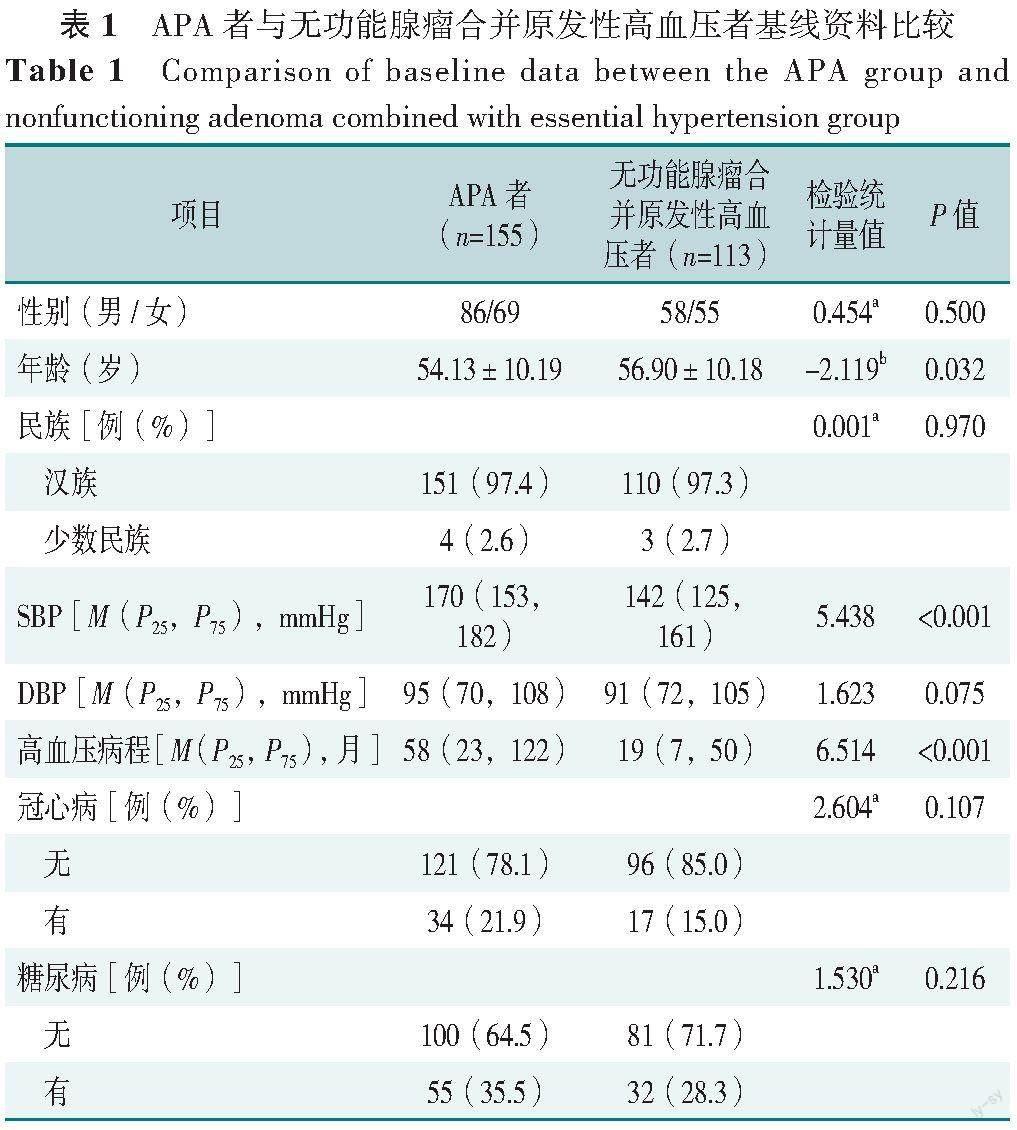
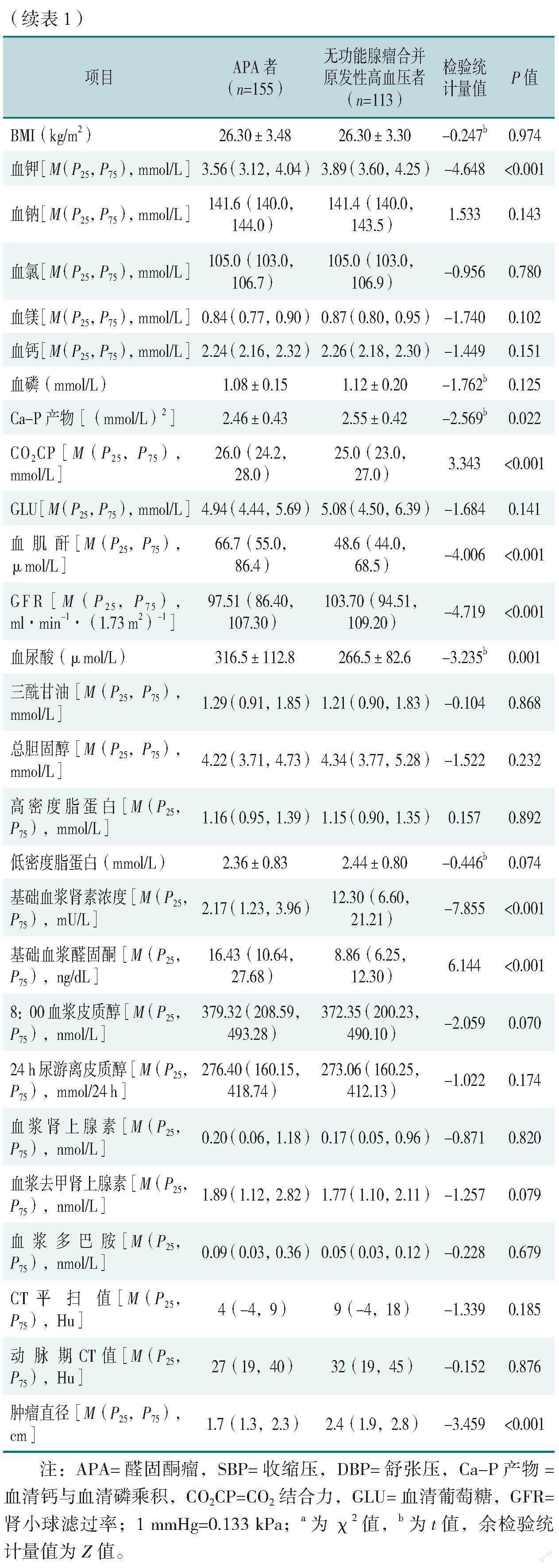
2.1 APA者与无功能腺瘤合并原发性高血压者基线资料比较
APA者与无功能腺瘤合并原发性高血压者性别、民族、DBP、冠心病、糖尿病、BMI、血钠、血氯、血镁、血钙、血磷、GLU、三酰甘油、总胆固醇、高密度脂蛋白、低密度脂蛋白、8:00血浆皮质醇、24 h尿游离皮质醇、血浆肾上腺素、血浆去甲肾上腺素、血浆多巴胺、CT平扫值、动脉期CT值比较,差异均无统计学意义(P>0.05),见表1。
APA者SBP、高血压病程、CO2CP、血肌酐、血尿酸、基础血浆醛固酮水平高于无功能腺瘤合并原发性高血压者,年龄、GFR、血钾、Ca-P产物、基础血浆肾素浓度、肿瘤直径低于无功能腺瘤合并原发性高血压者,差异均有统计学意义(P<0.05),见表1。
2.2 GFR与APA的相关分析
根据GFR的四分位数将患者分为4组,Q1组:≥107.4 mL·min-1·(1.73 m2)-1(n=67),Q2组:99.7~107.3 mL·min-1·(1.73 m2)-1(n=67),Q3组:88.6~99.6 mL·min-1·(1.73 m2)-1(n=67),Q4组:≤88.5 mL·min-1·(1.73 m2)-1(n=67),各组APA发生率分别为47.8%(32/67)、53.7%(36/67)、58.2%(39/67)、71.6%(48/67)。以是否发生APA为因变量(赋值:是=1,否=0),以GFR水平四分位分组为自变量行Logistic回归分析,Logistic回归趋势性检验提示随着GFR水平降低,APA患病风险呈趋势性升高(P=0.007);在较正年龄(赋值:实测值)、SBP(赋值:实测值)、高血压病程(赋值:实测值)、血钾(赋值:实测值)、Ca-P产物(赋值:实测值)、CO2CP(赋值:实测值)、血肌酐(赋值:实测值)、血尿酸(赋值:实测值)、基础血浆肾素浓度(赋值:实测值)、基础血浆醛固酮(赋值:实测值)和肿瘤直径(赋值:实测值)后,该趋势依旧存在(P=0.017),见表2。
2.3 APA相关预测因素的Logistic回归分析
将单因素分析中有统计学意义的项目进行最优分箱处理,无法最优分箱的项目以最佳截断值进行分组处理。结果示:血钾以3.25 mmol/L分箱,模型熵为0.930;CO2CP以29 mmol/L分箱,模型熵为0.931;模型熵提示两者分箱化变量预测准确度较高。年龄、SBP、高血压病程、Ca-P产物、血肌酐、血尿酸、血浆醛固酮、血浆肾素浓度、肿瘤直径的最佳截断值分别为55岁、160 mmHg(1 mmHg=0.133 kPa)、59个月、2.63(mmol/L)2、
60.2 μmol/L、282.5 μmol/L、13.42 ng/dL、2.07 mU/L、2.01 cm。以是否发生APA为因变量(赋值:是=1,否=0),以单因素分析中有统计学意义的项目为自变量行多因素Logistic回归分析,结果显示:SBP>160 mmHg、高血压病程≥59个月、血钾<3.25 mmol/L、GFR Q4组、基础血浆醛固酮>13.42 ng/dL是APA发生的独立危险因素(P<0.05),见表3。
2.4 列线图模型的构建
基于多因素Logistic回归筛选的5项因素,构建列线图模型(图1),通过将相应预测因子的得分相加得出总分,总分对应的概率即预测APA发生风险的概率。
2.5 列线图模型的验证
APA的列线图预测模型ROC曲线结果显示:AUC为0.898(95%CI=0.859~0.936),最大约登指数为0.694,预测APA的灵敏度为88.5%,特异度为91.7%。模型C-index为0.898,有较好的预测精度。Hosmer-Lemeshow拟合度检验结果显示χ2=14.059,P=0.080,该模型有较好的拟合度。使用Bootstrap 1 000次自主抽样进行内部验证,结果示模型平均绝对误差=0.015,校准曲线与理想曲线吻合度高,预测模型准确性高(图2)。
2.6 列线图模型的临床应用
决策曲线显示该模型预测APA较单一因素预测APA阈值范围广,提供的标准化净获益率较单一预测因素高,当模型预测APA发生风险概率阈值在0.10~0.90时,可提供积极标准化净收益(图3)。临床影响曲线显示当阈概率>0.77时,该预测模型判定为APA高风险人群与实际发生APA人群高度匹配,临床有效率高(图4)。
3 讨论
既往认为PA是少见病,其发生率在高血压人群中<1%,现研究表明PA是继发性高血压最常见的原因,高血压中PA的患病率达10%~20%[6],国内有研究提出中国高血压人群中PA的预测模型[7-9],但没有进一步对PA常见的类型APA构建预测模型。本研究在探讨GFR与APA相关性的同时,构建了具有一定实用性的APA列线图预测模型,且获得途径简易,在门诊即可完成。
本研究中APA者高血压3级占比最高[75例(48.3%)],2级占比次之[50例(32.3%)],1级占比最低[30例(19.4%)],与国内李南方等[10]报道的PA高血压占比研究结果相近。与无功能腺瘤合并原发性高血压者相比,APA者SBP较高,考虑与醛固酮通过参与水、盐平衡的调节,从而引起血压升高有关[11];有研究表明,高血压病程越长,导致动脉粥样硬化和肾脏等靶器官损害的可能性越大,不利于患者术后的转归[12],本研究中APA者高血压病程明显长于无功能腺瘤合并原发性高血压者,GFR水平也较无功能腺瘤者低,进一步证实了在高血压人群中筛查PA的重要性。
KAWASHIMA等[13]研究表明醛固酮与PA患者的肾功能损害密切相关。本研究显示,APA者基础血浆醛固酮明显偏高,基础血浆肾素浓度明显偏低,且APA患病风险随着GFR水平降低呈趋势性升高,与上述报道相似。APA在GFR Q1组、Q2组和Q3组中占比接近,考虑为早期钠重吸收增加和肾灌注压增加,使得肾小球处于高滤过状态,肾脏出现功能性适应,此阶段结构性肾损伤并不明显[14]。过量的醛固酮可促进肾外髓质钾通道活性,从而增加钠氯协同转运蛋白,导致钾离子的外排增加[15]。本研究中APA者血钾水平明显低于无功能腺瘤合并原发性高血压者,且低钾血症在APA者中占比为47.1%,无功能腺瘤合并原发性高血压者中为15.0%,与上述报道相符。此外,APA组CO2CP水平明显高于无功能腺瘤组,考虑主要与碱血症相关,低钾血症时,细胞内钾离子丢失,细胞外液的钠、氢离子进入细胞内,细胞外液氢离子减少,pH上升,加之肾小管对碳酸氢根重吸收增加,从而导致碱血症[16]。
有关APA风险模型,各种评分系统的发展及应用为临床决策的制订提供了依据。2012年国外学者K?PERS等[17]提出了联合典型腺瘤影像学表现、血钾<3.5 mmol/L、估算肾小球滤过率的评分,建议≥5分的患者直接行手术治疗;2017年国内专家指出K?PERS评分的不适应性并做出修改,提出了联合尿醛固酮、低血钾与肾上腺瘤体大小的预测模型[18]。本研究基于最优分箱和最佳截断值法最终筛选出SBP、高血压病程、血钾、GFR和基础血浆醛固酮5项指标构建了APA的列线图预测模型,该方法避免了广义线性模型的表达受限,模型会更稳定,降低了模型过拟合的风险。
综上所述,基于上述研究构建的APA预测模型可帮助区分影像学CT检查肾上腺无功能腺瘤与APA鉴别困难的问题,且具有良好的预测效果和临床实用性,对临床医师评判患者病情、合理制订临床治疗方案和医疗资源的合理配置具有重要的临床实践意义。本研究存在一定的局限性:首先,本研究时间跨度长,可能包括一些未知的混杂因素影响;其次,本研究样预测模型适用范围有限,关注重点是APA与肾上腺无功能腺瘤合并原发性高血压的鉴别,后续会进一步增加样本量、完善适用范围更广、更具实用性的模型;最后,本研究为单中心、病例对照研究,且仅采用内部验证方法验证。后续还需进一步开展多中心、前瞻性临床研究,并采用外部验证的方法进一步优化模型,为临床诊疗决策提供更多帮助。
作者贡献:常钰朋、耿茜茜进行论文撰写、数据整理、统计学分析;火睿进行研究指导、论文修改、经费支持;孙侃、常向云、李军、朱凌云做出支持性贡献;董玉洁、罗丽娜采集数据;所有作者确认了论文的最终稿。
本文无利益冲突。
参考文献
MONTICONE S,BURRELLO J,TIZZANI D,et al. Prevalence and clinical manifestations of primary aldosteronism encountered in primary care practice[J]. J Am Coll Cardiol,2017,69(14):1811-1820. DOI:10.1016/j.jacc.2017.01.052.
中华医学会内分泌学分会. 原发性醛固酮增多症诊断治疗的专家共识(2020版)[J]. 中华内分泌代谢杂志,2020,36(9):727-736. DOI:10.3760/cma.j.cn311282-20200615-00444.
LUPI A,BATTISTEL M,BARBIERO G,et al. Simultaneous bilateral adrenal vein sampling for primary aldosteronism:useful tips to make it simple and safe[J]. Eur Radiol,2019,29(11):6330-6335. DOI:10.1007/s00330-019-06209-5.
杜志鹏,杨淑敏,李启富. 原发性醛固酮增多症的无创分型:拨云睹日[J]. 中华内科杂志,2023,62(3):237-241.
王梦卉,张玮玮,彩丽,等. 血清钙磷乘积与原发性醛固酮增多症的相关性[J]. 临床心血管病杂志,2022,38(1):68-72. DOI:10.13201/j.issn.1001-1439.2022.01.014.
蒋怡然,王卫庆. 原发性醛固酮增多症在中国的诊治现状及研究进展[J]. 中华内分泌代谢杂志,2018,34(9):717-720. DOI:10.3760/cma.j.issn.1000-6699.2018.09.001.
LIN W B,GAN W J,FENG P N,et al. Online prediction model for primary aldosteronism in patients with hypertension in Chinese population:a two-center retrospective study[J]. Front Endocrinol,2022,13:882148. DOI:10.3389/fendo.2022.882148.
CHEN P T,CHANG D W,LIU K L,et al. Radiomics utilization to differentiate nonfunctional adenoma in essential hypertension and functional adenoma in primary aldosteronism[J]. Sci Rep,2022,12(1):8892. DOI:10.1038/s41598-022-12835-9.
ZHANG M,BIAN G,TIAN J Y,et al. Assessment of biochemical outcomes in patients with primary aldosteronism after adrenalectomy based on CT scan diagnosis of unilateral adenoma without adrenal vein sampling[J]. Front Oncol,2022,12:944035. DOI:10.3389/fonc.2022.944035.
李南方,李红建,王红梅,等. 330例原发性醛固酮增多症患者的临床分析[J]. 中华内分泌代谢杂志,2011,27(9):752-754. DOI:10.3760/cma.j.issn.1000-6699.2011.09.013.
MARTINEZ M F,MARTINI A G,SEQUEIRA-LOPEZ M L S,et al. Ctcf is required for renin expression and maintenance of the structural integrity of the kidney[J]. Clin Sci,2020,134(13):1763-1774. DOI:10.1042/CS20200184.
何小群,杨珊,吴珏莅,等. 预测原发性醛固酮增多症术后血压的转归:Fisher判别模型[J]. 中华医学杂志,2016,96(42):3379-3383.
KAWASHIMA A,SONE M,INAGAKI N,et al. Renal impairment is closely associated with plasma aldosterone concentration in patients with primary aldosteronism[J]. Eur J Endocrinol,2019,181(3):339-350. DOI:10.1530/EJE-19-0047.
KOBAYASHI H,ABE M,NAKAMURA Y,et al. Association between acute fall in estimated glomerular filtration rate after treatment for primary aldosteronism and long-term decline in renal function[J]. Hypertension,2019,74(3):630-638. DOI:10.1161/HYPERTENSIONAHA.119.13131.
LIN X,ULLAH M H E,WU X,et al. Cerebro-cardiovascular risk,target organ damage,and treatment outcomes in primary aldosteronism[J]. Front Cardiovasc Med,2021,8:798364. DOI:10.3389/fcvm.2021.798364.
GENNARI F J. Hypokalemia[J]. N Engl J Med,1998,339(7):451-458. DOI:10.1056/nejm199808133390707.
K?PERS E M,AMAR L,RAYNAUD A,et al. A clinical prediction score to diagnose unilateral primary aldosteronism[J]. J Clin Endocrinol Metab,2012,97(10):3530-3537. DOI:10.1210/jc.2012-1917.
ZHANG Y,NIU W Q,ZHENG F F,et al. Identifying unilateral disease in Chinese patients with primary aldosteronism by using a modified prediction score[J]. J Hypertens,2017,35(12):2486-2492. DOI:10.1097/HJH.0000000000001488.



