危芬兰王胜德(江西省鹰潭市人民医院肿瘤科 鹰潭 335000)
HIF-1a、COX-2在直肠癌组织中的表达及其临床意义*
危芬兰**王胜德
(江西省鹰潭市人民医院肿瘤科 鹰潭 335000)
目的:探讨HIF-1a、COX-2在直肠癌组织中的表达及其临床意义。方法:收集手术切除的直肠癌组织标本69例作为研究组,同期收集癌旁正常直肠组织(直肠癌边缘外>6 cm)标本69例作为对照组,采用免疫组化方法检测HIF-1a、COX-2表达,比较两组HIF-1a、COX-2阳性表达率,分析两者与直肠癌临床病理因素的关系。结果:研究组HIF-1a、COX-2阳性表达率均明显高于对照组(P<0.05);HIF-1a、COX-2表达与直肠癌Ducks分期、组织分化程度和淋巴结转移紧密相关,Ducks分期越高、组织分化程度越低,合并淋巴结转移者直肠癌组织HIF-1a、COX-2阳性表达率显着增高(P<0.05)。结论:HIF-1a、COX-2在直肠癌组织中的高表达与临床分期、组织分化程度和淋巴结转移等临床病理特征显着相关。
HIF-1a COX-2 直肠癌
缺氧诱导因子-1a(hypoxia inducible factor-1a,HIF-1a)是在缺氧状态下普遍存在于人类机体的核转录因子,在肿瘤的发生和发展中具有重要的意义[1]。环氧化酶-2(cyclooxygenase-2,COX-2)通过促进肿瘤细胞增殖、抑制肿瘤细胞凋亡等机制共同参与肿瘤的发生和发展,促进恶性肿瘤的侵袭和转移。相关研究表明,COX-2、HIF-1a的表达与直肠癌治疗效果具有紧密的关系[2]。但关于HIF-1a、COX-2在直肠癌组织中的表达及其与病理特征的关系研究报道甚少,现报道如下。
1 资料与方法
1.1 临床资料
收集我院2013年1月至2015年1月期间手术切除的直肠癌组织标本69例作为研究组。其中男45例,女24例,年龄39~77岁,平均年龄(62.38±6.01)岁;病理类型:乳头状腺瘤47例,管状腺癌14例,黏液腺癌8例;临床分期(参照Ducks分期标准[3]):A+B期21例,C期32例,D期16例;组织分化程度:低分化16例,中分化33例,高分化20例。纳入标准:全部患者均符合直肠癌的手术病理诊断标准[4],术前未接受放射性治疗、化疗、免疫治疗、中医中药治疗、生物靶向治疗和药物等抗肿瘤治疗措施,本研究通过伦理委员会审核。排除标准:具有肠癌根治术史,合并其他肿瘤、心肝肾功能衰竭、全身感染性疾病和精神性疾病患者。同期收集癌旁正常直肠组织(直肠癌边缘外>6 cm)标本69例作为对照组。
1.2 检测方法
1) 试剂与仪器。鼠抗人HIF-1a单克隆抗体、鼠抗人COX-2单克隆抗体、免疫组化试剂盒、HE染色试剂盒(型号:BS115-SJH,中国武汉博士德公司)、DAB显色剂、PBS缓冲液(北京中杉生物技术有限公司)、中性树胶(产品编号:CW0128,北京康为世纪生物科技有限公司)、Zeiss Axioskop显微镜(德国)、Thermo scientific全自动封片机(英国)。
2) 操作步骤。采用免疫组化方法检测HIF-1a、COX-2表达,术中采集直肠癌组织标本和癌旁正常直肠组织(直肠癌边缘外>6 cm)标本,甲醛固定石蜡包埋,连续4 μm切片,60 ℃烤片1 h,二甲苯脱蜡3次,每次5 min,浸入无水乙醇、85%乙醇和75%乙醇各5 min,进入蒸馏水5 min水化;采用柠檬酸修复工作液对石蜡切片进行高压修复,修复工作液加入高压锅中,待修复切片浸入修复液中,盖上压力锅盖,加热至均匀喷气,2 min后压力锅离开热源,自动冷却至室温,蒸馏水淋洗后采用PBS缓冲液洗涤2次,每次3 min,滴加过氧化物酶封闭液,室温下孵育10 min,PBS缓冲液充分淋洗,滴加封闭用羊血清工作液,室温下孵育10 min,甩干,滴加HIF-1a(1∶100)、COX-2(1∶100),4℃冰箱孵育过夜,PBS缓冲液充分淋洗,滴加生物素羊抗兔二抗工作液,室温下孵育10 min,PBS缓冲液充分淋洗,DAB显色剂显色1~5 min,显微镜下观察显色时间,当达到最佳显色效果后蒸馏水冲洗终止显色,苏木精复燃0.5~3 min,自来水冲洗复染液,PBS缓冲液浸泡3~5 min,细胞核返蓝,脱水,二甲苯透明,中性树胶封片。
1.3 免疫组化结果判定[5-6]
显微镜下观察细胞膜、细胞浆或细胞核上出现棕黄褐色颗粒为阳性细胞,随机选取5个400倍视野,当未见阳性细胞者评定为0分,当阳性细胞比例<25%者评定为1分,当阳性细胞比例25%~75%者评定为2分,当阳性细胞比例>75%者评定为3分;不显色或显色模糊者评定为0分,浅黄色者评定为1分,棕黄色者评定为2分,棕褐色者评定为3分,两项相加即为最终判定结果。0~1分为阴性,2~3分为弱阳性,4~5分为中度阳性,>5分为强阳性。
1.4 统计学处理
本研究数据采用SPSS 18.0统计软件进行分析,两组间的计数资料采用χ2检验,Pearson相关性分析直肠癌组织HIF-1a、COX-2表达之间的关系,P<0.05提示差异具有统计学意义。
2 结果
2.1 两组HIF-1a、COX-2阳性表达率比较
研究组HIF-1a、COX-2阳性表达率均明显高于对照组,两组比较差异具有统计学意义(表1)。
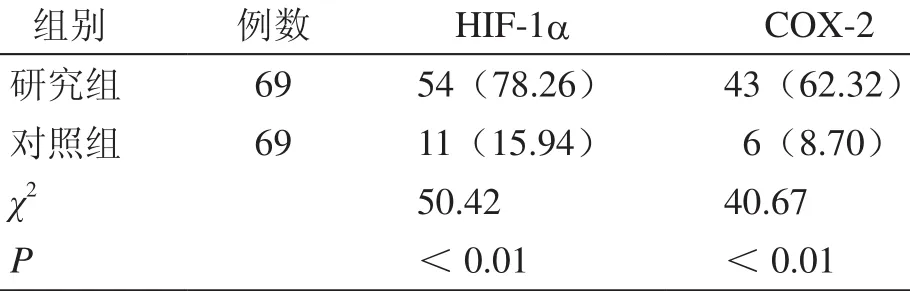
表1 两组HIF-1a、COX-2阳性表达率比较[阳性例数(%)]
2.2 HIF-1a、COX-2表达与直肠癌组织病理临床因素的关系
HIF-1a、COX-2表达与直肠癌Ducks分期、组织分化程度和淋巴结转移紧密相关,不同Ducks分期、组织分化程度和淋巴结转移者直肠癌组织HIF-1a、COX-2阳性表达率比较差异均具有统计学意义(P<0.05)。Ducks分期越高,组织分化程度越低,合并淋巴结转移者直肠癌组织的HIF-1a、COX-2阳性表达率显着增高(表2)。
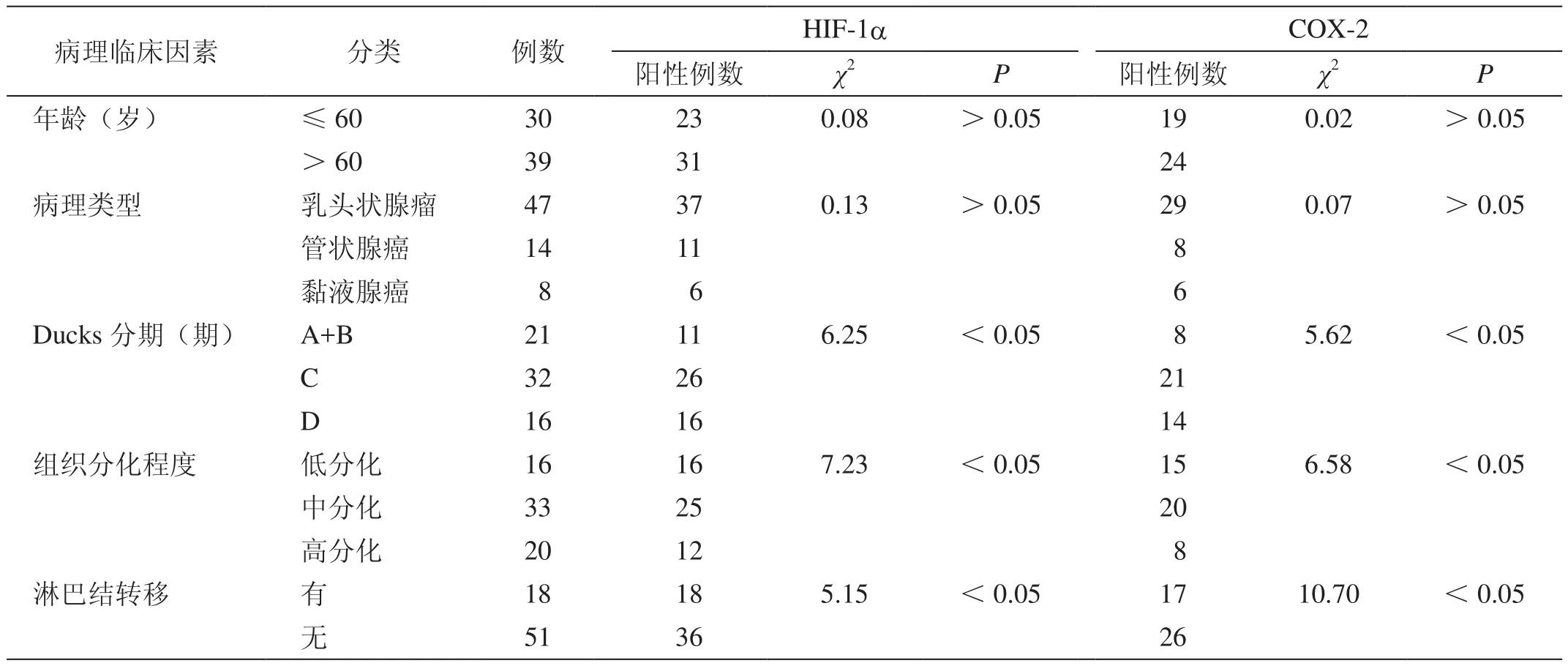
表2 HIF-1a、COX-2表达与直肠癌组织病理临床因素的关系
2.3 直肠癌组织HIF-1a、COX-2表达之间的关系
直肠癌组织中HIF-1a、COX-2表达均为阳性的为42例,均为阴性的为14例,HIF-1a阳性、COX-2阴性的为12例,HIF-1a阴性、COX-2阳性的为1例。经Pearson相关性分析显示,直肠癌组织HIF-1a、COX-2表达之间具有明显的正相关(r=0.759,P<0.01)。
3 讨论
HIF-1a通过调控糖酵解作用增强机体对低氧的耐受程度,为肿瘤细胞供应能量[7]。当肿瘤细胞体积扩大时,HIF-1a通过调控血管生成调节氧运输能力,为肿瘤细胞增殖、转移和侵袭提供条件。关于HIF-1a在直肠癌中的调控分子机制尚有待进一步的研究探讨。
COX-2是一种诱导型蛋白酶,正常生理状况下,机体COX-2表达活性较低。近期研究显示,COX-2不仅在炎症中发挥重要的作用,且通过促进细胞增殖、抑制细胞凋亡和促进肿瘤新生血管形成等作用,在参与恶性肿瘤的发生和发展过程中具有重要的价值[8]。目前研究显示,COX-2在乳腺癌、肺癌、结肠癌等恶性肿瘤组织中的表达均显着性上调[9]。COX-2表达与胃癌组织分化程度、浸润深度、临床TNM分期和淋巴转移等临床病理特征显着相关[10]。
本研究结果显示,直肠癌组织HIF-1a、COX-2阳性表达率均明显高于正常直肠黏膜组织,两者比较差异具有显着性。HIF-1a、COX-2表达与直肠癌Ducks分期、组织分化程度和淋巴结转移紧密相关,Ducks分期越高,组织分化程度越低,合并淋巴结转移者直肠癌组织HIF-1a、COX-2阳性表达率显着增高。因此,HIF-1a、COX-2参与了直肠癌发生和发展过程,其阳性表达率越高,直肠癌临床分期、组织分化程度和淋巴结转移程度加重。
侵袭和转移是直肠癌的重要生物学特征,也是导致直肠癌患者死亡的主要原因之一。恶性肿瘤侵袭和转移是一个多因子、多基因共同参与的病理过程。相关研究显示,COX-2通过对花生四烯酸催化作用,导致血栓烷形成,激活HIF-1a,增加恶性肿瘤侵袭和转移活性。本研究结果显示,经Pearson相关性分析直肠癌组织HIF-1a、COX-2表达之间具有明显的正相关,与相关研究结果具有一致性[11-12]。因此,HIF-1a、COX-2在直肠癌临床发生和发展的生物学过程中发挥促进作用。
综上所述,HIF-1α,COX-2在直肠癌组织中的显着性高表达,且两者与临床分期、组织分化程度和淋巴结转移等临床病理特征显着相关。
[1] 黄素军, 吴斌文, 李东风, 等. 结直肠癌中AEG-1对血管生成相关因子HIF-1a和miR-34a的影响[J]. 世界华人消化杂志, 2014, 40(18): 2532-2538.
[2] 徐昶, 宋华羽, 左志贵, 等. 直肠癌HIF-1a和COX-2的表达与新辅助放化疗敏感性的相关性[J]. 温州医科大学学报, 2014, 44(5): 348-351.
[3] 程伯溪, 涂朝勇, 龚恩来. 直肠癌患者行腹腔镜根治术后感染的危险因素分析[J]. 中华医院感染学杂志, 2015,25(1): 186-188.
[4] 郭小泉, 刘佳, 杨勇. 结直肠癌预后影响因素的COX回归分析[J]. 中国肿瘤外科杂志, 2012, 4(5): 262-264.
[5] 魏洁, 徐勤, 杨丽华. HIF-1a、Twist和Vimentin在宫颈癌组织中的表达及其临床意义[J].中国妇幼保健, 2014, 39(33): 5487-5489.
[6] 孙晓艳, 王亚帝, 何东宁, 等. BAG-1S和COX-2基因在非小细胞肺癌中的表达及其对预后的意义[J]. 中国全科医学, 2014, 47(32): 3840-3845.
[7] 陈俊林, 赵驰. 肝细胞癌中RHAMM和HIF-1a的表达及临床意义[J]. 临床与实验病理学杂志, 2014, 30(11): 1297-1299.
[8] 赵永强, 谢晓烨, 陈雪梅, 等. COX-2选择性抑制剂诱导人喉癌Hep-2细胞凋亡及自噬的体外研究[J]. 山东大学学报:医学版, 2014, 52(9): 39-43.
[9] 孙炯. 检测凋亡抑制因子Bcl-2、Cox-2表达水平在评估早期宫颈癌患者预后的价值分析[J]. 中国妇幼保健, 2014, 29(35): 5789-5791.
[10] 吴慧娟, 吴红波, 邹宏志, 等. 胃癌组织中环氧化酶2对幽门螺杆菌感染的胃癌侵袭与转移能力影响[J]. 中华医院感染学杂志, 2014, 24(16): 3939-3941.
[11] 于景龙, 于佳卉, 徐贵颖, 等. COX-2及P53在乳腺癌中的表达及临床意义[J].中国妇幼保健, 2014, 29(16): 2523-2524.
[12] 韩丽萍, 朱科科, 余海洋, 等. IEX-1、HIF-1a和NF-kB蛋白在宫颈癌组织中的表达及临床意义[J]. 中国妇幼保健, 2014, 29(32): 5299-5302.
The expression of HIF-1α and COX-2 in colorectal cancer tissue and its clinical significance*
WEI Fenlan**, WANG Shengde
(Department of Oncology, The People’s Hospital of Yingtan City, Jiangxi Province, Yingtan 335000, China)
Objective: To investigate the expression of HIF-1a and COX-2 in colorectal cancer tissue and its clinical significance. Methods: Specimens from both the colorectal cancer tissue of operation resection and the adjacent normal rectal tissue (the edge of rectal cancer>6 cm) were selected as a study group and a control group with 69 cases each, respectively. The expression of both HIF-1a and COX-2 was detected by an immunohistochemical method and the positive rate of their expression was compared between two groups. The relationship between their expression and the clinical pathological factors of colorectal cancer were analyzed. Results: The positive rate of HIF-1a and COX-2 expression was significantly higher in the study group than in the control group (P<0.05) and their expression was closely related to Ducks staging, differentiation degree and lymph node metastasis. The higher Ducks stage was, the lower the differentiation degree was, and the positive rate of their expression in the colorectal cancer tissue complicated with lymph node metastasis was significantly increased (P<0.05). Conclusion: The over expression of HIF-1a and COX-2 in colorectal cancer tissue is significantly correlated with the clinical stage, tissue differentiation degree and lymph node metastasis.
HIF-1a; COX-2; colorectal cancer
R735.37
A
1006-1533(2015)19-0050-03
2015年江西省卫生计生委科技计划(项目编号:20151555)
**
危芬兰,主治医师,主要从事肿瘤研究。E-mail:124167059@qq.com
2015-04-15)



