白鲁源 孙光碧 杨丽 王贞丽
[摘要] 目的
探讨柴芍六君子汤(CLD)治疗酒精性肝损伤(alconholic liver damage, ALD)的作用及机制。
方法 雄性C57BL/6小鼠50只,随机分为对照组(A组)、模型组(B组)、CLD低剂量组(C组)、CLD中剂量组(D组)、CLD高剂量组(E组),B~E组小鼠每天灌胃体积分数0.56的乙醇溶液(6 g/kg),同时C~E组小鼠再分别每天灌胃2.5、5、10 g/kg CLD,A组小鼠每天灌胃相同体积生理盐水,连续灌胃15 d,每5 d测量一次小鼠体质量。实验结束后,留取各组小鼠新鲜粪便,梯度稀释后平板培养分析粪便中肠道菌群的组成;小鼠麻醉后眼球取血检测各组小鼠血清中谷草转氨酶(AST)、谷丙转氨酶(ALT)、γ-转肽酶(γ-GT)、碱性磷酸酶(ALP)、总胆红素(T-BIL)、三酰甘油(TG)、总胆固醇(TC)含量;处死小鼠后剥离肝脏并计算肝脏指数;对肝组织切片行苏木素-伊红(HE)染色进行病理学分析。
结果 第15天时,与B组相比,C、E组小鼠体质量明显升高(q=4.217~7.573,P<0.05),E组小鼠肝脏指数明显降低(q=4.997,P<0.05)。与B组相比,C~E组小鼠血清中ALT、AST、γ-GT、ALP、T-BIL、TG的水平均呈剂量依赖性降低(q=4.705~19.790,P<0.05),血清TC水平比较无显着差异(P>0.05)。肝组织病理学分析结果显示,与B组相比,C~E组小鼠肝脏病理损伤减轻。肠道菌群检测结果显示,与B组相比,D组和E组小鼠肠道肠杆菌、肠球菌丰度明显降低(q=7.209~11.730,P<0.05),乳酸杆菌、双歧杆菌的丰度明显升高(q=4.811~23.470,P<0.05),E组小鼠肠道类杆菌丰度与B组相比显着升高(q=4.651,P<0.05)。
结论 CLD能有效调节ALD小鼠肠道菌群,改善小鼠肝功能,对小鼠ALD具有治疗作用。
[关键词] 柴芍六君子汤;肝疾病,酒精性;肝功能试验;胃肠道微生物组;小鼠;近交C57BL
[中图分类号] R575;R286.5 [文献标志码] A
酒精性肝损伤(alcoholic liver damage,ALD)是由于长期大量饮酒导致的肝脏疾病,后续可发展成为肝炎、肝纤维化、肝衰竭甚至肝癌等一系列肝病,已成为人类健康的严重威胁之一[1-2]。因此,迫切需要寻找一种有效的治疗方法,以降低ALD患者的病情进展的速度。临床实践表明,肠道菌群失衡在ALD发生机制中具有重要作用[3-4]。
据《医宗金鉴》记载,柴胡、半夏、甘草、白术、钩藤、党参、陈皮、白芍、茯苓等药材为柴芍六君子汤(CLD)组方,该方剂用于健脾平肝、化痰祛风[5],是中国传统中药治疗肝病的经典药方之一[6]。现代中医药把肠道菌群的失衡当作治疗ALD的一个重要方向,但目前尚未有CLD调节肠道菌群治疗ALD的报道。本研究通过观察CLD对ALD小鼠肝脏功能的改善作用和肠道菌群的调节作用,探讨CLD在治疗ALD方面的效果,以期能为ALD的治疗提供思路。
1 材料与方法
1.1 实验动物
雄性SPF级C57BL/6小鼠共50只,体质量(20±2)g,购自于北京维通利华实验动物技术有限公司;生产许可证编号:SCXK(京)2022-0013,合格证编号:211002300047215;饲养于温度(25±2)℃,湿度(50±10)%,12 h光暗循环环境中。
1.2 药物与试剂
体积分数0.56的乙醇溶液购于北京红星股份有限公司;苏木素-伊红(HE)(货号G1120)染色试剂盒购于北京索莱宝科技有限公司;柴胡、半夏、甘草、白术、钩藤、党参、陈皮、白芍以及茯苓购于青岛大学附属医院药剂科(批号:SYKGQDYXGS,上药控股青岛有限公司);乙醚购于国药集团化学试剂有限公司。
1.3 药物配制
柴胡、半夏、甘草、白术、钩藤、党参、陈皮、白芍、茯苓,按照古方比例准确称取共250 g。以上药物冷水浸泡40 min后,武火加热沸腾10 min后,再文火熬煮30 min,取药液;如法再煎煮一次,合并两次药液后,浓缩至1 g/mL,4 ℃下保存,用前复温至37 ℃。
1.4 动物分组与处理
C57BL/6小鼠随机分为对照组(A组)、模型组(B组)、CLD低、中、高剂量组(C~E组),每组10只。每日10:00,B~E组小鼠灌胃体积分数0.56的乙醇溶液(6 g/kg)[7],A组小鼠灌胃等量生理盐水;每日16:00,C~E组小鼠分别灌胃2.5、5、10 g/kg CLD,A、B组小鼠灌胃等量生理盐水。各组小鼠均连续灌胃15 d,期间观察各组小鼠的毛色、摄食及活动情况等,每5 d测量一次体质量。
灌胃第15天,测量体质量后,抓取小鼠轻轻挤压其下腹部迫使小鼠排便,收集3~6颗粪便颗粒于无菌EP管中,4 ℃下保存备用。各组小鼠乙醚麻醉后,摘除眼球取血,室温静置1 h以后,4 ℃下以3 000 r/min离心10 min,取血清,-20 ℃保存备用。随后断颈处死小鼠,剥离小鼠肝脏组织并测量肝脏质量,计算肝脏指数,保存肝脏备用。
1.5 血清生化指标检测
依照试剂盒说明书操作,使用B200V全自动生化分析仪(南京英诺华科技有限公司)检测各组小鼠血清中的谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-转肽酶(γ-GT)、碱性磷酸酶(ALP)、总胆红素(T-BIL)、三酰甘油(TG)、总胆固醇(TC)含量。
1.6 小鼠肝脏组织HE染色及观察
取各组小鼠肝脏组织于4%多聚甲醛中固定72 h,依次行乙醇梯度脱水、常规石蜡包埋、切片,按照试剂盒说明书对切片进行HE染色,光学显微镜下观察并拍照[8]。
1.7 肠道菌群检测
分别取各组的每只小鼠粪便0.5 g,置于装有玻璃珠的无菌小瓶内加0.01 mol/L PBS(pH 7.2)4.5 mL稀释,于振荡器上振荡20 min,当小鼠粪便均质化后,配置成终浓度10 g/L的母液,设定为10-1。根据预实验结果,用PBS对母液进行10倍梯度稀释,将浓度为10-3的粪便稀释液0.1 mL接种于肠杆菌培养基(EMS培养基),10-4的粪便稀释液0.1 mL接种于肠球菌培养基(叠氮钠-结晶紫-七叶苷琼脂),10-4的粪便稀释液0.1 mL接种于类杆菌培养基(BDS培养基),10-5的粪便稀释液0.1 mL接种于乳酸杆菌培养基(LBS培养基),10-5的粪便稀释液0.1 mL接种于双歧杆菌培养基(BBL培养基)。然后将上述培养基分别放置于37 ℃恒温箱中,需氧培养48 h或厌氧培养48~72 h后。用菌落形态比较、革兰染色镜检等方法对所生长出的菌落进行鉴定,确定为目标菌后进行菌落计数,计算菌含量(CFU/g),CFU/g=每一稀释度平均菌落数×稀释倍数×100,结果以对数值lgCFU·g-1表示。
1.8 统计学方法
采用Graphpad 9.0软件对数据进行统计分析,计量资料以[AKx-D]±s表示,多组间比较采用单因素方差分析,进一步两两比较采用t检验,重复测量设计采用双因素方差分析。以P<0.05表示差异有统计学意义。
2 结 果
2.1 CLD对ALD小鼠体质量和肝脏指数的影响
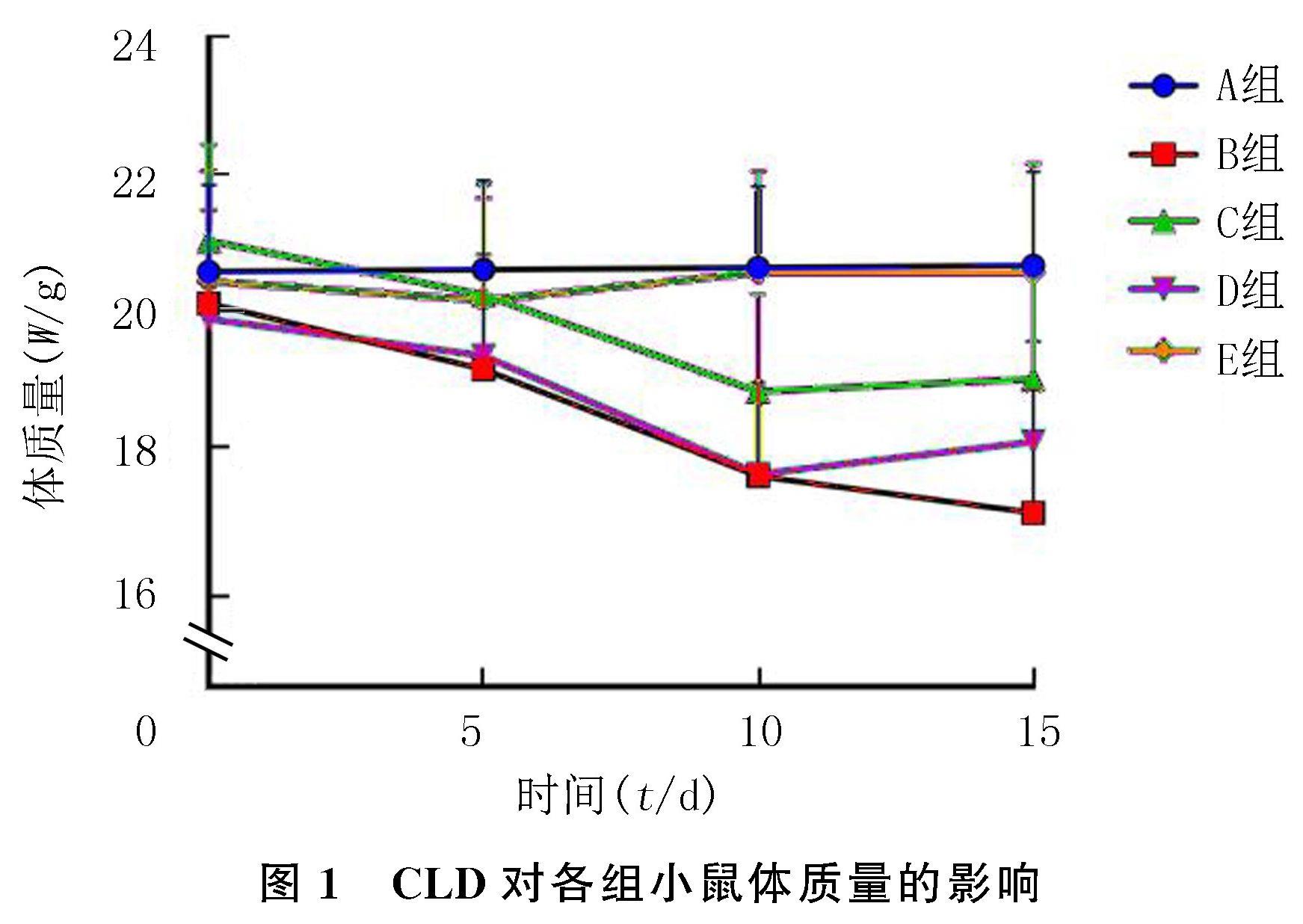
灌胃期间对各组小鼠的一般情况进行观察,A组小鼠毛发有光泽,活动敏捷,食欲良好;B组小鼠灌胃第5天时开始出现食欲不振、畏寒和毛发枯槁等情况;C~E组小鼠毛发黑亮,精神状态与活动均正常。重复测量设计的方差分析结果显示,分组、时间、分组与时间交互对各组小鼠体质量具有显着影响(F时间=17.510,F组间=10.220,F交互=2.365,P<0.05)。单独效应结果显示,组内比较,A、E组小鼠各时间点体质量均无明显差异(P>0.05),B、C、D组小鼠第10、15天与第0、5天相比体质量明显降低(q=3.872~6.604,P<0.05),组间比较,第0、5天时各组小鼠体质量无明显差异(P>0.05);第10天时,B、D组与A、E组相比体质量均明显降低(q=6.346~6.561,P<0.05),其余各组间体质量无明显差异(P>0.05);第15天时,B、D组与A组相比体质量明显降低(q=5.550~7.788,P<0.05),C、E组与B组相比、E组与D组相比体质量明显升高(q=4.217~7.573,P<0.05),其余各组间体质量无明显差异(P>0.05)。见图1。
实验第15天时A~E组小鼠肝脏指数分别为4.49±0.67、5.81±1.02、5.11±0.93、4.76±0.80、4.48±0.74,各组间比较差异有显着性(F=4.347,P<0.05);两两比较结果显示,B组与A、E组相比,小鼠肝脏指数均有明显升高(q=4.960~4.997,P<0.05),其余各组两两比较均无明显差异(P>0.05)。
2.2 CLD对ALD小鼠肝功能的影响
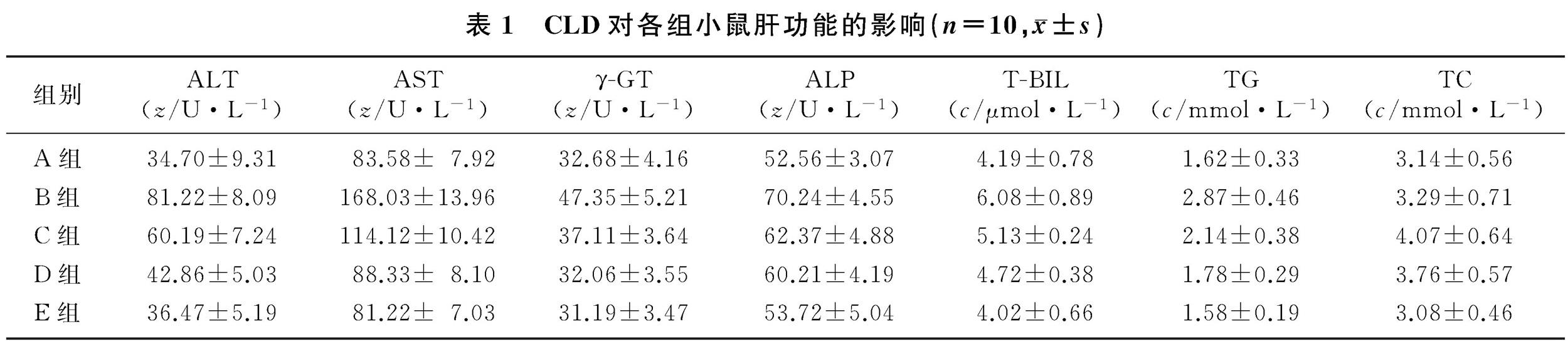
各组小鼠血清当中的ALT、AST、γ-GT、ALP、T-BIL、TG、TC水平比较差异均具有显着性(F=5.226~138.600,P<0.05),其中与A组相比,B组小鼠血清中ALT、AST、γ-GT、ALP、T-BIL、TG水平均显着增高(q=9.361~20.530,P<0.05),血清中TC水平比较无显着差异(P>0.05)。与B组相比,C~E组小鼠血清中的ALT、AST、γ-GT、ALP、T-BIL、TG的水平呈剂量依赖性降低(q=4.705~19.790,P<0.05),血清中TC水平比较无显着差异(P>0.05)。见表1。
2.3 CLD对ALD小鼠肝组织结构的影响
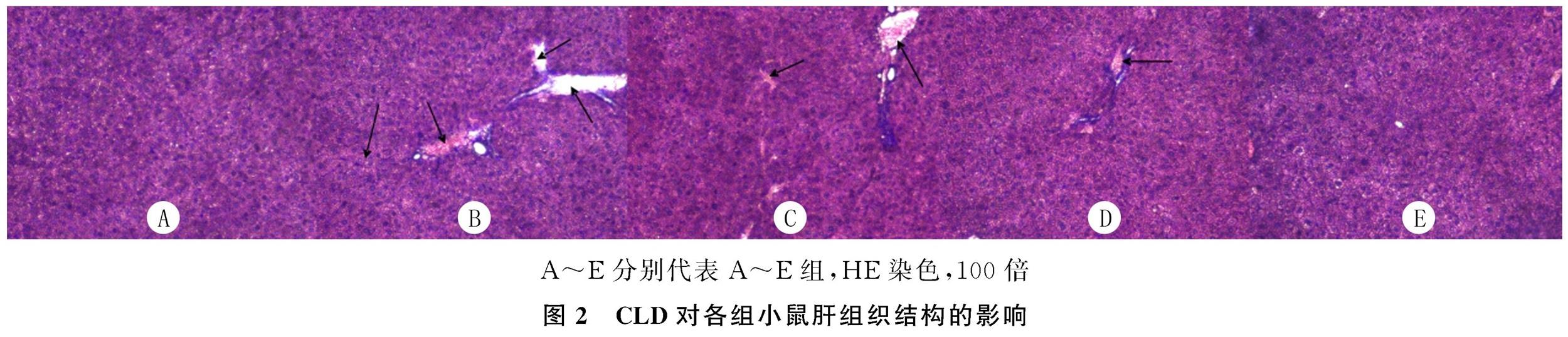
HE染色结果显示,A组肝组织肝细胞以中央静脉为中心单行排列成板状结构,肝小叶结构正常,未见炎性浸润。B组小鼠肝细胞间出现不规则空泡,肝窦充血,可见炎性浸润。与B组相比,C~E组小鼠脂肪空泡和炎性浸润明显减少,肝窦充血明显缓解,肝小叶结构较完整,其中E组与A组肝脏形态接近一致。见图2。
2.4 CLD对ALD小鼠肠道菌群的影响
各组小鼠肠杆菌、肠球菌、乳酸杆菌、双歧杆菌、类杆菌丰度比较差异均具有显着性(F=5.059~115.400,P<0.05);两两比较结果显示,与A组相比,B组小鼠肠杆菌、肠球菌的丰度均显着升高(q=10.870、11.190,P<0.05),乳杆菌、双歧杆菌以及类杆菌的丰度均显着降低(q=5.009~20.700,P<0.05);与B组相比,D组和E组肠杆菌、肠球菌的丰度均呈剂量依赖性降低(q=7.209~11.730,P<0.05),乳酸杆菌、双歧杆菌的丰度均呈剂量依赖性地升高(q=4.811~23.470,P<0.05),E组小鼠肠道类杆菌的丰度与B组相比显着升高(q=4.651,P<0.05)。见表2。
3 讨 论
肝脏是人体的重要脏器,具有代谢、解毒等重要功能,肝脏损伤主要与氧化应激、感染、微循环障碍、细胞凋亡等有关[9-10]。ALD的主要干预措施为戒酒联合药物治疗,截至目前仍缺乏有效的防治手段。随着ALD药物治疗的发展,越来越多的药物应用于临床治疗,然而药物副作用常导致肝细胞损伤和肠道菌群紊乱,进一步引起肝功能损伤[11]。因此,寻求新的防治药物成为抗肝病药物治疗的关键。中药复方治疗肝损伤在中国已经有上千年的历史,近年来研究显示,中药复方治疗ALD具有效果明显、作用靶点多、副作用少等优势,具有保肝降酶、促进肝细胞再生等作用[12-13],应用前景广阔,是近年来研究的热点之一。
CLD方剂中党参、白术、茯苓、甘草可健脾益气渗湿;柴胡、白芍配伍疏肝柔肝,敛阴合营;陈皮、半夏配伍降逆和胃,重在理气[14]。研究显示,CLD可降低慢性乙型肝炎患者血清ALT、ALP、TG、TC水平,有改善肝脏功能的效果[15-16]。王军义[17]研究发现,联合CLD和抗病毒药物治疗慢性乙型肝炎患者,治疗组总有效率大于90%。钟锐[18]采用CLD治疗慢性乙肝肝纤维化患者,相较于对照组,治疗组的临床有效率更高,肝功能指标、细胞因子谱等各项生化指标较治疗前都具有明显改善。肝脏作为酒精代谢的主要场所,过量的酒精摄入可导致肝组织损伤,肝细胞膜通透性增加,释放AST、ALT、ALP入血,因此血液中ALT、AST、ALP水平升高是肝细胞损伤的特征性表现[19]。此外,肝脏也是脂质代谢的重要器官,在TG、TC等脂质物质的生物合成以及脂质的转化与排泄等过程中发挥重要作用[20]。酒精引起肝细胞功能受损,影响线粒体脂肪酸-β氧化,血脂、脂蛋白及载脂蛋白的合成、转运、代谢等过程紊乱,使脂肪在血液和肝细胞内沉积,导致血液中TG、TC明显升高[21]。本研究使用酒精诱导小鼠肝损伤后,与对照组比较,小鼠一般状态变差,体质量下降,肝脏功能指标ALT、AST、ALP以及T-BIL水平均显着增高,血脂水平指标TG升高,肝脏组织肝细胞排列紊乱,有不规则脂肪空泡产生,肝血窦充血和炎性细胞浸润,表明肝脏组织呈病理损伤状态。CLD各剂量组与模型组比较,肝功能指标剂量依赖性恢复正常,血脂水平降低,表明CLD对ALD具有治疗作用。
肠道菌群以一定的组成规律分布在肠道,维持肠内微生态平衡[22]。然而长期饮酒会影响肠道菌群组成和分布,且损伤肠黏膜,有益菌减少而有害菌增多,产生大量内毒素等有害物质,这些物质随门静脉进入肝脏,最终造成肝脏损伤[23-25]。本研究结果显示,与模型组相比,以CLD不同剂量治疗后,小鼠肠道的有益菌乳酸杆菌、双歧杆菌和类杆菌丰度显着升高,而致病菌肠杆菌、肠球菌丰度显着降低。说明CLD对小鼠ALD的治疗作用与肠道中条件致病菌相对丰度降低及有益菌相对丰度升高有关。
基于肠道菌群结构复杂、功能多样的特点,本研究只对丰度较高的肠道有益菌和有害菌的代表性物种进行了初步分析,其他大部分菌群还有待进一步的检测与分析。基于高通量测序技术对ALD小鼠肠道菌群的深度分析,将对CLD的作用机制提供更丰富的数据支持,也是下一步的研究方向之一。
综上,CLD可显着改善酒精引起的小鼠肝脏功能的损伤,其机制可能与调节肠道微生态紊乱有关。本研究结果提示CLD在治疗ALD上有潜在应用价值,为中药复方应用于临床防治ALD提供了新的思路和参考,值得进一步的深入研究。
伦理批准和动物权利声明:本研究涉及的所有动物实验均已通过青岛大学医学部伦理委员会的审核批准(文件号QDU-AEC-202401-1)。所有实验过程均遵照科技部《实验动物管理条例》进行。
[参考文献]
[1]聂文. 金华火腿中的寡肽和脂肪酸对小鼠酒精性肝损伤的预防作用及其机制研究[D]. 合肥:合肥工业大学, 2022.
[2]DEVARBHAVI H, ASRANI S K, ARAB J P, et al. Global burden of liver disease: 2023 update[J]. J Hepatol, 2023,79(2):516-537.
[3]ALBILLOS A, DE GOTTARDI A, RESCIGNO M. The gut-liver axis in liver disease: Pathophysiological basis for therapy[J]. J Hepatol, 2020,72(3):558-577.
[4]ZHANG B X, NIU L J, HUANG X W. Lonicera caerulea juice alleviates alcoholic liver disease by regulating intestinal flora and the FXR-FGF15 signaling pathway[J]. Nutrients, 2023,15(18):4025.
[5]石佼灵,王若宇,孙克伟. 柴芍六君子汤联合西药对慢性乙型肝炎疗效的Meta分析[J]. 实用中医内科杂志, 2023,37(6):41-44,147-149.
[6]黄菊芳,李炜,罗茂权,等. 柴芍六君子汤治疗消化系统疾病研究进展[J]. 亚太传统医药, 2020,16(11):159-162.
[7]尤红娟. 基于肠道微环境探讨四君子汤“实脾治肝” 防治酒精性肝损伤的作用[D]. 青岛:青岛大学,2023.
[8]郭子雨,李晨阳,左递军,等. 睡莲花总黄酮对小鼠酒精肝损伤的防治作用研究[J]. 中国食品添加剂, 2023,34(4):205-211.
[9]QIAN H, CHAO X J, WILLIAMS J, et al. Autophagy in liver diseases: A review[J]. Mol Aspects Med, 2021,82:100973.
[10]HAN H, DESERT R, DAS S, et al. Danger signals in liver injury and restoration of homeostasis[J]. J Hepatol, 2020,73(4):933-951.
[11]鲍旭. 酒精性肝病的治疗进展[J]. 基层医学论坛, 2019,23(32):4705-4707.
[12]孟文文,刘慧茹,张文光,等. 中药防治酒精性肝病作用机制的研究进展[J]. 中草药, 2022,53(3):868-881.
[13]LAN Y W, YAN R, SHAN W, et al. Salvianic acid A alleviates chronic alcoholic liver disease by inhibiting HMGB1 translocation via down-regulating BRD4[J]. J Cell Mol Med, 2020,24(15):8518-8531.
[14]梁攀,徐基平. 徐基平教授从脾虚论治肝癌经验[J]. 中国中医药现代远程教育, 2021,19(2):93-95.
[15]高改娅,白艳艳,康艳,等. 柴芍六君子汤临床应用研究进展[J]. 实用中医药杂志, 2020,36(2):267-269.
[16]黄维. 柴芍六君子汤对肝郁脾虚型慢性乙型肝炎的治疗效果评价[J]. 中外医学研究, 2019,17(5):51-52.
[17]王军义. 柴芍六君子汤治疗肝郁脾虚型慢性乙型肝炎临床观察[J]. 光明中医, 2021,36(21):3638-3641.
[18]钟锐. 柴芍六君子汤加减方治疗肝纤维化60例[J]. 环球中医药, 2012,5(6):453-455.
[19]KONG X Y, LIANG W, LI X Y, et al. Characterization of an acidic polysaccharides from carrot and its hepatoprotective effect on alcoholic liver injury in mice[J]. Chem Biodivers, 2021,18(8):e2100359.
[20]GENG Y N, FABER K N, DE MEIJER V E, et al. How does hepatic lipid accumulation lead to lipotoxicity in non-alcoholic fatty liver disease?[J]. Hepatol Int, 2021,15(1):21-35.
[21]温扬敏,田力,王小斐,等. DHA单酰基甘油酯型藻油对小鼠急性酒精性肝损伤的保护作用[J]. 中国粮油学报, 2024,10(1):131-140.
[22]文永岚,王瑜,万科,等. 刺梨酵素化果醋对小鼠急性酒精性肝损伤的改善作用[J]. 现代食品科技, 2023,39(4):26-32.
[23]李国华,李鹤龄,陈智岗,等. 酒精性肝病与肠道微生物群落研究进展[J]. 中国实验动物学报, 2022,30(3):423-427.
[24]LI F Y, MCCLAIN C J, FENG W K. Microbiome dysbiosis and alcoholic liver disease[J]. Liver Res, 2019,3(3-4):218-226.
[25]LIANG H Y, SONG H, ZHANG X J, et al. Metformin attenuated sepsis-related liver injury by modulating gut microbiota[J]. Emerg Microbes Infect, 2022,11(1):815-828.



