赵瑞娜,张 波,姜玉新
中国医学科学院 北京协和医学院 北京协和医院超声诊断科,北京 100730
头颈部恶性肿瘤的颈部淋巴结转移率高,研究显示约30%的分化型甲状腺癌患者首诊时可发现转移性淋巴结[1],行常规淋巴结清扫患者的病理结果表明转移率更高,可达60%[2]。颈部转移淋巴结对手术方式、清扫范围选择及术后患者生活质量、复发率和生存率评估具有重要意义,故评估颈部淋巴结对头颈部肿瘤患者至关重要。然而,触诊对转移性淋巴结诊断的敏感性远远不够,尤其当淋巴结较小或位于颈部中央区、胸锁乳突肌深面时,因此需要进行影像学辅助诊断。
目前检测技术包括超声成像、磁共振成像(magnetic resonance imaging,MRI)、计算机断层扫描(computed tomography,CT)、正电子发射断层成像术/计算机断层扫描 (positron emission tomography-computed tomography,PET/CT)及单光子发射计算机断层成像术/计算机断层扫描 (single-photon emission computed tomography-computed tomography,SPECT/CT)等,其中超声成像对淋巴结评估具有明显的优势,其不仅具有快速、简捷、经济、无创、空间分辨率高的特点,还可以行多切面扫查、应用彩色多普勒实时检测血流,必要时可行超声引导下细针穿刺活检。因不同研究采用的样本、评估指标及临界值不同,常规超声诊断颈部转移性淋巴结准确度不一,介于70% ~85%之间[3]。超声目前已成为判断颈部淋巴结良恶性的重要手段。美国甲状腺学会 (American Thyroid Association,ATA)2009年更新的《甲状腺结节和分化型甲状腺癌诊治指南》建议对所有怀疑甲状腺癌的患者手术前、后进行颈部超声检查,以评估是否存在颈部淋巴结转移[4]。
灰阶超声特征
淋巴结部位 不同部位原发肿瘤的淋巴结转移区域具有一定的特异性。咽喉部、食道及甲状腺乳头状癌转移性淋巴结常沿颈静脉分布,即Ⅱ、Ⅲ、Ⅳ区;口腔恶性肿瘤常转移至下颌下区及颈静脉旁上组,即Ⅰ、Ⅱ区;锁骨下肿瘤如肺癌、乳腺癌常转移至锁骨上窝及后三角区,即锁骨上窝、Ⅴ区;鼻咽癌常转移至颈静脉旁上组及后三角区,即Ⅱ、Ⅴ区[5]。因此,肿大淋巴结的位置可初步提示原发肿瘤位置,对寻找原发病灶具有一定的意义。
淋巴结大小 研究表明淋巴结短径的差异较长径小[6-7],因此短径最能代表淋巴结大小。不同区域正常淋巴结的大小不同,Ⅱ区淋巴结大于其他区域,这可能与口腔反复炎症刺激引起的反应性增生或甲状腺癌患者放射性碘治疗有关[8]。van den Brekel等[9]研究发现,诊断不同区域转移性淋巴结的大小界值不同,Ⅱ区淋巴结诊断界值大于其他区域;且临床未触及转移灶 (N0期)的人群,诊断界值相对低。该研究指出,整个人群诊断转移性淋巴结的界值为8 mm(Ⅱ区为9 mm),N0期患者诊断界值为6 mm(Ⅱ区为7 mm)。一项对于N0期头颈部恶性肿瘤患者的研究指出,用10 mm作为界值诊断转移性淋巴结的特异度为92%,敏感度为63%[10]。
尽管许多研究致力于得出转移性淋巴结诊断准确度较高的界值,但不同研究得出的界值存在差异,这可能与研究对象、测量方法不同或超声测量的操作者差异有关。因此单独使用淋巴结大小诊断颈部转移性淋巴结并不可靠[5],系列随访更有价值:(1)已知恶性肿瘤患者随访过程中可疑淋巴结增大证实了转移;(2)对患者治疗反应的监测过程中,淋巴结的持续性减小是预后良好的指标。
淋巴结形态 正常淋巴结是长椭圆形,而转移性淋巴结倾向于圆形。这可能与癌细胞浸润开始于皮质,改变了淋巴结的结构有关。淋巴结的形态常用短径/长径 (S/L)评估。通常正常淋巴结的S/L<0.5,当S/L≥0.5时,应警惕转移性淋巴结的可能。有研究报道其预测淋巴结转移的敏感度可达95%[11],但由于淋巴瘤、结核性淋巴结炎也倾向于圆形,故特异性低[12]。同时诊断特异性还取决于淋巴结所处的位置,因为下颌下区及腮腺区正常淋巴结S/L可能≥0.5[8]。另一研究以0.55为界值,敏感度、特异度和准确度可分别达到92%、63%、80%,证实S/L是诊断淋巴结转移的较理想的指标[13]。
边界 正常淋巴结边界清晰,转移性淋巴结的边界可能清晰或不清晰。癌细胞浸润使结内细胞成分增多,脂肪成分减少,淋巴结与周围组织声阻抗差增大,边界清晰锐利[14-15]。因此,异常的淋巴结边界清晰时转移性可能性增加。对于已确诊的转移性淋巴结边界不清晰,常提示结外浸润。淋巴结的边界不能单独作为转移性淋巴结的判断指标。
淋巴结门 淋巴结门为输出淋巴管及供应血管进入淋巴结的部位,与周围结缔组织相连。短径大于5mm的正常淋巴结90%可见淋巴结门 (图1A),且随年龄增加其显示率更高,可能与年龄增加所致的脂肪沉积有关。淋巴结门消失或部分消失 (图1B、1C)提示转移性淋巴结的可能,原因是癌细胞的浸润取代了淋巴结门。淋巴结门消失诊断淋巴结转移的敏感度达88%[16],假阴性的产生原因是癌细胞浸润开始于皮质,早期的转移性淋巴结淋巴结门可以存在。Yuasa等[17]对口腔鳞状细胞癌患者458个淋巴结的研究发现,淋巴结门消失在良恶性淋巴结间存在交叉,故特异性较差。淋巴结门消失或部分消失不能单独作为诊断转移的指标。需要注意未显示淋巴结门并不意味着不存在门型血流,需应用彩色多普勒检测该淋巴结的血流类型[18]。
淋巴结回声
皮质回声水平:正常淋巴结与周围肌肉相比表现为低回声。多数转移性淋巴结也表现为低回声,因此低回声不能作为诊断转移性淋巴结的指标。

图1 淋巴结门声像图Fig 1 Images of hilus of different lymph nodes
皮质高回声:甲状腺乳头状癌的转移性淋巴结皮质内常出现高回声 (图2A),这可能与癌细胞产生的甲状腺球蛋白在淋巴结中沉积有关,该特征极少出现于良性淋巴结[16,19],因此皮质内出现高回声是诊断甲状腺乳头状癌转移性淋巴结较特异的指标。
坏死:转移性淋巴结内的癌细胞生长迅速,血供不足,出现坏死,分为液化性坏死及凝固性坏死[5]。液化性坏死更常见,超声表现为无回声,可表现为淋巴结内单发或多发无回声区 (图2B),也可为整个淋巴结都表现为囊性,此时应与颈部良性囊肿如鳃裂囊肿相鉴别。后者很少出现囊内分隔、囊内实性结节及囊壁厚的特点,而转移性淋巴结常会出现以上特征[20-21]。研究表明,6.2%的转移淋巴结可能表现为单纯的囊肿,常见于年轻患者[20],与良性无法鉴别,此时了解患者是否有原发肿瘤史或细针抽吸活检 (fine-needle aspiration biopsy,FNAB)有助于鉴别。液化性坏死对于诊断头颈部鳞状细胞癌及甲状腺乳头状癌的转移性淋巴结较特异[10,21-22]。有报道显示淋巴结囊性变是判断甲状腺乳头状癌最特异的指标,其特异性可达100%,敏感性为6.7%[21]。凝固性坏死少见,表现为皮质内局灶性高回声,不与周围脂肪组织相连且后方无声影。
钙化:钙化在转移性淋巴结的发生率不高,但常见于甲状腺乳头状癌及髓样癌[19]。超声表现为点状强回声 (图2C),多位于周边,与病理上的砂砾体相对应。有研究发现46%~69%的甲状腺乳头状癌转移性淋巴结可出现点状钙化[22]。点状钙化是诊断转移性淋巴结的较特异特征。
彩色多普勒超声特征
彩色多普勒血流显像 (color doppler flow imaging,CDFI)及彩色多普勒能量图 (color doppler energy,CDE)可用于评估淋巴结的血流,常用指标包括淋巴结血流模式及阻力指数。
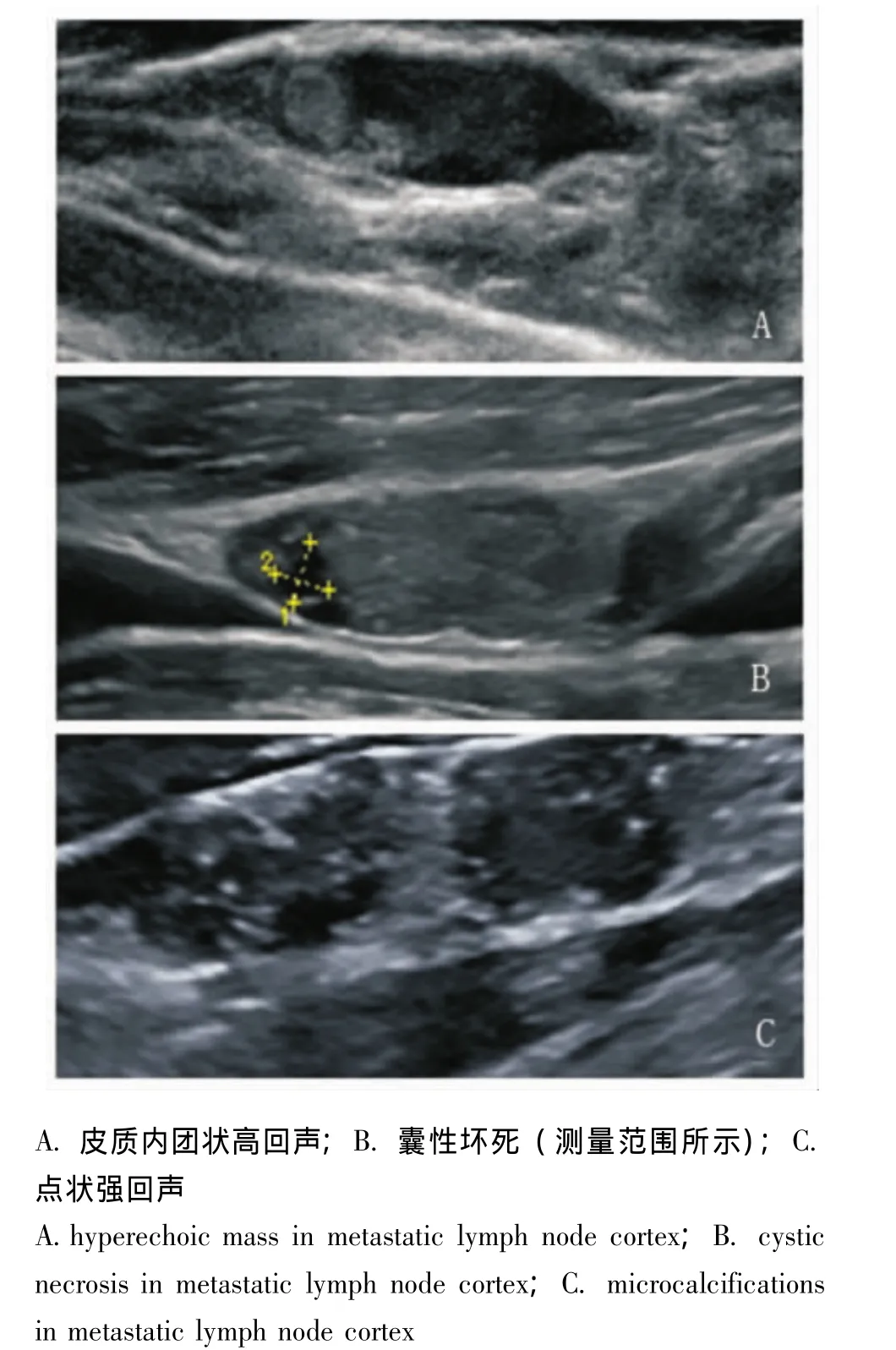
图2 转移淋巴结皮质回声特异性特征Fig 2 Specific signs of cortical echogenicity in metastatic lymph nodes
血流模式 CDE无角度依赖性且流速测量范围更大,因此对于低速血流的检测更敏感,可提高淋巴结内微血管的显示率,故淋巴结血流模式常用CDE探测。血流模式分为无血流型、门型血流、外周型血流及混合型血流[5,8,23]。无血流型即淋巴结内无彩色血流信号显示;门型血流即血流由淋巴结门进入,向皮质发出分支供血;外周型血流即血管由包膜下进入淋巴结发出分支供血;混合型血流即同时存在门型和外周型血流。
正常淋巴结表现为无血流或门型血流,90%短径大于5mm的正常淋巴结显示为门型血流[24]。转移早期,浸润皮质的癌细胞释放血管生成因子促进新生血管生成,外周血流增加,但淋巴结门尚未侵犯,因此门型血流同时存在,表现为混合型血流。随着癌细胞进一步浸润,淋巴结门被癌细胞取代,门型血流消失,表现为外周型血流。故转移性淋巴结表现为混合型血流或外周型血流[5,8]。局部血流的增加或血管扭曲增粗往往提示局部癌细胞的浸润。血流模式用于诊断淋巴结转移敏感度为86%,特异度为 82%[25]。
阻力指数 阻力指数 (resistance index,RI)目前尚无统一的多普勒设置,测量存在操作者差异,可重复性差。有研究报道转移淋巴结较反应性淋巴结RI高,也有研究得出相反结论或认为二者无统计学差异,且不同文献报道的诊断转移性淋巴结的RI界值不同[5],因此其诊断价值存在争议,应用受限。结合病史及淋巴结形态学特征,RI可作为诊断转移性淋巴结的辅助指标。
局限性 部分正常或转移性淋巴结不显示血流,多见于短径<5mm的淋巴结,此时无法靠血流模式及RI鉴别其良恶性。
超声造影
超声造影(contrast-enhanced ultrasonography,CEUS)是一种新的超声成像方式,静脉团注造影剂后,实时显示造影剂的运动、分布,了解感兴趣区域的血液灌注状态及血流动力学变化。多数研究证实,CEUS可增加肿瘤内血流的显示率,提高血流模式诊断的准确性[26-29],达 99%[28]。Schulte-Altedorneburg等[30]提出相反看法,认为CEUS虽然增加血流的显示率,但降低了诊断准确性。CEUS是否有助于转移性淋巴结诊断存在争议,仍需进一步研究。
Rubaltelli等[31]采用灌注模式判断淋巴结的良恶性,反应性淋巴结表现为均匀增强,转移性淋巴结表现为灌注缺损或无增强。国内研究也得到类似结论:良性淋巴结以均匀强化为主,造影剂主要分布在中央,向周围发散;转移性淋巴结以不均匀强化为主,造影剂主要分布在周边,走向紊乱[32](图3)。CEUS能够在灌注模式方面提供有用的信息,与常规超声结合使用可明显提高诊断的敏感度[33]。
有研究认为时间强度曲线在良恶性淋巴结之间存在差异,对鉴别诊断有一定的价值[34-35],但另一项研究认为转移性淋巴结与良性淋巴结时间强度曲线无统计学差异,不能用于诊断转移性淋巴结[36]。
弹性成像
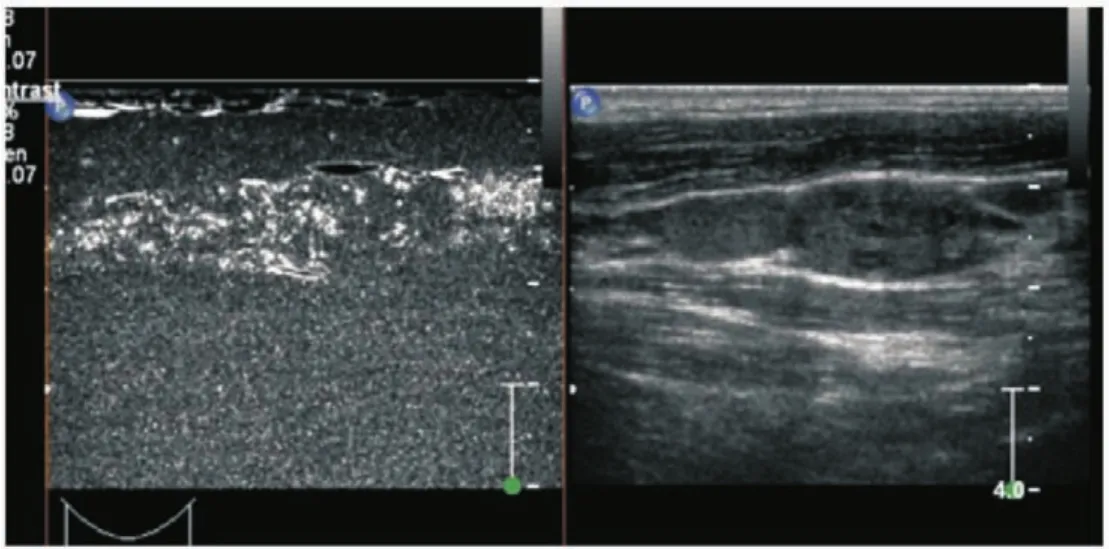
图3 转移性淋巴结的超声造影图像,示造影剂不均匀分布,以周边为主Fig 3 Contrast-enhanced ultrasonography of metastatic lymph node shows the distribution of contrast medium is nonuniform and peripheral mainly
弹性成像施加一个标准的外力后,通过检测组织的变形程度,反映组织的硬度。近年来发展迅速,虽然尚未广泛应用于临床,但研究证实在乳腺、甲状腺、前列腺等疾病的鉴别诊断中有重要意义,颈部肿大淋巴结的应用仍处于探索阶段。目前研究均支持转移性淋巴结较良性淋巴结弹性成像图像评分更高[37-39](图 4)。除 Lyshchik 等[37]采用脱机的弹性成像,余均采用实时弹性成像。目前多数研究表明弹性成像技术诊断转移性淋巴结的敏感度达83%~85%,特异度达98%~100%,准确度达89%~92%[37-38],明显优于常规超声各指标的诊断准确性,当与二维超声联合应用时准确度更高,可达93%[38]。Bhatia等[39]研究显示,弹性成像的敏感度为62%,特异度为84%,准确度为73%,远远低于其他研究,可能与弹性成像软件及其设置、操作者经验和入选病例差异有关。不同弹性成像软件或操作者间差异对诊断结果的影响有待进一步研究,应用于临床仍需进一步标准化。
弹性成像技术可以提高颈部转移性淋巴结诊断的准确性,尤其对于较小或早期转移性淋巴结,常规超声检查未发现恶性征象时采用弹性成像技术更有意义,但目前尚无较小淋巴结弹性成像的文献报道。也可用于选择待穿刺的淋巴结,增加FNAB的阳性率。弹性成像是一种准确度高、无创的技术,其在颈部转移性淋巴结的诊断中具有良好的应用前景。
超声引导下细针抽吸活检
大多数转移淋巴结有特征性声像图表现,但由于肿瘤微转移的存在,且良恶性淋巴结的特征存在交叉,因此当声像图不典型、常规超声鉴别困难时,可以行超声引导下细针抽吸活检 (ultrasound guided fine needle aspiration biopsy,US-FNAB)。应选择超声特征最可疑的淋巴结进行穿刺。US-FNAB既可以全程监视针头,避免重要神经组织及血管的损伤,同时有利于选择超声特征可疑部位,提高穿刺的阳性率。目前文献报道US-FNAB敏感度可达95.4%,特异度可达92.3%[40]。因此,可广泛应用于可疑恶性淋巴结的鉴别诊断。
将穿刺标本涂片进行细胞学诊断,当细胞学诊断不明确时,可对穿刺液进行其他化学检查。若怀疑甲状腺癌,可检测甲状腺球蛋白,甲状腺球蛋白升高提示甲状腺乳头状癌转移[8,22]。鳞状细胞癌颈部转移性淋巴结的穿刺标本免疫细胞化学检测有助于判断其对放化疗的敏感性[41]。
比较所有技术,超声联合FNAB的准确性最高[42],可为肿大淋巴结提供更准确的诊断,对其他技术漏诊的较小淋巴结也具有诊断价值。无论是否行CT、MRI,超声引导下FNA对于多数头颈部恶性肿瘤患者都是必要的[43]。
应用单一指标诊断淋巴结的良恶性往往特异性或敏感性不高,因此应将其形态学及血流灌注特征综合分析,判断淋巴结是否为转移性。结合超声造影、弹性成像及FNA等新技术,诊断准确性进一步提高。由于转移性淋巴结的多数特征与反应性淋巴结、淋巴瘤、结核性淋巴结炎、异位胸腺等存在交叉现象,其鉴别诊断尤为重要。因此超声医师应结合病史、临床特点综合分析各淋巴结特征得出正确诊断。超声结合US-FNA准确性高于其他影像学手段,已成为评估颈部肿大淋巴结的首选方法。
超声对于转移性淋巴结的评估具有重要意义,同时有一定的局限性。首先超声具有操作者依赖性,操作者经验不足可能会导致淋巴结的漏诊;气管前、气管旁、胸骨后淋巴结由于浅表组织的遮挡容易被漏诊;同时早期转移性淋巴结的结构及声像学特征不典型,会导致漏诊。尤其某些超声征象在良性及转移性淋巴结之间有交叉,因此淋巴结鉴别困难时,应结合CT、MRI、PET/CT等其他影像学手段。
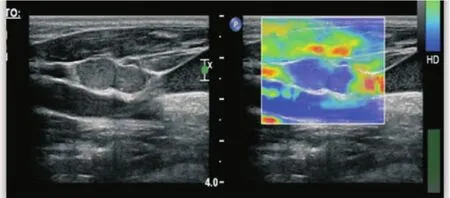
图4 转移性淋巴结的弹性成像,示淋巴结呈蓝色为主,质地硬Fig 4 Elastosongraphy of metastatic lymph node shows the lymph node is mainly blue,indicting hard in texture
[1]Schlumberger MJ.Papillary and follicular thyroid carcinoma[J].N Engl J Med,1998,338(5):297-306.
[2]Ito Y,Tomoda C,Uruno T,et al.Ultrasonographically and anatomopathologically detectable node metastases in the lateral compartment as indicators of worse relapse-free survival in patients with papillary thyroid carcinoma [J].World J Surg,2005,29(7):917-920.
[3]Esen G.Ultrasound of superficial lymph nodes [J].Eur J Radiol,2006,58(3):345-359.
[4]姜玉新,张波.甲状腺结节的超声诊断及治疗 [J].协和医学杂志,2010(1):34-39.
[5]Ahuja AT,Ying M,Ho SY,et al.Ultrasound of malignant cervical lymph nodes[J].Cancer Imaging,2008,8(1):48-56.
[6]Ying M,Ahuja A.Sonography of neck lymph nodes.Part I:normal lymph nodes [J].Clin Radiol,2003,58(5):351-358.
[7]Bruneton JN,Balu-Maestro C,Marcy PY,et al.Very high frequency(13 MHz)ultrasonographic examination of the normal neck:detection of normal lymph nodes and thyroid nodules[J].J Ultrasound Med,1994,13(2):87-90.
[8]Fish SA,Langer JE,Mandel SJ.Sonographic imaging of thyroid nodules and cervical lymph nodes [J].Endocrinol Metab Clin North Am,2008,37(2):401-417.
[9]van den Brekel MW,Castelijns JA,Snow GB.The size of lymph nodes in the neck on sonograms as a radiologic criterion for metastasis:how reliable is it[J].AJNR Am J Neuroradiol,1998,19(4):695-700.
[10]Richards PS,Peacock TE.The role of ultrasound in the detection of cervical lymph node metastases in clinically N0 squamous cell carcinoma of the head and neck [J].Cancer Imaging,2007,7(1):167-178.
[11]Steinkamp HJ,Cornehl M,Hosten N,et al.Cervical lymphadenopathy:ratio of long-to short-axis diameter as a predictor of malignancy [J].Br J Radiol,1995,68(807):266-270.
[12]Ahuja A,Ying M.An overview of neck node sonography[J].Invest Radiol,2002,37(6):333-342.
[13]Takashima S,Sone S,Nomura N,et al.Nonpalpable lymph nodes of the neck:assessment with US and US-guided fineneedle aspiration biopsy [J].J Clin Ultrasound,1997,25(6):283-292.
[14]Shozushima M,Suzuki M,Nakasima T,et al.Ultrasound diagnosis of lymph node metastasis in head and neck cancer[J].Dentomaxillofac Radiol,1990,19(4):165-170.
[15]李鹏,蔡胜,姜玉新.超声对良、恶性浅表淋巴结病变的鉴别诊断及其进展[J].中国医学影像技术,2007,23(9):1409-1412.
[16]Rosario PW,de Faria S,Bicalho L,et al.Ultrasonographic differentiation between metastatic and benign lymph nodes in patients with papillary thyroid carcinoma [J].J Ultrasound Med,2005,24(10):1385-1389.
[17]Yuasa K,Kawazu T,Nagata T,et al.Computed tomography and ultrasonography of metastatic cervical lymph nodes in oral squamous cell carcinoma [J].Dentomaxillofac Radiol,2000,29(4):238-244.
[18]Ahuja A,Ying M,King A,et al.Lymph node hilus:gray scale and power Doppler sonography of cervical nodes[J].J Ultrasound Med,2001,20(9):987-992,994.
[19]Ahuja A,Ying M.Sonography of neck lymph nodes.PartⅡ:abnormal lymph nodes [J].Clin Radiol,2003,58(5):359-366.
[20]Wunderbaldinger P,Harisinghani MG,Hahn PF,et al.Cystic lymph node metastases in papillary thyroid carcinoma[J].AJR Am J Roentgenol,2002,178(3):693-697.
[21]Miseikyte-Kaubriene E,Trakymas M,Ulys A.Cystic lymph node metastasis in papillary thyroid carcinoma [J].Medicina(Kaunas),2008,44(6):455-459.
[22]Langer JE,Mandel SJ.Sonographic imaging of cervical lymph nodes in patients with thyroid cancer[J].Neuroimaging Clin N Am,2008,18(3):479-489.
[23]李丹,韩绍光,张速敏,等.高频彩色多普勒超声多因素分析预测颈部浅表淋巴结病变性质[J].临床超声医学杂志,2004,6(6):331-334.
[24]Wu CH,Chang YL,Hsu WC,et al.Usefulness of Doppler spectral analysis and power Doppler sonography in the differentiation of cervical lymphadenopathies[J].AJR Am J Roentgenol,1998,171(2):503-509.
[25]Cooper DS,Doherty GM,Haugen BR,et al.Revised A-merican Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J].Thyroid,2009,19(11):1167-1214.
[26]Giovagnorio F.Color Doppler sonography for differential diagnosis of enlarged cervical lymph nodes [J].AJR Am J Roentgenol,2000,175(6):p1749.
[27]Yang WT,Metreweli C,Lam PK,et al.Benign and malignant breast masses and axillary nodes:evaluation with echoenhanced color power Doppler US [J].Radiology,2001,220(3):795-802.
[28]Moritz JD,Ludwig A,Oestmann JW.Contrast-enhanced color Doppler sonography for evaluation of enlarged cervical lymph nodes in head and neck tumors [J].AJR Am J Ro-entgenol,2000,174(5):1279-1284.
[29]Rickert D,Jecker P,Metzler V,et al.Color-coded duplex sonography of the cervical lymph nodes:improved differential diagnostic assessment after administration of the signal enhancer SH U 508A(Levovist)[J].Eur Arch Otorhinolaryngol,2000,257(8):453-458.
[30]Schulte-Altedorneburg G,Demharter J,Linne R,et al.Does ultrasound contrast agent improve the diagnostic value of colour and power Doppler sonography in superficial lymph node enlargement[J].Eur J Radiol,2003,48(3):252-257.
[31]Rubaltelli L,Khadivi Y,Tregnaghi A,et al.Evaluation of lymph node perfusion using continuous mode harmonic ultrasonography with a second-generation contrast agent[J].J Ultrasound Med,2004,23(6):829-836.
[32]罗慧,石秋玲,吴瑛,等.淋巴结超声造影的初步探讨[J]. 广东医学,2010,31(5):582-583.
[33]冀鸿涛,朱强,荣雪余,等.超声造影在头颈部淋巴结良恶性病变鉴别诊断中的应用[J].中华医学超声杂志(电子版),2011,8(7):77-81.
[34]刘青,于铭,苏海砾,等.超声造影在浅表淋巴结定性诊断中的临床价值 [J].中华超声影像学杂志,2009,18(2):142-145.
[35]洪玉蓉,刘学明,张闻,等.超声造影定量分析在浅表淋巴结疾病鉴别诊断中的应用[J].中国超声医学杂志,2007,23(3):212-214.
[36]韩峰,邹如海,林僖,等.常规超声和超声造影在浅表淋巴结良恶性鉴别诊断中的价值[J].中华超声影像学杂志,2010,19(3):234-237.
[37]Lyshchik A,Higashi T,Asato R,et al.Cervical lymph node metastases:diagnosis at sonoelastography-initial experience [J].Radiology,2007,243(1):258-267.
[38]Alam F,Naito K,Horiguchi J,et al.Accuracy of sonographic elastography in the differential diagnosis of enlarged cervical lymph nodes:comparison with conventional B-mode sonography [J].AJR Am J Roentgenol,2008,191(2):604-610.
[39]Bhatia KS,Cho CC,Yuen YH,et al.Real-time qualitative ultrasound elastography of cervical lymph nodes in routine clinical practice:interobserver agreement and correlation with malignancy [J].Ultrasound Med Biol,2010,36(12):1990-1997.
[40]Gupta A,Rahman K,Shahid M,et al.Sonographic assessment of cervical lymphadenopathy:role of high-resolution and color Doppler imaging[J].Head Neck,2011,33(3):297-302.
[41]Flezar MS,Kirbis IS,Popovic KS,et al.Radiosensitivity of squamous cell carcinoma metastases to the neck assessed by immunocytochemical profiling of fine-needle aspiration biopsy cell specimens:a pilot study [J].Radiother Oncol,2009,93(3):575-580.
[42]Van den Brekel MW,Castelijns JA,Stel HV,et al.Modern imaging techniques and ultrasound-guided aspiration cytology for the assessment of neck node metastases:a prospective comparative study [J].Eur Arch Otorhinolaryngol,1993,250(1):11-17.
[43]Atula TS,Varpula MJ,Kurki TJ,et al.Assessment of cervical lymph node status in head and neck cancer patients:palpation,computed tomography and low field magnetic resonance imaging compared with ultrasound-guided fine-needle aspiration cytology [J].Eur J Radiol,1997,25(2):152-161.



