晏佩佩,潘晓燕,王红荷,李质馨,王雪楠,赖 勤,宋文静,赵华一,窦肇华
1吉林医药学院组织学与胚胎学教研室,吉林132013
2济宁医学院附属医院生殖医学中心,山东济宁272029
双酚A(bisphenol-A,BPA)是世界上使用最广泛的工业化合物之一,主要用于生产环氧树脂、聚砜树脂、聚苯醚树脂、不饱和聚酯树脂等多种高分子材料。在日常生活中,从矿泉水瓶、医疗器械、食品包装的内里、罐头内包装、婴儿用瓶、牙科填充剂以及其他数百种日用品中都含有BPA[1]。BPA单体分子之间会发生聚合,以酯键结合在一起。当这些聚合物在高温下或与碱性/酸性物质放在一起时,就会破坏BPA分子之间的酯键,使之发生断裂,游离出BPA分子的单体。2003至2004年,美国健康和营养调查协会对6岁以上的不同年龄和性别的2 517名调查者进行了尿样检测,结果在92%以上人的尿样中检测到BPA,调查显示由于工作原因接触高浓度BPA的工人会出现男性性行为异常[2]。孕妇的胎盘[3]、脐带血[4]和羊水[5]中也检测到不同浓度的BPA。研究显示妊娠期的动物接触一定浓度的BPA,会显着影响后代生殖器官的发育和机体自身的代谢功能[6],胎儿或新生儿对接触的BPA比成人更加敏感[7]。
BPA结构类似于雌二醇和己烯雌酚,具有弱的雌激素活性,其在机体中发挥作用的方式与雌激素相似,主要通过与靶细胞上的雌激素受体结合调控细胞的功能。研究显示BPA会影响到围产期和植入期子宫的发育。Xiao等[8]对怀孕0.5~3.5 d的小鼠皮下注射100 mg/(kg·d)BPA,在怀孕4.5 d的子宫上未发现着床点,若将健康正常的胚胎移植到同剂量BPA处理的小鼠子宫,在4.5 d也未发现着床点,表明BPA改变了植入期子宫内膜对胚胎的容受性。植入过程需要胚胎和子宫内膜的同步发育,BPA影响了植入期子宫内膜对胚胎的容受性,那么BPA是否也影响了植入前囊胚的发育,使囊胚失去了侵入子宫内膜的能力,这方面的研究还较少。人们通过不同的给药途径发现BPA影响胚胎植入的浓度水平存在一定的争议[8-9],考虑到BPA进入人体的主要途径是口服,因此本研究对孕鼠灌服不同浓度的BPA,以探讨BPA对囊胚发育和囊胚植入的影响。
材料和方法
实验动物 实验用昆明种小白鼠90只,雌鼠体重30~35 g,雄鼠体重40~45 g,均购自长春高新技术实验动物中心。饲养条件为温度 (20±3)℃,湿度(50±10)%,自由摄食和饮水,室内照明采用14∶10 h明暗交替。雄鼠均单笼饲养。
动物分组与处理 昆明小白鼠适应性饲养1周后,以雌雄1∶1合笼,次日晨检查雌鼠阴道栓,发现阴道栓定为妊娠第0.5天。对妊娠鼠进行完全随机化分组,分为100、300、600 mg/(kg·d)BPA组和对照组,将BPA处理组的孕鼠从妊娠的0.5~3.5 d,每天下午4∶00分别灌服100、300和600 mg/kg剂量的BPA(Sigma-Aldrich公司),对照组灌服等量的豆油,连续灌服4 d。每组共做30只孕鼠。
着床点染色 妊娠第4.5天,利用水合氯醛对孕鼠进行麻醉,然后对麻醉好的孕鼠尾静脉注射0.5%滂胺天蓝 (Sigma-Aldrich公司)染液0.2 ml,待孕鼠口唇、眼睛变蓝后,颈椎脱臼处死孕鼠,取出子宫,观察子宫角上的蓝染点,统计着床点数和着床率。着床率=有着床点的小鼠数/受精的小鼠数×100%。对于未染出着床点的见栓小鼠,PBS冲洗子宫角,发现胚胎的小鼠是受精的小鼠,未发现胚胎的小鼠则未发生受精。每组共做20只孕鼠。
获取孕鼠的体内胚胎 在妊娠的第4天,用PBS冲洗孕鼠的子宫角,获取孕鼠体内胚胎,观察胚胎的发育情况,统计囊胚发育率和孵化率。囊胚率=囊胚数/总的胚胎数×100%;孵化率=孵化囊胚数/囊胚数×100%。将收集到的孵化囊胚用Hoechst 33342对细胞核进行染色,以统计孵化囊胚的总细胞数。每组共做10只孕鼠。
囊胚的免疫荧光染色 孵化囊胚在4%的多聚甲醛溶液中固定40 min,然后在0.1%Triton X-100的PBS溶液中作用15 min。将固定好的胚胎在活化型含半胱氨酸的天冬氨酸蛋白水解酶3的一抗 (Abcam公司)(1∶400稀释)中孵育2 h,PBS充分洗涤后,用异硫氰酸荧光素标记的二抗 (Invitrogen公司)(1∶400稀释)作用1 h。利用1 μmol/L Hoechst 33342(Sigma-Aldrich公司)对囊胚卵裂球的细胞核DNA进行染色,胚胎封片,激光扫描共聚焦显微镜观察,所有的图片均在相同强度的激光照射下拍摄。
统计学处理 采用SPSS 13.0对数据进行单因素方差分析 (One-Way ANOVA),P<0.05为差异有统计学意义。
结 果
BPA对胚胎植入的影响 600 mg/(kg·d)BPA处理的孕鼠未观察到着床点,但在子宫中冲出了胚胎,即高浓度的BPA抑制了胚胎的着床 (图1)。300 mg/(kg·d)的BPA显着降低了孕鼠的着床点数,且在300 mg/(kg·d)的BPA处理的12只孕鼠中,有6只未观察到着床点。100 mg/(kg·d)BPA处理的16只孕鼠全都观察到了着床点,且着床点数与对照组比较差异无统计学意义 (表1)。
BPA对第4天孕鼠子宫中囊胚发育和孵化的影响 BPA处理未影响囊胚的发育率 (表2),但300和600 mg/(kg·d)BPA组囊胚的孵化率较对照组显着降低 (P<0.05)(表2),能明显地观察到胚胎细胞外周完整的透明带 (图2)。高浓度的BPA影响了囊胚在子宫中的孵化。
BPA对囊胚孵化质量的影响 对照组和不同浓度BPA处理组中孵化囊胚的总细胞数差异无统计学意义(表3),但300和600 mg/(kg·d)BPA组孵化囊胚中含半胱氨酸的天冬氨酸蛋白水解酶3的阳性细胞数较对照组显着增加 (图3)。

表1 第4.5天孕鼠的着床点数和着床率Table 1 The number of implantation sites and the rate of implantation of mice on day 4.5 of pregnancy
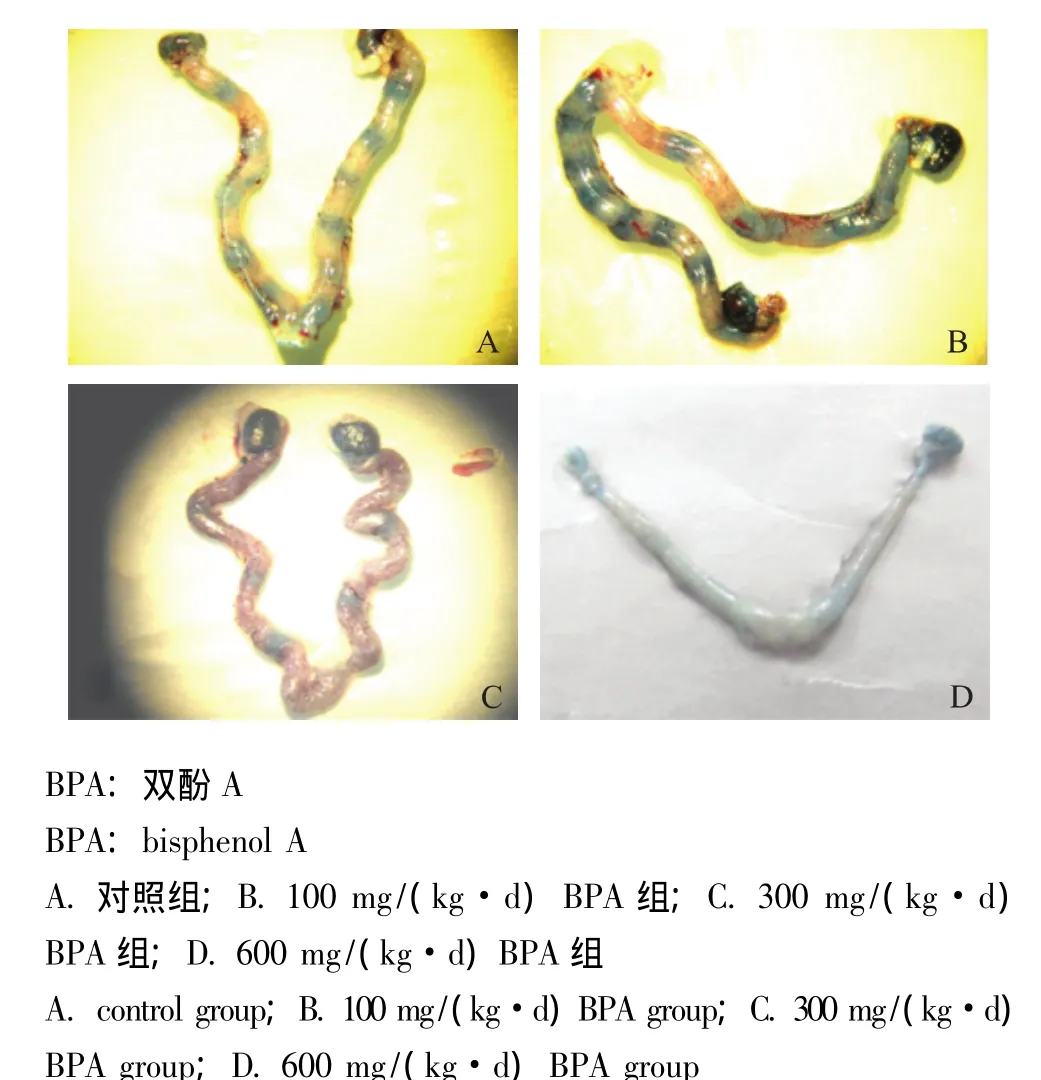
图1 第4.5天孕鼠的着床点染色 (滂胺天蓝染色,×40)Fig 1 Staining of the implantation sites of mice on day 4.5 of pregnancy(pontamine sky blue staining, ×40)
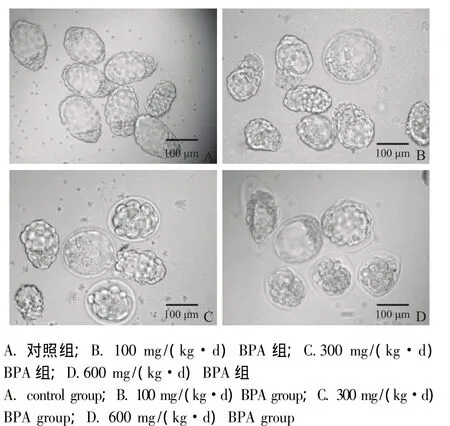
图2 第4天孕鼠子宫中的胚胎Fig 2 Embryos from the uteri of mice on day 4 of pregnancy

表2 第4天孕鼠子宫中囊胚发育率和孵化率Table 2 Blastocyst development rate and hatching rate on day 4 of pregnancy
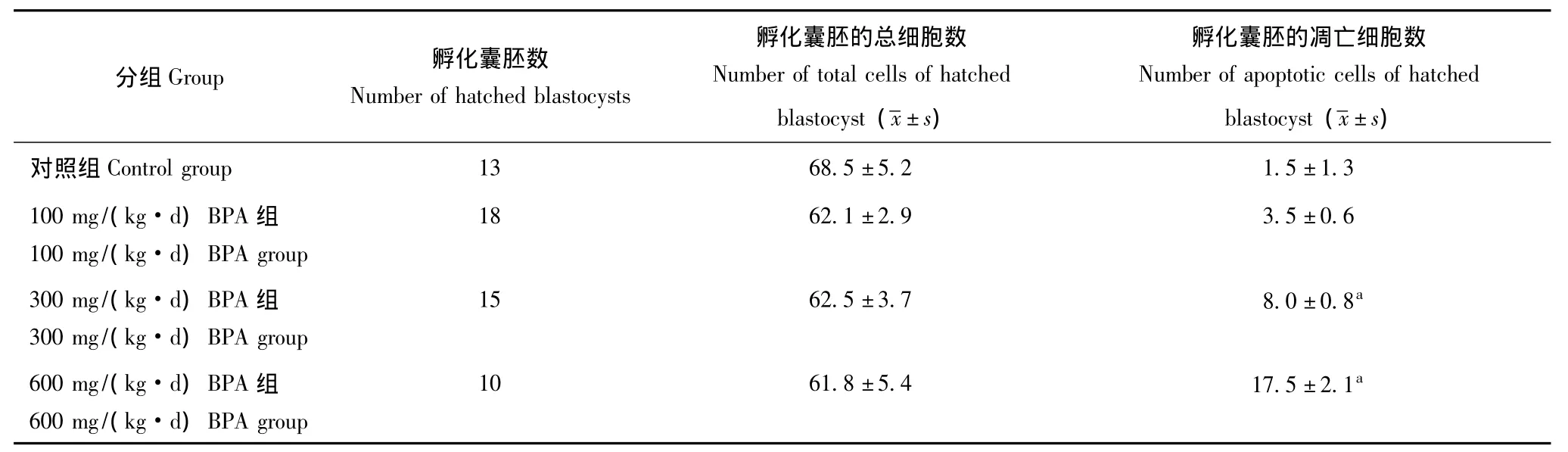
表3 第4天孵化囊胚的总细胞数和凋亡细胞数 (n)Table 3 Numbers of total cells and apoptotic cells of hatched blastocysts on day 4 of pregnancy(n)
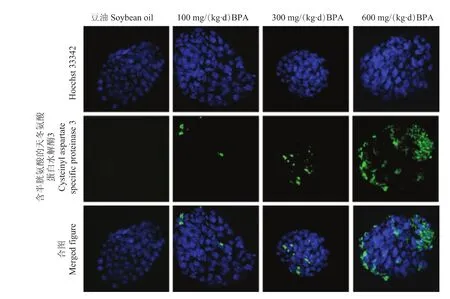
图3 孵化囊胚凋亡细胞的免疫荧光染色 (×800)Fig 3 Staining of the apoptotic cells of hatched blastocysts with the immunofluorescence technique(×800)
讨 论
考虑到BPA可能对人体产生的不良影响,美国食品与药品监督管理局规定人类每天BPA的摄入耐受剂量为50 μg/(kg·d)。但动物实验显示在这样的浓度下对机体会产生显着的不良影响[7],尤其是胎儿和新生儿对BPA的接触比成年动物更加敏感。另外,由于个人生活习惯的不同,对塑料制品的加热或反复使用,也会提高人体接触BPA的浓度。目前,人们对于日常接触到的BPA是否会对人体产生不良影响,会产生怎样的不良影响正在研究中。
本研究探讨孕鼠在胚胎着床时期接触BPA可能会对囊胚发育和植入产生的不良影响。结果显示高浓度的BPA显着影响了囊胚的孵化,降低了囊胚的孵化质量,以致囊胚的植入被抑制。有研究表明由于给药途径和给药时间的不同,BPA影响胚胎植入的浓度范围存在一定的差异[10]。本研究模拟人接触BPA最广泛的途径,对目前广泛使用的昆明种小鼠从妊娠后的0.5~3.5 d灌服不同浓度的BPA,结果显示300 mg/(kg·d)BPA影响了胚胎植入,600 mg/(kg·d)BPA处理的孕鼠未观察到着床点,抑制了胚胎的植入。而Xiao等[8]的研究表明皮下注射100 mg/(kg·d)BPA抑制了胚胎的植入,表明皮下注射的给药途径比经口服消化后对胚胎着床的影响更敏感,但人类接触BPA最广泛的途径是通过与一些食品包装的内里反复接触,经口服消化后产生的影响,因此本研究更能模拟人类接触BPA产生的不良影响。不仅给药途径会影响机体对BPA的敏感性,不同妊娠时间给药也会产生不同的效果。Berger等[11]研究显示在妊娠的第 0.5天或第1.5天对孕鼠皮下注射10.125 mg BPA显着降低了着床点数,而在妊娠的第2.5天注射相同剂量的BPA对胚胎的着床点数无影响,表明孕鼠妊娠后的0.5~1.5 d对内分泌干扰剂比妊娠后2.5 d更加敏感。
BPA可通过干扰植入期子宫内雌激素受体和孕激素受体的表达,影响子宫内膜上皮细胞、子宫腺上皮细胞和子宫内膜基质细胞中与胚胎植入相关基因的表达和蛋白的分泌[12],进而使子宫失去了接受胚胎植入的能力,导致植入失败。植入前胚胎的发育是一个受激素调控的发育过程,具有类雌激素作用的BPA是否会影响植入前体内胚胎的发育,这方面的研究较少。Takai等[13]在小鼠2-细胞胚胎的体外培养液中添加了100 μmol/L的BPA,培养48 h后显着提高了胚胎的退化率。Lee等[14]将小鼠2-细胞胚胎在添加了不同浓度BPA的培养液中培养72 h,结果显示随着BPA浓度的升高显着降低了小鼠囊胚的发育率,10-4mol/L的BPA抑制了囊胚的发育,无胚胎发育到囊胚。从胚胎的体外实验可以看出,BPA对植入前胚胎的发育会产生不良的影响。体内胚胎与体外胚胎所处的生长发育的环境不同,植入前的胚胎处于子宫的内环境中,受子宫内环境中不同类型细胞的影响,子宫的内环境是否会减轻BPA对体内胚胎发育的影响尚不清楚。Lee等[14]将小鼠2-细胞胚胎与子宫内膜上皮细胞共培养可显着减轻BPA对胚胎发育的毒性作用,提高胚胎的体外发育率,表明子宫内膜上皮细胞分泌的一些细胞因子可能对胚胎的发育具有保护作用。本研究观察了BPA处理对孕鼠体内囊胚的发育情况,结果显示BPA对体内囊胚发育的影响具有一定的浓度依赖性,300和600 mg/(kg·d)BPA显着降低了囊胚的孵化率,而100 mg/(kg·d)BPA对囊胚发育率和孵化率无影响,表明子宫内环境对胚胎发育的保护作用有一定范围,如果干扰剂的浓度超过了这一范围,即会对胚胎的体内发育产生不良影响。
本研究比较了各组中孵化囊胚的总细胞数和凋亡细胞数,结果显示各组中孵化囊胚的总细胞数差异无统计学意义,但300和600 mg/(kg·d)BPA组孵化囊胚中含半胱氨酸的天冬氨酸蛋白水解酶3阳性的细胞数较对照组显着增加,高浓度的BPA影响了孵化囊胚的质量。Jin等[15]对成年大鼠连续14 d口服2 μg/kg的BPA,显着提高了睾丸生精细胞中凋亡细胞的数量,Fas、FasL和含半胱氨酸的天冬氨酸蛋白水解酶3 mRNA水平也较对照组显着升高,表明BPA可促进生殖细胞的凋亡。Tsutsui等[16]研究显示BPA可与金黄地鼠胚胎细胞中的DNA形成DNA加合物,导致细胞染色体异倍性的发生。Pfeiffer等[17]用BPA处理V79细胞,未发现BPA诱导DNA断裂。本研究通过Hoechst 33342对孵化囊胚的细胞核进行染色,也未发现DNA断裂,BPA诱导了活化型含半胱氨酸的天冬氨酸蛋白水解酶3蛋白的表达,使得表达活化型含半胱氨酸的天冬氨酸蛋白水解酶3蛋白的细胞数显着增加,含半胱氨酸的天冬氨酸蛋白水解酶3蛋白作为细胞凋亡的执行者会诱导细胞的凋亡,影响囊胚向子宫内膜侵入。
综上,高浓度BPA损伤了植入前囊胚的发育,提高了孵化囊胚中凋亡细胞的数量,影响了胚胎侵入子宫内膜能力的获得,进而抑制了胚胎的植入。进一步的研究是找出BPA在囊胚中直接或间接作用的靶分子,阐明这些靶分子对囊胚发育的影响以及BPA对这些靶分子的调控作用。
[1] 晏佩佩,潘晓燕,王雪楠,等.双酚A对雌性生殖器官的影响及作用机制 [J].中国医学科学院学报,2013,35(6):683-688.
[2] Li D,Zhou Z,Qing D,et al.Occupational exposure to bisphenol-A(BPA)and the risk of self-reported male sexual dysfunction [J].Hum Reprod,2010,25(2):519-527.
[3] Schonfelder G,Wittfoht W,Hopp H,et al.Parent bisphenol A accumulation in the human maternal-fetal-placental unit[J].Environ Health Perspect,2002,110(11):A703-A707.
[4] Wan Y,Choi K,Kim S,et al.Hydroxylated polybrominated diphenyl ethers and bisphenol a in pregnant women and their matching fetuses:placental transfer and potential risks[J].Environ Sci Technol,2010,44(13):5233-5239.
[5] Yamada H,Furuta I,Kato EH,et al.Maternal serum and amniotic fluid bisphenol A concentrations in the early second trimester[J].Reprod Toxicol,2002,16(6):735-739.
[6] Suzuki A,Sugihara A,Uchida K,et al.Developmental effects of perinatal exposure to bisphenol-A and diethylstilbestrol on reproductive organs in female mice [J].Reprod Toxicol,2002,16(2):107-116.
[7] Alonso-Magdalena P,Vieira E,Soriano SA,et al.Bisphenol a exposure during pregnancy disrupts glucose homeostasis in mothers and adult male offspring[J].Environ Health Perspect,2010,118(9):1243-1250.
[8] Xiao S,Diao H,Smith MA,et al.Preimplantation exposure to bisphenol A(BPA)affects embryo transport,preimplantation embryo development,and utetine receptivity in mice[J].Reprod Toxicol,2011,32(4):434-441.
[9] Andersen HR,Andersson AM,Arnold SF,et al.Comparison of short-term estrogenicity tests for identification of hormone-disrupting chemicals [J].Environ Health Perspect,1999,107(Suppl 1):89-108.
[10] Berger RG,Hancock T,deCatanzaro D.Influence of oral and subcutaneous bisphenol-A on intrauterine implantation of fertilized ova in inseminated female mice[J].Reprod Toxicol,2007,23(2):138-144.
[11] Berger RG,Shaw J,decatanzaro D.Impact of acute bisphenol-A exposure upon intrauterine implantation of fertilized ova and urinary levels of progesterone and 17 beta-estradiol[J].Reprod Toxicol,2008,26(2):94-99.
[12] Varayoud J,Ramos JG,Bosquiazzo VL,et al.Neonatal exposure to bisphenol A alters rat uterine implantation-associated gene expression and reduces the number of implantation sites[J].Endocrinology,2011,152(3):1101-1111.
[13] Takai Y,Tsutsumi O,Ikezuki Y,et al.Preimplantation exposure to bisphenol A advances postnatal development[J].Reprod Toxicol,2001,15(1):71-74.
[14] Lee MS,Lee YS,Lee HH,et al.Human endometrial cell coculture reduces the endocrine disruptor toxicity on mouse embryo development[J].J Occup Med Toxicol,2012,7(1):7.
[15] Jin P,Wang X,Chang F,et al.Low dose bisphenol A impairs spermatogenesis by suppressing reproductive hormone production and promoting germ cell apoptosis in adult rats[J].J Biomed Res,2013,27(2):135-144.
[16] Tsutsui T,Tamura Y,Yagi E,et al.Bisphenol-A induces cellular transformation,aneuploidy and DNA adduct formation in cultured syrian hamster embryo cells[J].Int J Cancer,1998,75(2):290-294.
[17] Pfeiffer E,Rosenberg B,Deuschel S,et al.Interference with microtubules and induction of micronuclei in vitro by various bisphenols[J].Mutat Res,1997,390(1-2):21-31.



