田 艳,鲁 瑶,赵玉珍,史艳芬,郑 敏,李建初
1中国医学科学院 北京协和医学院 北京协和医院超声医学科,北京 100730 中日友好医院 2乳腺甲状腺外科 3超声科 4病理科,北京 100029
近年来,国内外甲状腺结节和甲状腺癌的发病率均明显增加,且发病年龄呈现年轻化趋势[1- 2]。甲状腺乳头状癌是甲状腺癌中最常见的类型,约占甲状腺癌的85%,其主要治疗手段是外科手术。如果甲状腺乳头状癌能够早期发现并及时治疗,可以获得较高的生存率,因此准确的术前诊断具有重要意义。多部指南肯定了灰阶超声对甲状腺癌的诊断价值[3],其中声像图上微钙化被认为与甲状腺乳头状癌高度相关,具有较高的特异性[4]。目前临床用于甲状腺检查的超声探头频率一般小于17 MHz,目前尚未见应用17 MHz高频超声对甲状腺乳头状癌微钙化的研究报道。本研究探讨了17 MHz高频超声检查甲状腺乳头状癌微钙化的超声表现及其病理基础。
资料和方法
资料来源2016年1月至2017年1月在中日友好医院就诊的经超声检查和手术病理证实为甲状腺乳头状癌的患者。排除标准:(1)结节后缘距体表距离≥2.6 cm的甲状腺结节(因为当甲状腺结节后缘距体表距离≥2.6 cm时,使用17 MHz高频探头会导致结节超声图像不清晰);(2)内部存在粗大钙化的甲状腺结节(因粗大钙化在病理标本制作时一般会进行脱钙处理)。本研究经中日友好医院伦理委员会批准,所有患者均豁免知情同意。
超声检查方法采用德国西门子SIEMENS ACUSON3000型彩色多普勒超声诊断仪(西门子医疗系统公司,美国),9L4(4.0~9.0 MHz)线阵探头和18L6 HD(7.0~17.0 MHz)线阵探头,选择仪器预设的甲状腺条件。9L4探头即目前普遍应用的常规高频探头。具体为:患者取仰卧位,头部后仰充分暴露颈前区。先后依次采用常规高频超声探头和17 MHz高频超声探头对甲状腺结节进行观察,记录结节的部位、大小、边界、内部回声、后方回声等信息,并着重观察结节内是否存在微钙化,留存结节纵、横切面图像及动态图像。
结节灰阶超声特征的描述及分析方法如下:(1)结节深度:扫查结节整体情况后,于横断面选取结节最大直径处,测量结节后缘距体表的深度。(2)部位:甲状腺左叶、右叶、峡部,左右叶分别又分为上、中、下3个区域。(3)大小:测量结节上下径、左右径、前后径共3个径线。以结节最大径线1.0 cm为界点,≤1.0 cm为微小癌[5],>1.0 cm 为非微小癌。(4)形态:分为规则与不规则,形态规则指椭圆形及类圆形,形态不规则包括分叶形、边缘成角等其他形状。(5)边界:指结节与周围腺体的连接面,分为清晰、不清晰。(6)结节内部回声:高回声、等回声、低回声、极低回声。高回声指高于甲状腺实质回声;等回声指与甲状腺实质回声水平相同;低回声指低于甲状腺实质回声但不低于颈前肌肉回声;极低回声指低于颈前肌肉回声。(7)钙化:本研究将最大径≤0.2 cm的点状强回声称为微钙化,直径>0.2 cm的强回声称为粗大钙化[6- 7]。
组织病理学检查方法选取施行一侧或双侧叶切除后的甲状腺标本,标本由外科大夫标记出头侧。病理纵切取材,手术后组织标本用10%甲醛溶液固定,切片为 4 μm厚,经HE染色,病理切片制备后单独留存。由1位5年以上工作经验的病理医师在显微镜下观察,对病灶病理切片做病理组织学分析,寻找钙化并留取图像。着重观察以下内容:(1)视野内是否存在钙化。钙化指的是显微镜下所见的钙盐沉积。(2)观察钙盐沉积的分布及形态。同心圆状排列的钙化小体被称为砂粒体,是一种直径约50~70 μm、同心圆分层状的钙化小体,其在显微镜下呈特殊的“洋葱样”[8]表现;不符合这种诊断标准的钙盐沉积形态被称为不规则钙盐沉积。(3)肿瘤内部的细胞与间质成分,间质主要是指增生纤维组织。
统计学处理采用SPSS 20.0统计软件,分类变量的比较采用χ2检验,以P<0.05为差异有统计学意义。以手术后病理结果为金标准,计算常规超声与17 MHz超声诊断甲状腺结节微钙化的敏感度、特异度、准确度、阳性预测值、阴性预测值,评价两种方法对结节微钙化的检出效果。
结 果
一般情况75例甲状腺结节患者,共102个结节接受术前超声检查并经手术病理确诊为甲状腺乳头状癌,其中,2例患者共计3个甲状腺结节的后缘距体表>2.6 cm被排除(结节后缘距体表距离分别为2.8、2.6、3.0 cm),4例患者共计6个结节内含粗大钙化被排除,最终有69例患者共计93个结节纳入研究。入选的69例患者中,男15例(21.7%),女54例(78.3%),平均年龄(42.4±11.6)岁(19~67岁),男性平均年龄(28.2±10.9)岁(23~60岁),女性平均年龄(43.6±11.5)岁(19~67岁)。
病理结果病理显微镜下发现钙化结节患者44例(53个结节),其中,男12例(27.3%),女32例(72.7%),平均年龄(41.4±13.3)岁(19~67岁);发现无钙化结节患者36例(40个结节),其中,男6例(16.7%),女30例(83.3%),平均年龄(43.9±8.4)岁(24~60岁)。
53个甲状腺钙化结节中,有10个发现典型的砂粒体表现(图1A),均位于细胞团内,其中8个结节是同时存在砂粒体及不规则钙盐沉积,不规则钙盐沉积大部分位于细胞间质及纤维化间隔内(图1B)。
将结节按大小分为≤1.0 cm的微小癌组(n=66)和>1.0 cm 的非微小癌组(n=27),两组分别有44和19个结节在显微镜下有钙化,差异无统计学意义(χ2=1.305,P=0.358)。
常规超声与17MHz超声对乳头状癌结节微钙化检出情况的比较93个甲状腺结节中,17 MHz超声对甲状腺乳头状癌微钙化的检出率为74.2%(69/93),明显高于常规超声的59.1%(55/93)(χ2=4.742,P=0.029)。
常规超声和17 MHz超声对甲状腺结节微钙化的诊断敏感度、特异度、准确度、阳性预测值、阴性预测值分别为73.6%和98.1%、60.0%和57.5%、67.7%和80.6%、70.9%和75.4%、63.1%和95.8%。17 MHz超声对结节内部显示更加细致,与显微镜下病理结果相关性更好(图2、3)。
分析不同频率超声显示的甲状腺结节内部微钙化数目,并与病理微钙化结果进行对照,结果显示:常规超声与17 MHz超声均无微钙化共20个结节,病理亦未发现钙化,与病理结果一致。常规超声与17 MHz超声均有微钙化共51个结节,其中结节内微钙化数>5个的结节39例,病理亦发现钙化,与病理结果一致;结节内微钙化数<5个(实际病例均≤3个)的结节12个,病理未发现钙化,与病理结果不一致。常规超声与17 MHz超声微钙化表现相反的结节22个,5个常规超声表现与病理结果一致,17个17 MHz超声表现与病理结果一致。
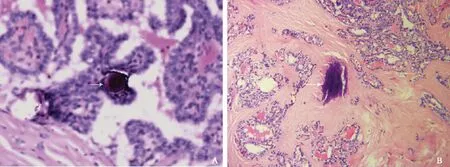
A.甲状腺乳头状癌内部的砂粒体(箭头),周围是细胞成分,呈明显的“同心圆、洋葱皮”结构(HE,×200);B.乳头状癌内部不规则钙盐沉积(箭头),位于增生的纤维成分内(HE,×100)
A.psammoma bodies (arrow) inside papillary thyroid carcinoma,with a characteristic concentric laminated appearance,surrounded by cell components (HE,×200);B. irregular calcium deposits (arrow) inside papillary thyroid carcinoma,located mainly in proliferated fibrous tissues(HE,×100)
图1不同钙化形式的病理表现
Fig1Pathological manifestations of different calcification
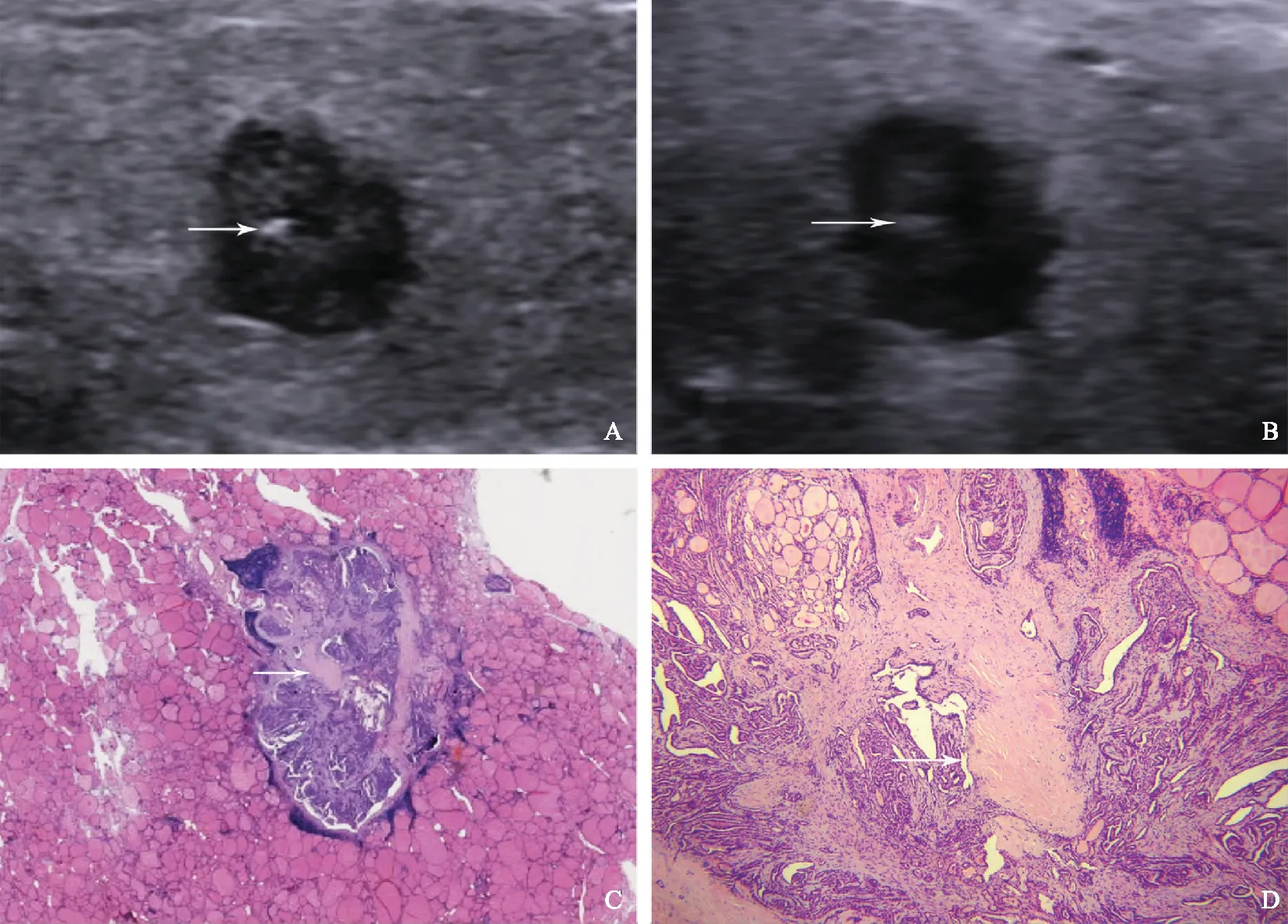
A.纵切面,常规超声示低回声结节内点状强回声(箭头);B.纵切面,17 MHz高频超声示对应位置呈短条状高回声(箭头);C.病理结果显示对应位置内呈细胞与纤维条索分隔(箭头)(HE,×20);D.病理结果显示增生纤维分隔内无钙盐沉积(箭头)(HE,×40)
A. longitudinal grayscale sonogram of a thyroid hypoechoic nodule on the conventional ultrasound,showing a punctate echogenic focus (arrow);B. longitudinal grayscale sonogram of a thyroid hypoechoic nodule on 17-MHz ultrasound,showing a hyperechoic strip (arrow);C. pathology reveals a focal distribution of proliferated fibrous tissues (arrow) (HE,×20);D.pathology reveals that there is no calcification in the proliferated fibrous tissues (arrow) (HE,×40)
图2患者,男,48岁,甲状腺左叶乳头状癌,结节大小0.67 cm×0.48 cm×0.67 cm
Fig2A 48-year-old male with papillary thyroid carcinoma in left thyroid lobe (nodule size: 0.67 cm×0.48 cm×0.67 cm)
讨 论
高频超声检查已成为临床检查甲状腺结节的首选方法[9],通过观察甲状腺结节的边界和内部结构,提供判断甲状腺结节良恶性的依据[10-11]。但由于甲状腺结节组织结构的复杂多样性,良恶性结节的超声表现存在交叉现象。微钙化是甲状腺癌特异性较高的超声特征[12],通过仔细观察甲状腺结节超声表现,提高甲状腺结节的微钙化显示,有利于判断甲状腺结节良恶性。近年来,关于超声对甲状腺结节的研究,限于使用7.5、13 MHz等小于17 MHz的高频超声[13-15]。随着超声检查设备的发展,更高频率超声探头逐渐应用。本研究采用17 MHz超声针对甲状腺乳头状癌的微钙化超声表现与相应病理进行研究,以期进一步加深对微钙化的理解。
自1906年首次报道砂粒体与甲状腺乳头状癌具有相关性以来[16],声像图上甲状腺结节微钙化被认为是砂粒体的声像图表现[17]。Bai等[18]回顾性分析了229例甲状腺乳头状癌患者,其中58例(25%)发现砂粒体,与年龄、性别、肿瘤大小没有相关性;Das等[19]回顾分析了54例甲状腺乳头状癌细针穿刺(fine needle aspiration,FNA)涂片,发现6例(11%)存在砂粒体,与本研究结果相似。本研究在显微镜下发现53个结节存在钙化,其中10个结节(11%)存在典型的砂粒体。常规超声发现55个微钙化结节中有7个结节存在砂粒体,17 MHz超声发现69个微钙化结节中10个存在砂粒体,超声发现的微钙化结节数量多于病理显微镜下存在砂粒体结节的数量。由此推测,声像图上微钙化并不完全是砂粒体所致。
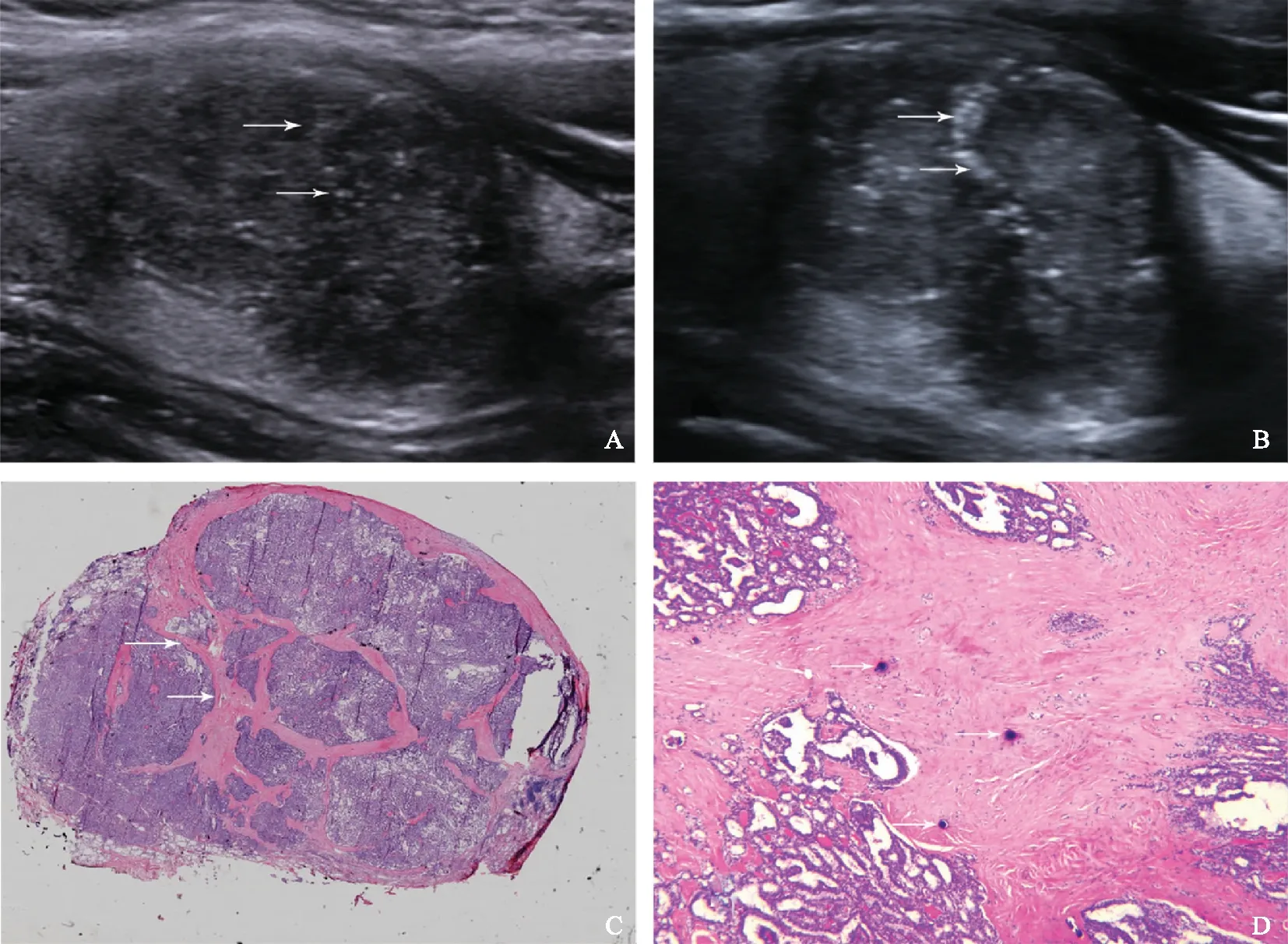
A.纵切面,常规超声示低回声结节内多发、散在点状强回声(箭头);B.纵切面,17 MHz高频超声示一部分点状强回声呈条状排列(箭头);C.病理结果示结节内纤维呈条索状分隔肿瘤细胞(箭头)(HE,×20);D.病理结果示钙盐沉积位于增生的纤维间隔内(箭头)(HE,×40)
A.longitudinal grayscale sonogram of a thyroid hypoechoic nodule on conventional ultrasound,showing multiple and diffuse punctate echogenic foci (arrows);B. longitudinal gray scale sonogram of a thyroid hypoechoic nodule on the 17-MHz ultrasound,showing multiple punctate echogenic foci characterized as strip-shaped distribution;C. pathology reveals the fibers in the nodules separate the tumor cells in streak-like manner (arrows) (HE,×20); D.pathology reveals irregular calcium deposits in proliferated fibrous tissues (arrows) (HE,×40)
图3患者,女,36岁,甲状腺左叶乳头状癌,结节大小2.4 cm×1.9 cm×1.8 cm
Fig3A 36-year-old female with papillary thyroid carcinoma in left thyroid lobe (nodule size: 2.4 cm×1.9 cm×1.8 cm)
目前,甲状腺乳头状癌微钙化的机制仍存在争议[20]。有研究认为成骨相关蛋白表达增高可能与甲状腺癌微钙化形成有关[21-22]。Das等[19]研究认为甲状腺癌肿瘤细胞能自分泌钙化物质而形成砂粒体。根据钙化形式不同,显微镜下钙化可分为砂粒体钙化及不规则样钙化[23]。本研究显微镜下的55个钙化结节,其钙化形式包括砂粒体及不规则钙盐沉积,与以上报道相同。所以,砂粒体和不规则钙盐沉积均是钙化的重要形式。本研究还发现两种钙化的分布有不同特点,砂粒体主要位于肿瘤细胞间,不规则钙盐沉积于纤维组织中,与以往研究结果相同[18]。Bai等[18]研究认为甲状腺癌的钙化形式主要有砂粒体、基质钙化及骨化,其中基质钙化的判断标准为典型砂粒体结构及骨基质之外的钙化形式,后者与本研究中的不规则钙盐沉积相同,并发现砂粒体钙化及基质钙化均与甲状腺癌淋巴结转移及分期有关[18]。由此可见,无论哪种钙化形式,微钙化都对甲状腺癌的诊断具有重要意义。
诸多临床研究及Meta分析均发现,甲状腺结节的微钙化超声征象对诊断甲状腺癌有较高的特异度[24]。本研究采用17 MHz高频超声和常规超声对93个甲状腺乳头状癌结节进行探查,结果显示17 MHz高频超声扫描对甲状腺结节微钙化的检出率明显高于常规超声,同时准确度、阳性预测值及阴性预测值也更高。Tahvildari等[6]研究认为,由于18 MHz超声的轴向分辨率为0.4 mm,因此对小于400 μm的砂粒体及不规则钙化无法显示。本研究中,声像图上微钙化与显微镜下钙化不符合的状况均出现在超声声像图中微钙化数目少于5个、显微镜下钙盐沉积数目少且分散的结节。Wu等[25]研究认为,声像图上的微钙化还可能是胶体结晶、纤维化、囊内出血的表现。本研究中,采用常规超声扫查部分病灶内部显示微小点状强回声,而17 MHz超声表现为短条状稍高回声,相应显微镜下切面出现的是纤维条索,高倍镜下未出现钙化。对于另外一些病例,常规超声显示为无规律分布的散在微小点状强回声,17 MHz超声显示出部分微小点状强回声呈条状排列,相应低倍显微镜下切面显示为纤维组织,高倍显微镜下显示为钙盐沉积分布于增生的纤维组织中。即本组病例中常规超声及17 MHz超声声像图上的微钙化,显微镜下除钙盐沉积还有纤维化。这些研究结果提示,声像图上的微钙化不完全是显微镜下的钙化;声像图上甲状腺结节内存在数目更多的点状强回声对恶性的提示有更大诊断价值,但数目较少的点状强回声需慎重提示微钙化。17 MHz超声对微钙化显示较常规超声更敏感,但又引起对微钙化过度提示的不足,降低了微钙化诊断恶性的特异度。本组病例没有包括甲状腺良性结节,因此有关17 MHz超声对微钙化的诊断价值有待进一步深入研究。
综上,本研究结果显示,声像图上微钙化是由病理显微镜下的砂粒体和不规则钙盐沉积所致,对甲状腺乳头状癌诊断具有较高的特异性。17 MHz高频超声扫描对甲状腺结节微钙化的检出率高于常规超声,但会引起对微钙化过度提示的不足,且受扫查深度的限制,需与常规超声联合应用。
[1] Davies L,Welch HG. Current thyroid cancer trends in the United States[J]. JAMA Otolaryngol Head Neck Surg,2014,140(4):317- 322. DOI:10.1001/jamaoto.2014.1.
[2] Siegel RL,Miller KD,Jemal A. Cancer statistics[J].CA Cancer J Clin,2017,67(1):7- 30. DOI:10.3322/caac.21387.
[3] Pacini F,Schlumberger M,Dralle H,et al. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium [J]. Eur J Endocrinol,2006,154(6):787- 803. DOI:10.1530/eje. 1.02158.
[4] Kim BK,Choi YS,Kwon HJ,et al. Relationship between patterns of calcification thyroid nodules and histopathologic findings[J]. Endocr J,2013,60(2):155- 160.DOI:10.1507/endocrj.EJ12- 0294.
[5] Baudin E,Travagli JP,Ropers J,et al. Microcarcinoma of the thyroid gland: the Gustave-Roussy institute experience[J]. Cancer,1998,83(3):553- 559.
[6] Tahvildari AM,Pan L,Kong CS,et al. Sonographic-pathologic correlation for punctate echogenic reflectors in papillary thyroid carcinoma: what are they[J]. J Ultrasound Med,2016,35(8):1645- 1652.DOI:10.7863/ultra.15.09048.
[7] Jeh SK,Jung SL,Kim BS,et al. Evaluating the degree of conformity of papillary carcinoma and follicular carcinoma to the reported ultrasonographic findings of malignant thyroid tumor[J].Korean J Radiol,2007,8(3):192- 197. DOI:10.3348/ kjr.2007.8.3.192.
[8] Ayala C,Healy GB,Robson CD,et al. Psammomatous calcification in association with a benign thyroglossal duct cyst[J]. Arch Otolaryngol Head Neck Surg,2003,129(2):241- 243.DOI:10.1001/archotol.129.2.241.
[9] Dhoot NM,Singh S,Choudhury B,et al. Evaluation of hypopharyngeal carcinoma using high-resolution ultrasound: comparison with CT[J].J Clin Ultrasound,2014,42(3):143- 149.DOI: 10.1002/jcu.22130.
[10] Rios A,Torregrosa B,Rodríguez JM,et al. Ultrasonographic risk factors of malignancy in thyroid nodules[J]. Langenbecks Arch Surg,2016,401(6):839- 849. DOI:10.1007/s00423- 016- 1451-y.
[11] Woliński K,Szkudlarek M,Szczepanek-Parulska E,et al. Usefulness of different ultrasound features of malignancy in predicting the type of thyroid lesions: a meta-analysis of prospective studies[J]. Pol Arch Med Wewn,2014,124(3):97- 104.DOI:10.20452/pamw.2132.
[12] Campanella P,Ianni F,Rota CA,et al. Quantification of cancer risk of each clinical and ultrasonographic suspicious feature of thyroid nodules: a systematic review and meta-analysis [J]. Eur J Endocrinol,2014,170(5):R203-R211.DOI: 10.1530/EJE- 13- 0995.
[13] Guth S,Theune U,Aberle J,et al. Very high prevalence of thyroid nodules detected by high frequency(13MHz) ultrasound examination[J]. Eur J Clin Invest,2009,39(8):699- 706.DOI:10.1111/j. 1365- 2362. 2009.02162.x.
[14] Dedecjus M,Adamczewski Z,Brzeziński J,et al. Real-time,high-resolution ultrasonography of the vocal folds--a prospective pilot study in patients before and after thyroidectomy[J]. Langenbecks Arch Surg,2010,395(7):859- 864. DOI: 10.1007/s00423- 010- 0694- 2.
[15] Acharya UR,Faust O,Sree SV,et al. ThyroScreen system: high resolution ultrasound thyroid image characterization into benign and malignant classes using novel combination of texture and discrete wavelet transform[J]. Comput Methods Programs Biomed,2012,107(2):233- 241. DOI: 10.1016/j.cmpb.2011. 10.001.
[16] Klink GH,Winship T. Psammoma bodies and thyroid cancer[J]. Cancer,1959,12:656- 662.
[17] Frates MC,Benson CB,Charboneau JW,et al. Management of thyroid nodules detected at US: Society of Radiologists in Ultrasound consensus conference statement[J]. Radiology,2005,237(3):794- 800. DOI:10.1148/ radiol.2373050 220.
[18] Bai Y,Zhou G,Nakamura M,et al. Survival impact of psammoma body,stromal calcification,and bone formation in papillary thyroid carcinoma[J]. Mod Pathol,2009,22(7):887- 894.DOI:10.1038/modpathol.2009.38.
[19] Das DK,Mallik MK,Haji BE,et al. Psammoma body and its precursors in papillary thyroid carcinoma: a study by fine-needle aspiration cytology[J]. Diagn Cytopathol,2004,31(6):380- 386. DOI:10.1002/dc.20124.
[20] Triggiani V,Guastamacchia E,Licchelli B,et a1. Microcalcifications and psammoma bodies in thyroid tumors[J]. Thyroid,2008,18(9):1017- 1018. DOI: 10.1089/thy.2008.0082.
[21] Sun Y,Fang S,Dong H,et al. Correlation between osteopontin messenger RNA expression and microcalcification shown on sonography in papillary thyroid carcinoma[J].J Ultrasound Med,2011,30(6):765- 771. DOI:10.7863/jum.2011.30. 6.765.
[22] Kang KH. Osteopontin expression in papillary thyroid carcinoma and its relationship with the BRAF mutation and tumor characteristics[J]. J Korean Surg Soc,2013,84(1):9- 17.DOI:10.4174/jkss.2013.84.1.9.
[23] Scimeca M,Giannini E,Antonacci C,et al. Microcalcification in breast cancer: an active phenomenon mediated by epithelial cells with mesenchymal characteristics[J]. BMC Cancer,2014,23(14):286- 295.DOI: 10.1186/1471- 2407- 14- 286.
[24] Remonti LR,Kramer CK,Leitao CB,et al. Thyroid ultrasound features and risk of carcinoma:a systematic review and meta-analysis of observational studies[J]. Thyroid,2015,25(5):538- 550. DOI: 10.1089/thy.2014.0353.
[25] Wu G,Zhou Z,Li T,et al. Do hyperechoic thyroid nodules on B-ultrasound represent calcification[J]. J Int Med Res,2013,41(3):848- 854. DOI:10.1177/ 0300060513480083.



