任 翠,朱 巧,陈 雯,郎 宁,袁慧书
北京大学第三医院放射科,北京 100191
强直性脊柱炎(ankylosing spondylitis,AS)是一种病因不明以中轴骨受累为主的慢性炎症性疾病。AS的活动性与治疗方案的选择密切相关[1-2]。大多数学者推荐加拿大脊柱关节炎研究协会(Spondyloarthritis Research Consortium Canada,SPARCC)制定的磁共振成像(magnetic resonance imaging,MRI)骶髂关节评分系统评价骶髂关节炎的活动性[3-4]。有研究表明SPARCC骶髂关节评分与Bath强直性脊柱炎病情活动指数(Bath ankylosing spondylitis disease activity index,BASDAI)呈显着正相关,此外,相对于其他评价方法,SPARCC评分系统具有较高的可重复性[5-6],然而其对骨髓水肿的评估仅限于主观的视觉评价。弥散加权成像(diffusion weighted imaging,DWI)是一种不依赖对比剂,敏感、快速的成像方法,通过体素内水分子扩散速度的不同提供图像对比。近年,DWI在骨骼肌肉系统疾病中应用越来越广泛[7-9]。DWI有助于早期诊断AS,并可能成为评估疾病活动性的生物学标记物[10-12]。然而,Boy等[13]研究表明脂肪抑制T2加权像(T2 weighted imaging,T2WI)判断骶髂关节骨炎的敏感性最高,并且,DWI及动态增强扫描不能提供额外的诊断价值。此外,有文献报道表观弥散系数(apparent diffusion coefficient,ADC)值与BASDAI评分具有一定的相关性,但相关系数相对较低(r=0.329)[7]。因此,本研究旨在进一步明确DWI在AS骶髂关节炎活动性评估中的作用。
对象和方法
对象选取2015年8月至2018年1月本院就诊、符合国际脊柱关节病评价小组标准、经临床确诊的AS患者,所有患者均在疾病活动性评估2周内行常规MRI及DWI检查。所有患者仍需符合以下入组条件:(1)无腰椎及骨盆手术史;(2)1年内无骶髂关节外伤史;(3)无骶髂关节感染史;(4)不合并其他结缔组织病史;(5)无恶性肿瘤病史。共78例患者符合入选标准,其中5例患者肠气较多,DWI图像伪影重被剔除。最终被纳入研究的患者共73例,男性59例、女性14例,年龄15~41岁,平均(28.1±14.3)岁。
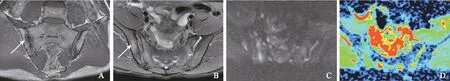
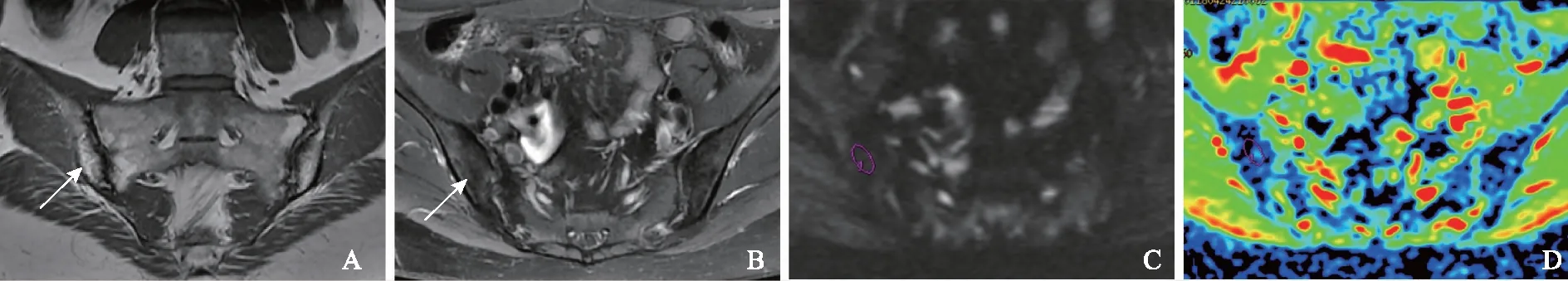
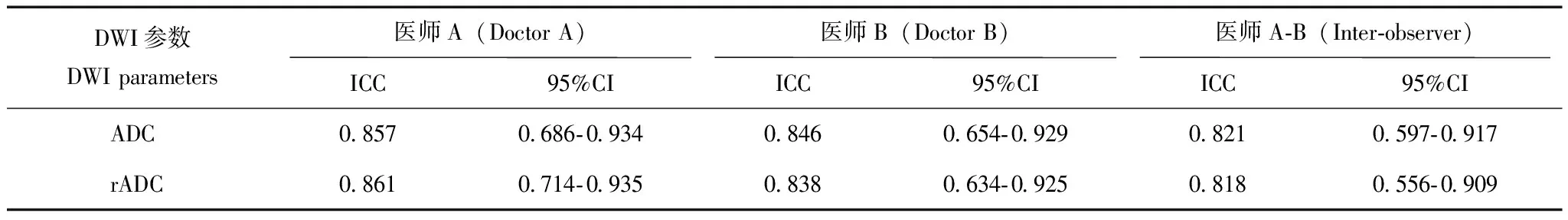
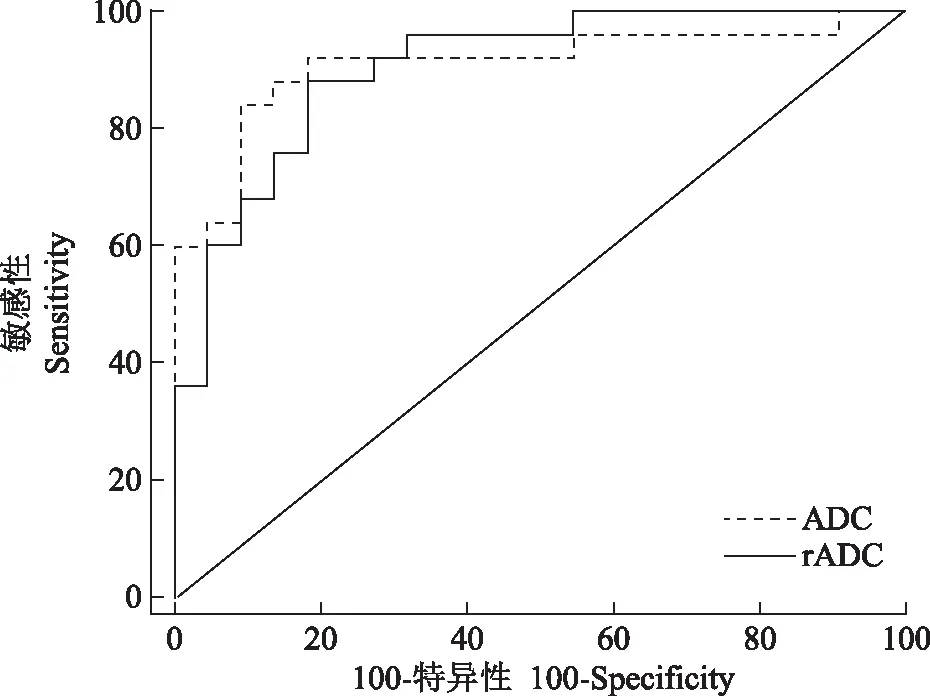
AS临床活动性评价标准由两名风湿免疫科医师共同判断患者的临床活动性。活动组:BASDAI评分≥6分或4分 MR检查方法采用GE Discovery MR750 3.0T磁共振扫描仪,8通道体部线控相圈。患者取常规仰卧位,足先进。常规骶髂关节扫描序列包括斜冠状位快速自旋回波T1 加权像:重复时间(repetition time,TR)/回波时间(echo time,TE)=450 ms/10 ms,层厚/间隔=4 mm/0.5 mm,视野(field of view,FOV) 30 cm×30 cm,矩阵352×256,激发次数(number of excitation,NEX)=1;斜冠状位快速自旋回波脂肪抑制T2WI:TR/TE=3200 ms/85 ms,层厚/间隔=4 mm/0.5 mm,FOV 30 cm×30 cm,矩阵320×256,NEX=4;轴位快速自旋回波脂肪抑制T2WI:TR/TE=3900 ms/85 ms,层厚/间隔=4 mm/0.5 mm,FOV 32 cm×32 cm,矩阵320×256,NEX=4。横轴位DWI:TR/TE=8.7 ms/minimum ms,层厚/间隔=4 mm/0.5 mm,FOV 38 cm×38 cm,矩阵 192×192,NEX=1,b=0、10、20、30、50、80、100、200、400、800 s/mm2。 图像后处理及ADC值测量应用AW 4.6工作站Functool软件重建出ADC图。2名放射科医生在不知晓患者AS临床活动性的前提下,参照同层面轴位脂肪抑制T2WI,独立测量病变区(不包括骨质硬化)ADC值。在ADC图上尽可能大地绘制类圆形感兴趣区,每个感兴趣区至少≥50个体素,并且避开血管、坏死、囊变、骨皮质及关节软骨区域,同时测量双侧骶髂关节骶骨及髂骨侧病变内及正常区域的ADC值,测量3次后取平均值。计算骶骨或髂骨病变与正常骶骨或髂骨的相对ADC(relative ADC,rADC)值,rADC值=ADC病变/ADC正常。 统计学处理采用SPSS 18.0统计软件进行分析,计算组内相关系数(interclass correlation coefficient,ICC),评价两名医师及同一医师不同时间测量结果的一致性,ICC≥0.81,一致性好;ICC位于0.61~0.80,一致性中等;0.41~0.60,一致性一般;0.11~0.40,一致性差;0.1以下无一致性。采用更有经验医师的测量结果进行ADC值、rADC值的组间比较,受试者工作特征(receiver operating characteristic,ROC)曲线分析及Pearson相关性分析。活动组、稳定组ADC值及rADC值的比较,若数据满足正态分布采用两独立样本t检验,若不满足则采用Mann-WhitneyU检验。采用MedCalc 15.8软件,通过ROC曲线分析,利用临界值表选取最大约登指数对应的临界值,作为ADC值及rADC值判断骶髂关节炎活动性的最佳阈值,以AS患者临床活动性评价结果为金标准,计算敏感性及特异性。ADC及rADC值与临床BASDAI评分之间的相关关系采用Pearson相关性分析,P<0.05为差异有统计学意义。 一般情况73例AS患者,活动组43例,平均年龄(27.3±13.8)岁;稳定组30例,平均年龄(29.9±12.9)岁。活动组及稳定组年龄差异无统计学意义(t=1.06,P>0.05)。 AS骶髂关节炎MRI表现MRI图像出现单和/或双侧骶髂关节面骨质侵蚀35例(活动组11例、稳定组24例),表现为低信号骨皮质线连续性中断,关节面凹凸不平可见虫蚀状骨质破坏。单和/或双侧骶髂关节面下骨髓水肿43例(活动组38例、稳定组5例),表现为长T1、长T2信号,DWI呈明显高信号,ADC值升高。骶髂关节面下出现脂肪沉积52例(活动组22例、稳定组30例),表现为T1加权像(T1 weighted imaging,T1WI)呈高信号,脂肪抑制T2WI呈低信号,DWI信号不高,ADC值减低。骶髂关节面下出现骨质增生硬化47例(活动组20例、稳定组27例),在所有磁共振成像序列上均表现为低信号,DWI信号不高,ADC值减低(图1、2)。 测量结果一致性评价同一医师两次重复测量、两名医师分别测量ADC值及rADC值的ICC>0.81,一致性较好(表1)。 ADC值及rADC值ADC值及rADC值均服从正态分布,活动组、稳定组骶髂关节ADC值分别为(0.667±0.122)×10-3mm2/s和(0.492±0.0651)×10-3mm2/s,差异有统计学意义(t=6.02,P<0.0001)。活动组、稳定组rADC值分别为(1.715±0.343)×10-3mm2/s和(1.289±0.209)×10-3mm2/s,差异有统计学意义(t=5.06,P<0.0001)。 AS:强直性脊柱炎;T1WI:T1加权像;T2WI:T2加权像;DWI:弥散加权成像;ADC:表观弥散系数;ROI:感兴趣区 AS:ankylosing spondylitis;T1WI:T1-weighted imaging;T2WI:T2-weighted imaging;DWI:diffusion-weighted imaging;ADC:apparent diffusion coefficient;ROI:region of interest 图122岁男性AS患者活动性骶髂关节炎:双侧骶髂关节软骨下骨髓水肿(箭头),冠状位T1WI呈低信号(A),轴位脂肪抑制T2WI呈高信号(B),DWI骨髓水肿(类圆形区域)呈高信号(C),ADC图将 ROI(类圆形区域)置于右侧髂骨骨髓水肿区,ADC值为0.960×10-3mm2/s(D) Fig1Active sacroiliitis in a 22-year-old man with AS:bilateral subchondral bone marrow edema (arrow) was seen in both sacroiliac joints,T1WI showed low signal intensity (A),and fat-saturated T2WI axial images showed subchondral bone marrow edema with high signal intensity (B),DWI image demonstrated hyperintensity representing bone marrow edema (circle-like area) (C),ADC map was obtained,and ROI (circle-like area) was placed on the marrow edema area of right iliac bone,the ADC value was 0.960×10-3mm2/s (D) 图233岁女性AS患者稳定的骶髂关节炎:双侧骶髂关节软骨下脂肪沉积(箭头),冠状位T1WI呈高信号(A),轴位脂肪抑制T2WI呈低信号(B),DWI脂肪沉积区(类圆形区域)呈低信号(C),ADC图将ROI(类圆形区域)置于右侧髂骨脂肪沉积区,ADC值为0.397×10-3mm2/s(D) Fig2Chronic sacroiliitis in a 33-year-old woman with AS:bilateral subchondral adipose deposition (arrow) was seen in both sacroiliac joints,T1WI showed high signal intensity (A),and fat-saturated axial T2WI image showed low signal intensity (B),DWI image demonstrated hypointensity representing dipose deposition (circle-like area) (C),ADC map was obtained,ROI (circle-like area) was placed on the dipose deposition area of right iliac bone,the ADC value was 0.397×10-3mm2/s (D) 表1 DWI定量参数测量同一观察者、不同观察者一致性评价Table 1 Intra-observer and inter-observer agreement on DWI quantitative parameters measurement rADC:相对表观弥散系数;ICC:组内相关系数 rADC:relative apparent diffusion coefficient ;ICC:interclass correlation coefficient ROC曲线ADC值判断骶髂关节炎活动性的最佳阈值为0.545×10-3mm2/s,ROC曲线下面积(area under curve,AUC)为0.909(0.789~0.973),特异性、敏感性分别为81.8%、92.0%。rADC值判断骶髂关节炎活动性的最佳阈值为1.467×10-3mm2/s,AUC为0.904(0.782~0.970),特异性、敏感性分别为81.8%、88.0%。ADC值及rADC值的AUC差异无统计学意义(Z=0.0980,P=0.92)(图3)。 图3ADC值及rADC值鉴别AS骶髂关节炎活动性的受试者工作特征曲线 Fig3Receiver operating characteristic curves of ADC and rADC values for identifying the activity of sacroiliitis in AS rADC值、ADC值与BASDAI评分的相关性活动组BASDAI评分为4.00~7.40分,中位数为5.30,四分位数间距为1.70;稳定组BASDAI评分为1.00~3.50分,中位数为2.05,四分位数间距为1.03。ADC值、rADC值与BASDAI评分呈显着正相关(Pearson相关系数分别为0.82、0.80,P<0.0001)。 本研究表明DWI有助于判断AS骶髂关节炎的活动性,活动组的ADC值及rADC值显着高于稳定组,这一结果可能与以下因素有关:骶髂关节炎骨髓水肿引起细胞外水分子的比例增加、毛细血管输送到骨髓腔的血液增加以及水分子的扩散运动增加[14-16]。这些因素均会引起ADC值升高。此外,ADC值同时也受黄骨髓的影响,黄骨髓可以降低水分子的密度,并且相对于红骨髓内较小的造血细胞,黄骨髓中含有较多大的脂质细胞能在更大程度上限制水分子的运动,此外,脂肪的疏水性不仅是扩散的物理屏障,而且对水分子的运动起排斥作用[17-18]。AS骶髂关节面下脂肪沉积被认为是对活动性炎症的修复[5,19],稳定组ADC值降低可能与骶髂关节脂肪沉积增多有关。本研究与以往的研究结果类似[10,12,14]。本研究ROC曲线分析显示ADC值、rADC值判断AS活动性的最佳阈值分别为0.545×10-3mm2/s、1.467×10-3mm2/s,特异性均为81.8%,敏感性分别为92. 0%、88.0%,这一结果与其他研究结果类似[12,14,20],ADC值鉴别AS骶髂关节炎活动性的特异度及敏感度均在80%以上,因此可作为一种有效的生物学定量参数判断AS的活动性,然而由于ADC值受不同设备、场强、b值及绘制感兴趣区随机性的影响,目前仍不能制定统一的ADC值鉴别AS活动性的最佳阈值,rADC值也许在一定程度上能够降低上述因素对ADC值差异的影响。然而,据笔者所知,仅Vendhan 等[21]利用rADC值鉴别附着点炎相关关节炎(幼年特发性关节炎的1个亚型)骶髂关节炎的活动性,而几乎所有的研究仅测量了ADC值的“绝对值”判断成人AS的活动性,然而非常有必要测量rADC值,因为随着年龄增加,黄骨髓的比例会增加,rADC值可以减少不同年龄AS患者ADC值的内在差异。虽然本研究rADC值判断AS骶髂关节炎活动性的能力并没有显着高于ADC值,可能与本研究的样本量相对较小、研究对象主要是年轻人有关。 本研究采用单指数衰减模型评价ADC值,该模型计算的ADC值同时受水分子扩散及毛细血管微循环灌注的影响,不能反映水分子的真实扩散运动。基于双指数衰减模型的DWI可以计算出组织内水分子纯弥散系数、微循环灌注相关系数及微循环灌注在DWI信号衰减中所占的比重[22-23]。然而,有文献比较了单、双指数模型的DWI检出AS活动性骶髂关节炎的能力,结果表明ADC值鉴别活动及非活动性骶髂关节炎的能力显着高于所有双指数模型产生的定量参数[20],此外有研究表明ADC值、纯弥散系数鉴别Ⅰ、Ⅱ型卵巢上皮癌的能力差异无统计学意义[24]。也有类似研究表明ADC值鉴别肝脏良、恶性肿瘤,评价肾功能不全的能力显着高于纯弥散系数[25-26]。此外,尽管动态增强扫描表明活动性骶髂关节炎会引起局部微循环的灌注增加,但是骶髂关节是一个少血供器官,笔者推测微循环灌注可能对ADC值的影响较小,并且Henkelman等[27]认为由双指数衰减模型计算的灌注参数能够更完整地评价通过单个体素的总血流灌注情况,这可能不同于使用血管内造影剂测量的灌注参数,由于缺少组织病理学对照,因此本研究仅评价了ADC值及rADC值在AS骶髂关节炎中作用。 目前用于评价AS骶髂关节炎活动性的MRI序列主要包括:T1WI增强扫描、FS-T2WI及DWI。AS骶髂关节炎活动期,炎性细胞和血管源性水肿导致血流灌注增加,微血管结构破坏,行T1WI增强扫描,活动性炎症区域明显强化[28]。动态对比增强扫描,可以绘制出病变区的时间-信号强度曲线,可对炎性病变的严重程度进行定量分析,然而,该检查需要静脉注射对比剂,可能出现过敏反应及肾源性系统性纤维化风险,同时增加了扫描时间。FS-T2WI是诊断脊柱关节病骨炎非常敏感的成像序列,活动性骶髂关节炎在FS-T2WI上表现为明显高信号,然而FS-T2WI不能定量分析病变的严重程度,不利于准确评价AS的治疗反应。DWI无需对比剂,扫描时间短,可以对活动性炎症进行定量分析,与BASDAI评分具有较好的相关性,是评价AS骶髂关节炎非常有价值的成像方法之一。在DWI上活动性炎症表现为明显高信号,而病变的ADC值升高,这与DWI的“T2穿透效应”有关,同时,细胞毒性水肿、高细胞密度和高黏度可能也是导致病变区DWI上呈高信号的原因[29]。 本研究具有一定的局限性:(1)样本量相对较小,有必要进行大样本的研究进一步证实DWI判断AS骶髂关节炎活动性的价值。(2)不同医师判断AS临床活动性的一致性尚未评价。(3)ADC值的变化并没有相应组织病理学对照研究,然而临床工作中并不推荐骶髂关节活检评价AS活动性。(4)本研究并未观察与骶髂关节炎活动性相关的其他结构,如滑膜、软骨、韧带及周围软组织病变。(5)治疗方法及治疗时间对ADC值的影响,尚未评价。 综上,本研究结果表明DWI有助于定量评价AS骶髂关节炎的活动性。活动组ADC值及rADC值显着高于稳定组。结 果
讨 论



