盖晓磊,李思哲,左亚刚,杜 伟,何春霞
1中国医学科学院 北京协和医学院 北京协和医院皮肤科 协和医学转化中心 国家皮肤与免疫疾病临床医学研究中心,北京 100730 2河北北方学院研究生院,河北张家口 075000
结节性类天疱疮(pemphigoid nodularis,PN)是一种罕见的大疱性类天疱疮(bullous pemphigoid,BP)临床亚型,目前报道的文献多为个案报道,搜索万方和知网数据库近10年来仅有两篇涉及多例资料的报道[1-2],且主要关注该病的临床和病理表现,未见对该病其他实验室检查进行分析。PN主要表现为瘙痒性丘疹或结节,部分与水疱同时存在,与经典的BP具有相似的免疫学特征,但PN与BP在很多实验室检查方面不同。为探讨PN的临床及实验室检查特点,本研究分析了2016年1月至2019年8月北京协和医院皮肤科住院部收治的6例PN患者的临床资料,为临床提供参考。
资料和方法
收集2016年1月至2019年8月北京协和医院皮肤科住院部经过确诊的PN患者的临床资料,纳入标准符合(1)瘙痒性结节;(2)直接/间接免疫荧光显示IgG、C3表皮基底膜带线性沉积;(3)酶联免疫吸附实验检测到抗BP180和/或抗BP230抗体,或盐裂间接免疫荧光表皮侧IgG线性沉积;(4)组织病理:表皮下裂隙或表皮下大疱,无棘层松解,嗜酸性粒细胞(eosinophil,EOS)性海绵水肿,真皮浅层EOS浸润;其中1~3条为诊断必要条件[3]。复发定义为皮损完全消退后,1个月出现3个新发皮损(水疱、湿疹或结节)[4]。6例患者均符合PN的诊断标准,对其临床表现、组织病理及实验室检查结果进行分析。
结 果
一般资料男性3例、女性3例,年龄34~78岁,平均(58±16) 岁;病程最短11个月,最长8年,平均(39±34)个月(表1)。

表1 PN患者临床特征Table 1 Clinical characteristics of patients with PN disease
PN:结节性类天疱疮
PN:pemphigoid nodularis
临床表现5例患者初发时为局灶性病变,表现为瘙痒性红斑、丘疹,1例为没有皮损的全身性瘙痒。起病部位发生于躯干部2例(腰部1例、胸背部1例)、四肢3例(上肢1例、手足2例)。所有患者瘙痒程度剧烈,病情缓慢进展,最后均发展为全身瘙痒性丘疹、结节(图1),伴有色素沉着,病程中4例出现过肉眼可见的水疱,且均为紧张性水疱,直径在0.5~3.0 cm,初发水疱时间在发病后2个月~5年,持续时间为3~10 d。所有患者均无黏膜受累。
合并症6例患者中2例合并自身免疫性疾病(单克隆丙种球蛋白病和甲状腺结节),未见合并中枢神经系统疾病。
组织病理学
常规HE染色:3例出现角化过度伴有或不伴有角化不全,2例棘细胞层增厚,真皮层炎细胞浸润,以组织细胞、淋巴细胞为主;2例出现表皮下水疱(图2),疱液内EOS浸润为主,真皮浅层血管周围EOS、中性粒细胞和淋巴细胞浸润。
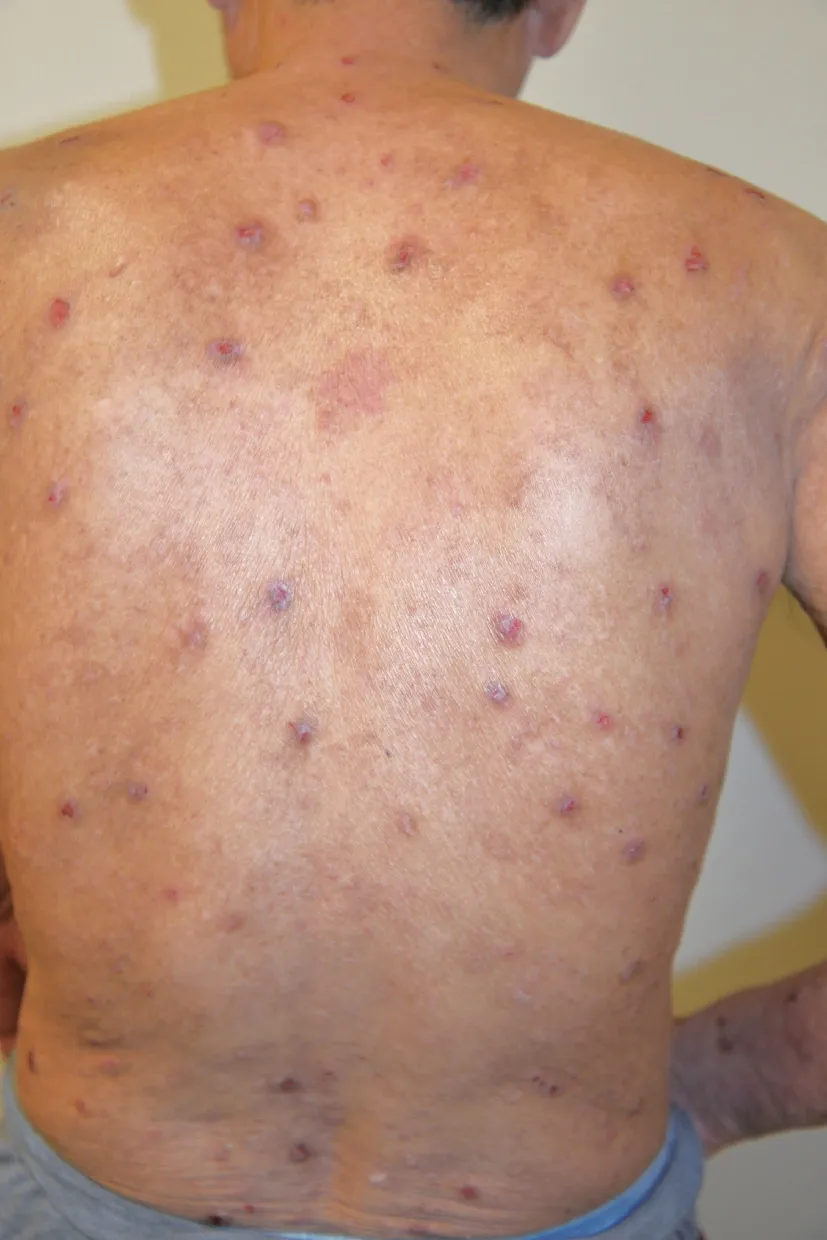
图1PN临床表现:全身散在丘疹、结节,中央无坏死,形如结节性痒疹
Fig1Clinical manifestations of PN:multiple papules and nodules scattered on the whole body,without necrosis in the center
免疫荧光检测:4例患者行直接免疫荧光检测,表现为基底膜带线状沉积(图3),其中C3沉积1例、IgG沉积1例、IgG和C3沉积2例。6例患者行间接免疫荧光检查,均表现为抗基底膜带IgG抗体阳性,抗体滴度1∶40~1∶320。1例盐裂实验表皮侧沉积。
抗BP180抗体:5例血清抗BP180抗体为阳性,24~85 U/ml,平均(43±26) U/ml。
实验室检查结果6例PN患者中4例EOS升高,分别为20.2%、30.3%、5.3%和13.7%,平均13.1%;5例进行了免疫球蛋白E(IgE)检测,均升高,70~1666 KU/L,平均(530±672) KU/L。同时PN与BP以1∶4配比,对两组人群进行比较,年龄(58±16)岁比 (70±10) 岁,EOS (13.1±10.6)%比 (11.4±12.0)%,IgE (530±672)KU/L比 (911±1153) KU/L。

图2PN皮损部位病理表现:角化过度,棘层肥厚,表皮下水疱形成,真皮浅中层及血管周围散在淋巴细胞、中性细胞浸润、嗜酸性粒细胞浸润(HE染色,×10)
Fig2Histopathology of PN lesions:hyperkeratosis,acanthosis,and subepidermal blister formation,with lymphocytes,neutrophils,and eosinophils infiltrating in the superficial dermis and around the blood vessels (HE staining,×10)

图3PN直接免疫荧光:基底膜带IgG呈线状沉积
Fig3Direct immunofluorescence of PN showed the linear deposition of IgG along the basement membrane zone
误诊情况6例PN患者入院前均被误诊,误诊疾病包括湿疹、结节性痒疹、EOS增多性皮病。疾病诊断时间最短6个月,最长5年,平均诊断时间(24±21)个月。
治疗2例单独系统应用糖皮质激素治疗(甲泼尼龙),3例糖皮质激素与免疫抑制剂联合治疗(2例甲泼尼龙+沙利度胺,1例甲泼尼龙+甲氨蝶呤),甲泼尼龙初始剂量为24~32 mg/d,最大控制剂量48 mg/d,1例单独应用免疫抑制剂治疗(环孢素)。疾病控制时间定义为皮损消失、瘙痒症状减轻、药物开始减量的时间,平均为(20±7) d(14~32 d)。
随访与复发情况6例患者中随访5例、失访1例,随访时间12~24个月,随访过程中3例复发。1例已完全停用口服药物,目前停用1个月,偶有新发皮损,每月内出现3~5个,外用激素软膏可完全消退。2例均为停用激素后2个月左右再次出现症状,目前2例均已经口服激素治疗(曾经治疗过程中激素控制剂量2/3),无新发皮损出现。2例目前每日口服甲泼尼龙8 mg维持治疗,无新发皮损出现。
讨 论
BP是一种自身抗体介导的免疫性疾病,主要影响70岁以上的老年人,典型BP表现为红斑或正常皮肤上出现瘙痒性、紧张性水疱。BP患者中,约20%患者表现为结节样、湿疹样、多形红斑样、扁平苔藓样、汗疱疹样等非典型BP皮损[3],又称非大疱性类天疱疮(nonbullous pemphigoid,NBP)。PN属于NBP的一种,多发生在中老年女性[3],本研究患者平均年龄(58±16)岁,相对BP(70±10)岁,本病发病年龄相对较轻。本研究病例性别无差异。BP常合并神经系统性疾病[5],本研究病例中未发现,但本研究提示PN患者更容易合并自身免疫性疾病,这与其他研究结果[3]相似。PN临床表现为瘙痒性丘疹、结节,病程中出现或不出现水疱。不出现水疱的原因,可能由于抗体滴度较低,补体和EOS的参与作用小[6]。BP患者中有10%~30%出现黏膜损害[7],但PN患者中黏膜损害罕见[3],与本研究结果一致。目前PN的发病机制尚不清楚,可能由于搔抓、局部炎症或外伤,导致基底膜带抗原暴露、易感个体产生自身抗体、基底细胞表达基质细胞传递和增殖的介质以及某些重要因子表达增加[8],从而出现相关症状。
外周血EOS、IgE、抗BP180和BP患者的病情密切相关[9],本研究有4例患者出现外周血EOS数目升高,5例患者进行了血清IgE检测,均升高,EOS和IgE间无相关性,与本课题组既往关于BP的研究结果[10]相似。5例患者抗BP180阳性,但滴度较低,平均为(43±26) U/ml,与既往研究[1]相似。
PN的组织病理学表现结节性痒疹样(表皮角化过度、局灶性角化不全和不规则表皮增生)[11]和大疱性类天疱疮(EOS水肿、表皮下裂隙)[12]的特征。显微镜下直接免疫荧光、血清间接免疫荧光对PN的诊断价值较高,所有疑诊PN的患者,均需进行直接免疫荧光检测。PN与BP免疫荧光检测结果相同,表现为IgG和/或C3基底膜带线状沉积,血清中可检测到抗BP180和抗BP230抗体、盐裂实验示致病抗体沉积于表皮侧均有助于确诊本病。
PN主要与结节性痒疹、泛发性湿疹、获得性反应性穿通性胶原病、痒疹型大疱性表皮松解症等疾病相鉴别,因组织病理不具有特异性,免疫荧光以及抗BP180抗体检测可明确诊断。目前,皮肤科医师对PN认识不够充分,容易误诊,6例患者在早期均被误诊为结节性痒疹、慢性湿疹、EOS增多性皮肤病等,提示本病临床表现不特异。需要提醒医师对于慢性、顽固性、瘙痒性结节/丘疹的老年患者,仔细询问是否出现水疱病史,同时对不同形态皮损进行多部位活组织病理、免疫荧光及抗BP180抗体检查,以便早期确诊。
本研究PN的治疗主要是系统应用糖皮质激素和免疫抑制剂。本研究4例口服甲泼尼龙,其中3例联用免疫抑制剂情况下,激素有效剂量仍超过每日每公斤体重0.5 mg,提示PN激素控制剂量可能超过同等程度BP激素控制剂量。也有散发报道认为PN存在药物抵抗现象[13],可能较BP更难治疗。
6例PN患者中有1例失访,5例可随访的患者中3例出现复发,2例仍在维持治疗阶段,3例复发患者中2例在停药2个月左右出现,1例患者复发程度较轻,仅外用激素软膏可控制病情。提示PN患者和BP患者相似,容易复发。复发时间依病情严重程度不同而不同。
需要注意的是,组织病理学检查是BP的主要诊断指标,但在PN患者,组织病理检查缺乏特异性。由于抗BP180抗体滴度低,有些患者不能检测到,或在确诊PN数年后出现该抗体[8],故该抗体阴性并不能除外PN的可能性。如果直接免疫荧光阳性,临床疑似PN,需及早进行盐裂免疫荧光检测。此外,相对于BP,PN患者发病年龄较轻,抗BP180抗体滴度较低,合并神经系统疾病较少,误诊率较高。



