陈苏衡,甘 露,庄 苗,张小晓,郭 鸿,黄蓉蓉,李玉兰
1兰州大学第一临床医学院,兰州 730000 2兰州大学第一医院麻醉科,兰州 730000
近年来,全球各行业“过劳死”频繁发生,引起社会的广泛关注。“过劳死”是因为工作时间过长、劳动强度过重、心理压力太大引发的亚健康状态,由于积重难返,可能诱发身体潜在的疾病突然恶化,救治不及时会危及生命[1]。据不完全统计,我国每年有约60万人死于过度劳累(overwork,OW),居世界首位。过劳死已成为我国现阶段非常严重的社会问题之一,亟待社会学和医学层面的系统研究[2]。既往研究表明,OW状态引起猝死的主要原因是心脑血管疾病,如脑出血、脑梗死、心肌梗死等[3];OW状态增加体内儿茶酚胺和皮质醇的分泌,导致动脉粥样硬化的进展、心血管疾病和脑卒中的风险增加[4],且长时间工作与中风具有明显的剂量-反应关系[5]。对青年猝死者进行法医学检查时,在其脑血管、冠状血管及主动脉上升部均可发现明显的形态学改变[6],表现为血管壁结缔组织紊乱、扭曲或结缔组织成分置换的改变[7],以细胞外基质(extracellular matrix,ECM)结构排列紊乱与ECM的沉积为着。ECM的异常沉积或成分改变会使血管壁发生重塑,血管重塑是对衰老和血管疾病相关的各种病理生理变化的适应性反应,血管重塑与心脑血管疾病的发展进程密切相关[8- 9]。本研究拟建立大鼠OW模型[10],检测OW对大鼠动脉壁病理、基质金属蛋白酶(matrix metalloproteinase,MMP)相关基因、组织金属蛋白酶抑制剂(tissueinhibitor of metalloproteinase,TIMP)相关基因与Ⅰ型胶原纤维(collagen 1,Col- 1)基因、蛋白的影响,探讨OW引起血管病变的可能性。
材料和方法
动物与分组健康清洁级成年雄性Sprague-Dawley大鼠18只,体重180~220 g,由兰州大学实验动物中心提供,采用随机数字分组法分为3组:对照组、OW组、睡眠限制(sleep deficiency,SD)+OW组,每组6只。SD+OW组的设立用于观察在OW的基础上,相对较少的睡眠时间是否可以进一步加重动脉血管壁的变化,睡眠时间限制的方法使动物模型更接近于人类的工作状态。实验于兰州大学实验动物中心进行,实验前适应性饲养1周,饲养室温24 ℃、湿度45%~65%,喂食标准饲料,自由摄食水。
主要试剂与材料Masson改良三色染色试剂盒、EVG染色试剂盒均购自北京索莱宝公司,二步法免疫组织化学法检测试剂盒购自北京中杉金桥生物公司,兔抗Ⅰ型胶原蛋白多克隆抗体购自中国武汉三鹰生物有限公司,台式高速冷冻型微量离心机为中国大龙兴创实验仪器有限公司生产,荧光定量PCR仪、超微量分光光度计均为美国赛默飞世尔科技公司生产,超净工作台为中国苏净安泰公司生产,光镜为日本奥林巴斯公司生产,透射电镜为日本电子株式会社公司生产。
模型制作与处理采取强迫游泳实验(forced swimming test,FST)建立过劳模型,FST是指将大鼠放入水中,大鼠试图通过游泳离开水域,直至力竭的方法;本研究当大鼠完全潜入水中(鼻尖低于水平面)超过10 s不能自行浮出水面的情况连续出现3次或捞出后大鼠翻正反射消失即为完成1次FST。对照组大鼠在鼠笼中自由活动,随意饮食,无特殊处理;OW组大鼠每日完成FST 2次,其余条件同对照组,连续15 d;SD+OW组大鼠每日完成FST 2次,在两次游泳之间大鼠被放入水上平台(水中平台装置为一35 cm×40 cm×60 cm的水槽,其内有数个高约12 cm、直径约4 cm的圆柱形平台,水深约10 cm),时长为6 h,随意饮食,连续15 d。连续15 d完成FST的大鼠即认为造模成功。第16天,用戊巴比妥钠(1%溶液,6 μl/g,腹腔注射)麻醉大鼠,心脏取血5 ml后迅速摘取5 cm腹主动脉和1 cm颈总动脉后进行相关指标检测。
血管壁病理形态学检查取部分腹主动脉,在磷酸盐缓冲液中将血管外周结缔组织剥离干净,放入4%多聚甲醛固定7 d,乙醇梯度脱水,石蜡垂直定向包埋,每段血管间断均匀切取6片。Masson染色:取6片切片严格按试剂盒说明书行Masson染色,光镜下观察胶原纤维染色,后用Image J病理图像分析系统定量胶原纤维含量百分比[11];EVG染色:在磷酸盐缓冲液中剥离颈总动脉外结缔组织,放入4%多聚甲醛固定7 d,乙醇梯度脱水,石蜡垂直定向包埋,每段血管均匀切取6片进行EVG弹性纤维染色,光镜下观察动脉壁弹性纤维染色,用于判断弹性纤维的完整性及结构排列,后用Image J病理图像分析系统定量弹性纤维含量百分比。
透射电镜观察腹主动脉壁超微结构取部分腹主动脉,在PBS缓冲液中将血管外周结缔组织剥离干净,用2.5%戊二醛、1%锇酸双重固定,环氧树脂包埋,超薄切片机切片(70 nm),醋酸铀、柠檬酸铅染色后在透射电镜下观察血管壁超微结构的改变、血管平滑肌细胞(vascular smooth muscle cell,VSMC)与ECM的连接及弹性纤维层的形态结构和完整性。
免疫组织化学法定量分析腹主动脉Col- 1蛋白表达取部分腹主动脉石蜡垂直定向包埋后,石蜡切片机均匀切片,每片厚约4 μm;60 ℃烤片过夜;脱蜡水化;微波抗原修复;冷却至室温后每张切片滴加一抗50 μl(兔抗Ⅰ型胶原蛋白多克隆抗体,稀释浓度1∶200),4 ℃孵育过夜;然后按PV- 9000二步法检测试剂盒滴加二抗,37 ℃温育30 min;二氨基联苯胺显色,苏木素复染,脱水与透明后封片,封片后光镜下观察。光镜下可见阳性表达呈棕黄色点状或纤维状染色,棕黄色面积大小可以代表蛋白表达含量的多少;每张切片选择5个不同视野进行拍照,用Image-Pro J图像分析软件测量阳性染色积分光密度(integrated optical density,IOD)值以及阳性染色面积,并计算平均IOD值(mean integral optical density,MOD)(MOD=IOD/目标分布区域面积)以反映Col- 1蛋白的表达强度。
腹主动脉中MMP、TIMP、Col- 1基因表达水平测定取部分腹主动脉,在PBS缓冲液中将血管外周结缔组织剥离干净,吸干血管壁表面水分备用,取匀浆管,加入1 ml的RNA提取液,置冰上预冷,取100 mg组织,加入到匀浆管中,匀浆仪充分研磨直至无可见组织块,使用离心半径为8 cm的离心机,12 000 r/min离心10 min取上清;将浓度过高的RNA进行适当比例的稀释,使其终浓度为200 mg/L;配置反转录反应体系后与提取RNA轻轻混匀后离心,设置反转录程序(25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 s);后将每个反转录产物配置3管,进行PCR扩增;扩增结果使用ΔΔCT法处理,表达倍数=2-ΔΔCT。最终计算得出的表达倍数反映血管壁中相关基因的表达水平。
统计学处理运用SPSS 25.0统计软件进行统计分析,将数据进行正态性检验,符合正态分布的数据以均数±标准差表示,多组间比较采用ANOVA单因素方差分析,非正态分布的数据以M(P25,P75)表示,多组间比较采用Kruskal Wallis秩和检验,用Bonferroni检验校正显着性水平进行组间比较,P<0.05为差异有统计学意义。
结 果
腹主动脉胶原纤维结构及含量变化对照组可见排列整齐的蓝色胶原纤维,胶原纤维间可见粉色的血管平滑肌细胞;与对照组相比,OW组与SD+OW组胶原纤维排列结构无明显变化,血管壁中层厚度增加(图1)。Image J图像软件定量分析显示, 对照组胶原纤维面积为(47.64±5.98)%,OW组为(45.27±8.65)%,SD+OW组为(43.83±4.75)%,3组中膜胶原纤维含量差异无统计学意义(P>0.05)。
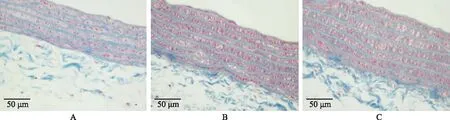
OW:过度劳累;SD:睡眠限制
颈总动脉弹性纤维结构及含量变化血管壁染色后弹性纤维呈黑色,胶原纤维呈粉红色,各弹性板层间可见散在的弹性纤维;与对照组相比,OW组与SD+OW组弹性纤维断裂和紊乱,合并有血管壁中层厚度增加;SD+OW组弹性板层结构紊乱,弹性纤维排列杂乱无序,VSMC细胞间散在的弹性纤维减少,且弹性板层变薄(图2);Image J图像软件定量分析显示,对照组弹性纤维面积为(19.62±2.70)%,OW组为(13.23±1.65)%,SD+OW组为(13.25±1.57)%;与对照组相比,OW组与SD+OW组弹性纤维含量均显着下降(P均<0.001),OW组与SD+OW组比较差异无统计学意义(P>0.05)。

←:弹性板层
透射电镜下腹主动脉的超微结构与对照组相比,OW组、SD+OW组可见弹性纤维断裂、腹主动脉管壁厚度增加、VSMC紊乱、ECM排列结构紊乱;在SD+OW组腹主动脉观察到虫蛀样或海绵状的碎裂纤维的外观,在同一血管横截面的不同区域,纤维破碎和混乱的严重程度不同。此外,观察到平滑肌细胞与ECM纤维连接减少(图3)。
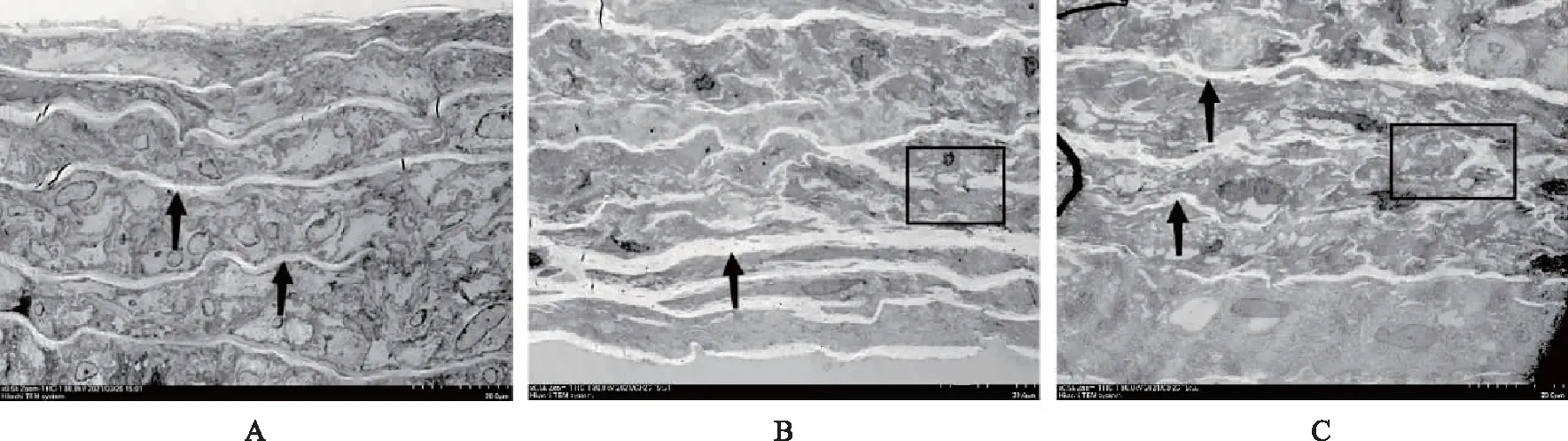
←:弹性纤维;:断裂的纤维及海绵状的碎裂纤维
血管壁Col- 1的表达实时荧光定量PCR显示,对照组Col- 1的mRNA表达量为1.00±0.03,OW组为0.85±0.02,SD+OW组为0.82±0.02;与对照组相比,OW组、SD+OW组Col- 1 mRNA表达水平均显着下降(P均<0.001);OW组与SD+OW组Col- 1 mRNA表达差异无统计学意义(P>0.05)。与对照组相比,OW组和SD+OW组黄染颗粒面积明显减少(图4)。定量分析显示,对照组MOD值为0.33±0.04,OW组为0.30±0.02,SD+OW组为0.28±0.05;与对照组相比,OW组、SD+OW组Col- 1蛋白含量均显着下降(P均<0.001);OW组与SD+OW组Col- 1蛋白表达差异无统计学意义(P>0.05)。
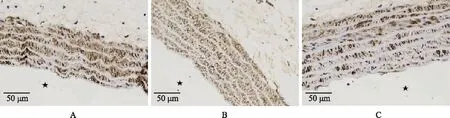
Col- 1:Ⅰ型胶原蛋白;★:管腔侧
MMP与TIMP的基因表达与对照组相比,OW组、SD+OW组MMP- 1(P均<0.001)、MMP- 2(P均<0.001)的mRNA表达均显着增加,OW组与SD+OW组MMP- 1、MMP- 2的 mRNA表达差异均无统计学意义(P均>0.05);3组MMP- 9、TIMP- 1的mRNA表达差异均无统计学意义(P均>0.05)(图5)。
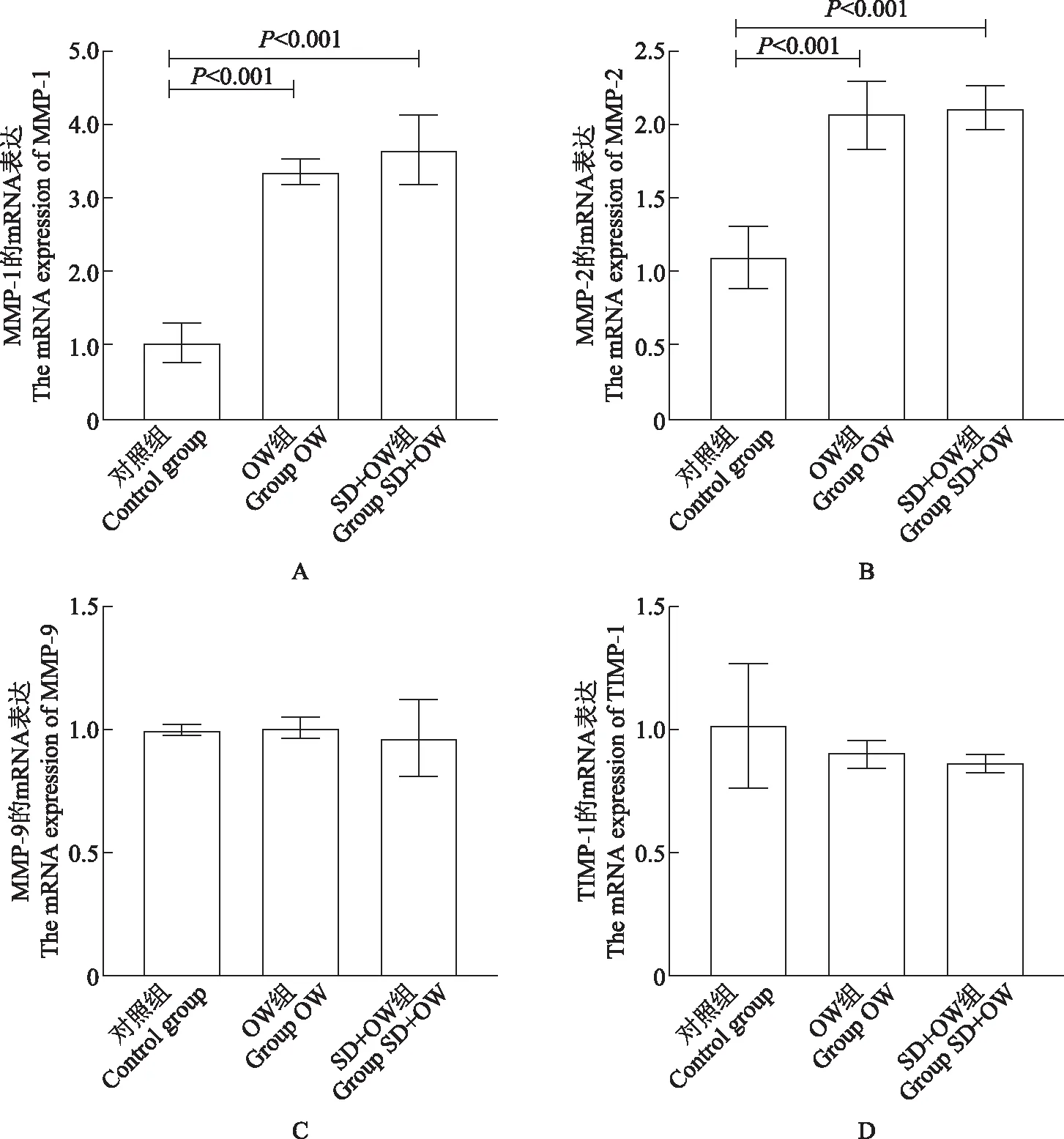
MMP:基质金属蛋白酶;TIMP- 1:组织金属蛋白酶抑制剂- 1
讨 论
OW引起猝死的病理机制目前尚无研究定论。本研究采用FST建立过劳模型[10],模拟人类长期工作并间断处于应激反应的状态;同时结合水中平台装置限制大鼠的睡眠时间,使模型更加贴近人们日常的生活状态。目前中国公民人均预期寿命是77.3年,正常大鼠寿命2~3年,实验造模周期共15 d,造模时长相当于人类连续处于OW工作状态1年左右。第16天造模结束,可见OW大鼠毛发失去光泽、毛发稀疏,同时伴有神情淡漠与精神状态欠佳,认为造模成功[10]。
本研究结果显示,OW使大鼠颈总动脉弹性纤维含量下降,血管壁的弹性板层变薄;腹主动脉血管壁发生纤维断裂,ECM失去正常的排列顺序。OW使大鼠腹主动脉Col- 1的mRNA表达和蛋白表达下降。OW使大鼠腹主动脉MMP- 1、MMP- 2的mRNA表达增加。MMP的增加会引起Col- 1和弹性纤维的降解,破坏血管壁ECM的动态平衡。研究表明在OW等因素作用下,动脉血管ECM的完整性会遭到破坏,从而血管壁的稳定性下降。
大中动脉的血管壁分为3层:内膜、中膜及外膜,主要组成成分有内皮细胞、平滑肌细胞和ECM[12]。内膜连接血管腔,中膜由内、外弹性层与内膜、外膜隔开,主要由呈圆周排列的VSMC、胶原蛋白和弹性蛋白组成;中膜是血管壁的主要组成部分,是机械顺应性的主要决定因素,外膜由胶原体ECM、成纤维细胞、血管周神经、淋巴管、血管和炎症细胞组成[13]。中、大动脉血管壁中含量最多的ECM为胶原纤维和弹性纤维,二者在血管壁的结构支撑、机械性能与生化性能中发挥着不可或缺的作用。
ECM的合成与降解处于动态平衡中,MMP可降解ECM中所有的蛋白,正常生理条件下,MMP的生理活性很低,并在4个水平上受到调节,包括转录水平基因表达的调控、合成与分泌调节、酶原的激活及TIMP的调节;TIMP是多功能分子,不仅调控MMP活性,且具有细胞生长因子样作用,促进成纤维细胞增生及胶原合成,使ECM沉积并抑制其降解[14]。为了研究血管壁中ECM的变化,本研究检测血管壁含量最多的Col- 1以及在调控ECM合成降解中发挥重要作用的MMP与TIMP;MMP- 1为胶原酶的一种,主要作用底物为Ⅰ~Ⅲ型胶原纤维、纤维连接蛋白及层粘连蛋白;MMP- 2和MMP- 9属于明胶酶一类,主要作用底物为Ⅵ、Ⅴ、Ⅶ型胶原纤维和纤维连接蛋白、层粘连蛋白、弹性蛋白[15]。
细胞外基质降解被认为是导致血管壁结构完整性和机械性能破坏最重要的机制,MMP是这一过程的关键因素。主动脉壁MMP主要来源于巨噬细胞、单核细胞和内侧VSMC[16]。长时间工作会使人体处于一个慢性应激状态,应激会使体内的氧化应激产物及炎性因子增多,同时增加肾素-血管紧张素系统的活性[17],白细胞介素- 2、白细胞介素- 6、肿瘤坏死因子-α等促炎症因子和血管紧张素Ⅱ的增加会对细胞外基质产生影响[18];在氧化应激产物及炎性因子的刺激作用下,内侧平滑肌细胞和巨噬细胞分泌MMP增加[19],从而加剧细胞外基质的降解,使ECM原有的排列结构与机械性能遭到破坏;有文献显示炎性因子浸润血管壁可以促进ECM中弹性纤维和胶原纤维的降解,从而促进腹主动脉瘤的发生和发展[16]。正常血管壁中,在MMP含量升高时,会同时激活TIMP,TIMP生成增加后结合MMP,使MMP活性下降,从而减少ECM的降解,以调控ECM降解与合成,达成一种新的动态平衡,即ECM重塑。伴随这种ECM的重塑,血管壁细胞的生物学行为、血管壁形态和功能均会发生改变。
本研究同时探讨了OW状态下限制睡眠时间是否加重血管壁的损伤。结果显示SD联合OW与单纯OW大鼠的检测指标差异无统计学意义,表明相对减少的睡眠时间并未加重OW造成的血管壁损伤。
本研究的局限性在于仅对腹主动脉与颈总动脉进行了检测观察,未进一步观察主要器官内的动脉变化;MMP与TIMP是调节细胞外基质稳态的重要系统,该研究仅检测mRNA水平的表达,未检测其蛋白表达水平及功能活性,不能全面评估动脉血管壁ECM的变化。
综上,OW可造成动脉血管壁ECM中MMP- 1、MMP- 2的mRNA表达增加,Col- 1与弹性纤维的降解增多、含量减少,ECM合成与分解的动态平衡遭到破坏,加速血管壁ECM重塑,造成血管壁稳定性下降,这可能是OW引起的血管病变的病理基础。



