戚燕 张荣强 张灵芝 李晶 陈雪芹 付国涛 李灵兰 李秀芹

摘要:目的 探讨硒蛋白基因在人类免疫缺陷病毒(HIV)感染及其母婴传播中的表达水平,为艾滋病的预防及诊疗提供新的理论依据。方法 在基因表达数据库检索下载数据集GSE4124,样本由HIV阳性组(n=25)和对照组(n=20)构成,其中HIV阳性组包括母婴传播(TR)组(n=11)和非母婴传播(NTR)组(n=14);采用t检验分析4组(HIV阳性组比对照组、NTR组比对照组、TR组比对照组、TR组比NTR组)硒蛋白基因表达水平的差异;随后采用单因素和多因素Logistic回归分析差异表达基因对HIV感染和母婴传播的影响;应用R语言构建列线图预测模型并验证其效能。结果 与对照组比较,HIV阳性组、NTR组、TR组分别有8、5、8个差异表达硒蛋白基因为下调基因;与NTR组比较,TR组有4个差异表达硒蛋白基因为下调基因。单因素Logistic回归分析显示,GPX1、GPX3、GPX4、TXNRD1、TXNRD3、SEPHS2基因异常高表达对HIV感染均具有影响,而对母婴传播无影响作用。多因素Logistic回归分析显示,TXNRD3基因的异常高表达与是否HIV感染呈正相关(OR=0.032,95%CI= 0.002~0.607,P =0.022)。列线图预测模型的预测效能显示,HIV感染者生存时间1、3年的受试者工作特征曲线下面积分别为0.840(95%CI=0.690~1.000)和0.870(95%CI=0.730~1.000)。结论 多个硒蛋白基因差异表达水平下调,参与调控HIV感染和母婴传播过程;其中,TXNRD3基因异常高表达与是否HIV感染呈正相关,为艾滋病防治、诊疗提供了新思路。
关键词:硒蛋白基因;人类免疫缺陷病毒;母婴传播;Logistic回归;列线图
中图分类号: R183.9文献标志码: A文章编号:1000-503X(2023)04-0563-08
DOI:10.3881/j.issn.1000-503X.15569
A Prediction Model for Human Immunodeficiency Virus Infection and Mother-to-Child
Transmission Based on the Expression Levels of Selenoprotein Genes
QI Yan1,ZHANG Rongqiang1,ZHANG Lingzhi2,LI Jing1,CHEN Xueqin1,
FU Guotao1,LI Linglan1,LI Xiuqin3
1Department of Epidemiology and Health Statistics,School of Public Health,Shaanxi University of
Chinese Medicine,Xianyang,Shaanxi 712046,China
2Department of Laboratory Medicine,The Second Hospital of Hanbin District,Ankang,Shaanxi 725021,China
3Department of Public Administration,School of Humanities and Management,Shaanxi University of
Chinese Medicine,Xianyang,Shaanxi 712046,China
Corresponding author:LI Xiuqin Tel:029-38185218,E-mail:lixiuqin2000@163.com
ABSTRACT:Objective To study the expression of selenoprotein genes in human immunodeficiency virus(HIV)infection and its mother-to-child transmission,so as to provide a theoretical basis for the prevention,diagnosis,and treatment of acquired immunodeficiency syndrome.Methods The dataset GSE4124 was downloaded from the Gene Expression Omnibus(GEO).Two groups of HIV-positive mothers(n=25)and HIV-negative mothers(n=20)were designed.HIV-positive mothers included a subset of transmitter(TR)mothers(n=11)and non-transmitter(NTR)mothers(n=14).Then,t-test was carried out to compare the expression levels of selenoprotein genes between the four groups(HIV-positive vs. HIV-negative,NTR vs. HIV-negative,TR vs. HIV-negative,TR vs. NTR).Univariate and multivariate Logistic regression were adopted to analyze the effects of differentially expressed genes on HIV infection and mother-to-child transmission.R software was used to establish a nomogram prediction model and evaluate the model performance.Results Compared with the HIV-negative group,HIV-positive,NTR,and TR groups had 8,5 and 8 down-regulated selenoprotein genes,respectively.Compared with the NTR group,the TR group had 4 down-regulated selenoprotein genes.Univariate Logistic regression analysis showed that abnormally high expression of GPX1,GPX3,GPX4,TXNRD1,TXNRD3,and SEPHS2 affected HIV infection and had no effect on mother-to-child transmission.The multivariate Logistic regression analysis showed that the abnormally high expression of TXNRD3(OR=0.032,95%CI=0.002-0.607,P=0.022)was positively correlated with HIV infection.As for the nomogram prediction model,the area under the receiver-operating characteristic curve for 1-year survival of HIV-infected patients was 0.840(95%CI=0.690-1.000),and that for 3-year survival of HIV-infected patients was 0.870(95%CI=0.730-1.000).Conclusions Multiple selenoprotein genes with down-regulated expression levels were involved in the regulation of HIV infection and mother-to-child transmission.The abnormal high expression of TXNRD3 was positively correlated with HIV infection.The findings provide new ideas for the prevention,diagnosis,and treatment of acquired immunodeficiency syndrome.
Key words:selenoprotein gene;human immunodeficiency virus;mother-to-child transmission;Logistic regression;nomogram
Acta Acad Med Sin,2023,45(4):563-570
硒是一种人体必需的微量元素,它与人类健康、疾病的许多方面有关。有研究表明在新型冠状病毒感染疾病中,人体液中硒含量低与重症监护病房住院感染患者预后不良之间存在关联[1]。而硒蛋白常与免疫功能和病毒或细菌引起的传染病相关[2-8]。当机体硒含量缺乏时,会改变病毒的基因组,使正常良性或轻度致病性的病毒变得高毒性,这种现象在流行性感冒和柯萨奇病毒的动物模型中得到证明[9-10],但尚未在其他病毒模型中进行研究。硒的有益作用大多归因于它以硒代半胱氨酸的形式存在人体内,与抗氧化防御、氧化还原稳态、氧化还原信号传导及参与其他细胞反应过程有关[11]。
人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者长期处于慢性氧化应激状态,营养缺乏较多,尤其是硒含量的缺乏[8]。而硒含量缺乏可能会进一步削弱免疫系统的功能从而加剧病情的恶化,导致CD4 T细胞计数降低、艾滋病进展更快以及死亡风险增加[5,7]。研究表明硒蛋白可调节M1巨噬细胞,影响NK细胞的细胞毒性、活性以及T细胞的增殖[12]。高血清硒含量者一般都具有较低的病毒载量,他们会相应减少抗逆转录病毒疗效[13-14]。至今尚无统一的指南明确给出HIV感染者硒相关的膳食补充建议。随着HIV感染者数量的增加,感染HIV的女性患者渴望妊娠的需求也在增加。但HIV可通过胎盘、产道或母乳、唾液等途径传播给婴儿,故母婴传播成为儿童感染HIV的主要途径[15]。研究显示如果对HIV感染孕产妇不采取任何干预措施,33%~35%的女性会发生HIV母婴传播[16]。目前,关于硒蛋白基因与HIV感染和母婴传播的相关研究较少,本研究通过了解硒蛋白基因在HIV感染和母婴传播中的表达水平,探索硒蛋白基因在人体内的差异表达,为艾滋病的预防及诊疗提供新的理论依据。
资料和方法
资料来源 在美国国立生物技术信息中心的基因表达数据库(Gene Expression Omnibus,GEO)(http://www.ncbi.nlm.nih.gov)中,以2022年11月为时间截点,将“HIV”作为筛选条件,物种 “human” 检索,筛选GEO数据库中芯片数据集。HIV人群研究数据集GSE4124共包含12 824个基因的表达谱,共检测硒蛋白16种。样本由HIV阳性组(n=25)和对照组(n=20)构成。其中,HIV阳性组包括母婴传播(transmitter mothers,TR)组(n=11)和非母婴传播(nontransmitter mothers,NTR)组(n=14)。
差异表达基因的筛选 GEO中的原始数据集使用RMA算法进行背景校正、标准化及表达值计算;处理后数据以|log2FC|>1.5和P<0.003(Bonferroni校正)作为筛选标准,确保后续分析结果的准确性和可靠性。运用Graphpad Prism 9.2.0绘制4组(HIV阳性组比对照组、NTR组比对照组、TR组比对照组、TR组比NTR组)差异基因表达的小提琴图。通过Venny 2.1.0软件(https://bioinfogp.cnb.csic.es/tools/venny)绘制4组硒蛋白差异表达基因的韦恩图。
统计学处理 运用软件SPSS 26.0进行统计分析,利用R软件包p ROC(版本1.17.0.1)建立具有适当预测能力的列线图模型。列线图的预测性能通过受试者工作特征曲线下面积及校准图进行综合评估。P <0.05为差异有统计学意义。
结果
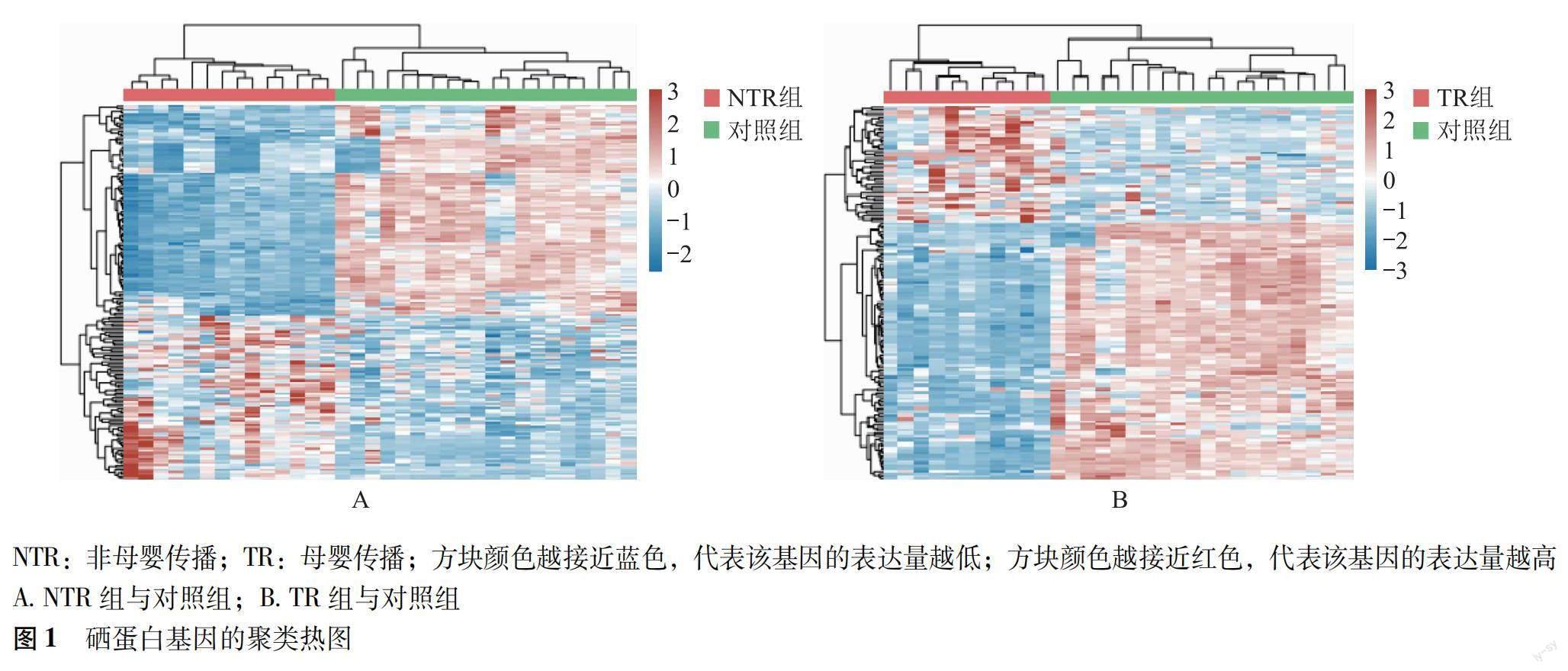
硒蛋白基因的表达水平 将数据进行标准化处理后,各样本基因表达数据均数基本稳定,数据质量良好、可靠,聚类热图显示:硒蛋白基因在NTR、TR组与对照组间的表达水平不同,存在差异(图1)。
筛选差异表达基因 4组硒蛋白差异表达基因的小提琴图显示,与对照组比较,HIV阳性组获得8个差异表达硒蛋白基因:GPX1、GPX3、GPX4、TXNRD1、TXNRD2、TXNRD3、SELENOW、SEPHS2;NTR组获得5个基因:GPX4、TXNRD2、SELENOF、SELENOW、SEPHS2;TR组获得8个基因:GPX1、GPX4、TXNRD1、TXNRD2、SELENOH、SELENOW、SELP、SEPHS2,且均为下调基因。与NTR组比较,TR组获得4个差异表达硒蛋白基因:GPX4、TXNRD2、SELENOH、SELENOW,且均为下调基因(图2)。
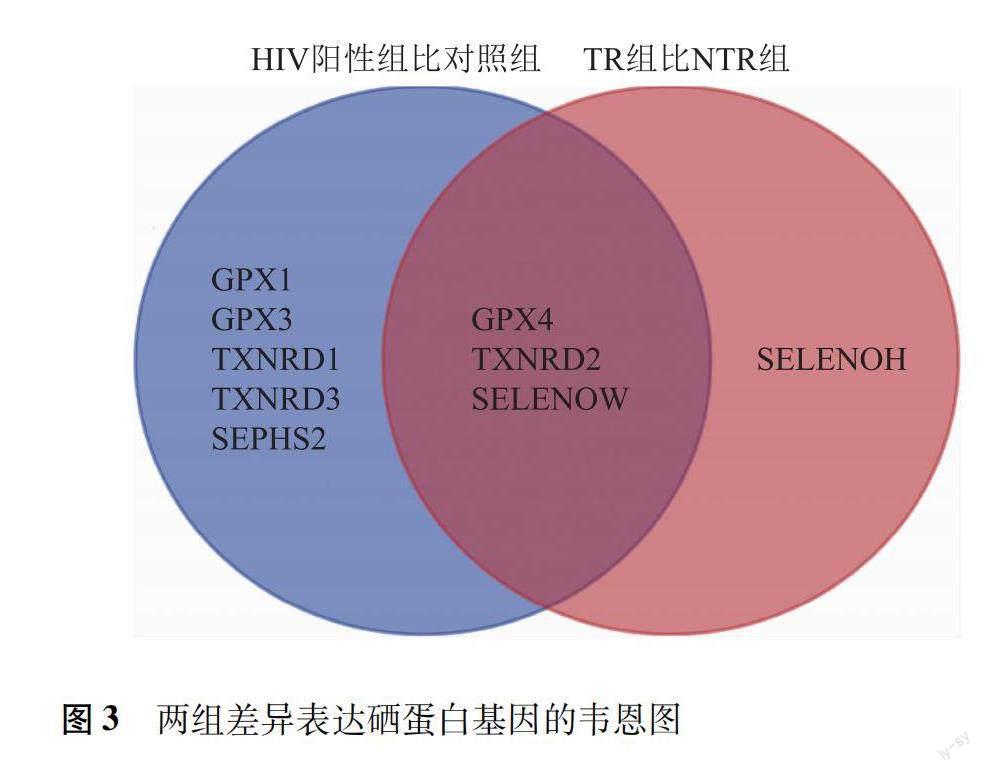
HIV感染和母婴传播中差异表达的硒蛋白基因的韦恩图显示,与对照组比较,HIV阳性组筛选出与HIV感染可能有关的差异表达基因8个(GPX1、GPX3、GPX4、TXNRD1、TXNRD2、TXNRD3、SELENOW、SEPHS2);与NTR组比较,TR组筛选出与是否母婴传播可能有关的差异表达基因4个(GPX4、TXNRD2、SELENOH、SELENOW)。在HIV感染和母婴传播间可能有交互作用的硒蛋白基因3个(GPX4、TXNRD2、SELENOW);可能对HIV感染具有独立影响的差异表达基因5个(GPX1、GPX3、TXNRD1、TXNRD3、SEPHS2);可能对母婴传播具有独立影响的差异表达基因1个(SELENOH)(图3)。
单因素Logistics回归分析结果 以中位数为截断值把差异基因的表达水平分为低表达组和高表达组,将韦恩图获得的与HIV感染可能有关的差异表达基因(GPX1、GPX3、GPX4、TXNRD1、TXNRD2、TXNRD3、SELENOW、SEPHS2)分别作自变量,HIV是否感染作为因变量,采用单因素Logistic回归,分析差异表达硒蛋白基因对HIV感染的影响,结果显示GPX1、GPX3、GPX4、TXNRD1、TXNRD3、SEPHS2差异基因表达水平的异常高表达与是否HIV感染呈正相关(图4)。将与HIV感染可能有关的NTR:非母婴传播;TR:母婴传播;方块颜色越接近蓝色,代表该基因的表达量越低;方块颜色越接近红色,代表该基因的表达量越高差异表达基因(GPX4、TXNRD2、SELENOH、SELENOW)分别作为自变量,是否母婴传播作为因变量,采用单因素Logistic回归分析差异表达硒蛋白基因对HIV感染的影响,结果显示GPX4、TXNRD2、SELENOH、SELENOW差异基因表达水平与是否HIV感染无相关性。
多因素Logistics回归分析结果 将单因素Logistic回归结果中差异有统计学意义的硒蛋白基因(GPX1、GPX3、GPX4、TXNRD1、TXNRD3、SEPHS2)纳入多因素Logistic回归模型方程,韦恩图中心可能有交互作用的硒蛋白基因(GPX4、TXNRD2、SELENOW)作为协变量探讨交互作用,方法为:向后,有条件。结果显示TXNRD3基因的异常高表达与是否HIV感染呈正相关(OR=0.032,95%CI= 0.002~0.607,P=0.022)(表1)。
构建及验证列线图模型 HIV感染者差异表达硒蛋白基因构建了生存时间列线图模型(图5),利用p ROC的受试者工作特征曲线进行1、3年时间点的受试者工作特征分析,结果显示HIV感染者生存时间1、3年的受试者工作特征曲线下面积分别为0.840(95%CI=0.690~1.000)和0.870(95%CI=0.730~1.000)(图6)。通过图形校正对列线图进行效果评价,结果显示列线图预测HIV感染者1年生存时间的预测校准曲线贴近标准曲线,说明基于HIV感染者差异表达硒蛋白基因所构建的列线图的预测能力较高(图7)。
讨论
当机体感染HIV后,CD4细胞受到侵犯,随着CD4细胞表达的减少,其细胞增殖所需的细胞因子也不断减少,影响CD4 T淋巴细胞的增殖[17]。所以,维持稳定的CD4细胞增殖可以维持病情长期不进展[18]。本研究应用生物信息学技术,对硒蛋白基因在女性HIV感染者及其母婴传播中的表达及预测模型进行分析,旨在为HIV感染者及其母婴传播的预防和诊疗提供依据。
数据集GSE4124中,NTR、TR组的平均血浆病毒载量分别为(4.23±0.89)、(4.70±0.68)copies/ml[19];在更具有代表性的研究中,NTR、TR组的平均血浆病毒载量分别为(4.34±0.81)、(4.78±0.69)copies/ml[20]。此外,数据集GSE4124中研究对象为居住在4个不同研究地点的平均年龄为25岁(17~44岁)的妇女,他们在居住地、年龄、临床状况或病情、胎次、剖宫产经验、母乳喂养实践或性传播疾病患病率方面,TR、NTR组和对照组间的差异均无统计学意义[19]。表明数据集 GSE4124与具有代表性的母体HIV-1感染和母婴传播研究中的病毒载量、年龄和国籍相似。通过对数据集GSE4124检测的16种硒蛋白进行差异表达分析,本研究显示多个硒蛋白基因(GPX1、GPX3、GPX4、TXNRD1、TXNRD2、TXNRD3、SELENOW、SEPHS2)在HIV感染者体内表达水平下调,表明硒蛋白基因在HIV感染者体内参与一定调控,提示补硒可能对HIV感染者有益。硒蛋白影响HIV感染者的疾病进展、调节细胞因子表达、白细胞介素2产生以及吞噬性中性粒细胞和巨噬细胞破坏抗原的能力[21]。研究显示硒营养补充剂的有益作用被报道为减少病毒载量、延缓发展为艾滋病的时间和间接增加CD4+T细胞的数量[22-24]。硒在HIV感染的早期治疗中,可通过增加体内CD4 T淋巴细胞的数量发挥一定的作用。而HIV感染者的死亡率与低硒状态有关:在HIV感染者中,低硒状态下的死亡率比足硒状态下高20倍[25]。因此,适当地补充硒有助于减缓HIV感染者疾病的进展,并对心脏机能有一定的改善作用,从而降低HIV感染者的死亡率。
硫氧还蛋白(thioredoxin,TXN)是一种小的氧化还原活性蛋白,广泛分布于各种哺乳动物组织和细胞中,用于减少氧化基团(如Cys-Cys二硫键),而TXN/TXNRD系统是调节细胞氧化还原平衡的最重要机制之一[26]。本研究显示TXNRD3基因的异常高表达与是否HIV感染呈正相关,表明TXNRD3基因在人体内异常高表达更易感染HIV,这一研究结果可以为HIV感染者的诊疗提供依据。
硒蛋白通过调节免疫细胞的迁移、增殖以及炎症相关细胞因子的分泌增强免疫系统功能。SEPHS2是调节免疫细胞功能的酶促硒蛋白之一,是硒磷酸合成酶家族,催化还原硒的化合物,使三磷酸腺苷生成磷酸硒,参与硒蛋白的合成,其作用是为硒代半胱氨酸的生物合成提供活性硒供体磷酸硒[27]。作为一种自我调节因子,SEPHS2调节硒磷酸盐的产生和硒蛋白的生物合成,进而参与调节人体的各项机能。虽然流行病学研究表明硒与HIV感染有关,但仍然缺乏细胞和分子实验证据阐明硒在病毒感染中的作用。
目前,关于硒蛋白对HIV母婴传播的独立影响作用具有较大争议。本研究显示差异表达硒蛋白基因(GPX4、TXNRD2、SELENOH、SELENOW)在母婴传播的围产期妇女中低表达,提示4种低表达硒蛋白基因可能是HIV母婴传播的影响因素。但本研究在探讨硒蛋白基因对母婴传播的独立影响作用中,未发现对母婴传播有影响的硒蛋白基因。有研究显示,与硒含量充足(≥85 μg/L)的妇女相比,缺乏硒含量(<85 μg/L)的妇女在生殖道传播HIV的可能性几乎高3倍,从而增加了将病毒传播给后代的机会[28]。然而,另一项研究显示,HIV阳性母亲补充硒可降低低体重儿的风险但会增加胎儿的死亡风险[29]。而未服用抗逆转录病毒药物的哺乳期妇女,硒补充剂增加了母乳中检测到的HIV含量,表明硒可能会增加HIV母婴传播的风险。因此,HIV阳性母亲最好避免补充硒,直到有明显的优势[30]。
本研究构建了列线图预测模型,对HIV感染者生存时间的曲线下面积、特异度及敏感度的预测均较高,表明该模型具有较高的预测价值,可运用于HIV感染者生存时间的预测。但本研究也存在以下不足:对硒蛋白基因进行Logistic回归的过程中,显示置信区间变异范围很大,差异表达基因的95%置信区间较宽,精度较低,可能为本研究使用数据集GSE4124样本含量的限制、该数据集研究对象的变异、标本血清处理过程不当等。可通过增加对HIV阳性围产期妇女的随访、加大样本含量等方法改善研究。
综上,本研究显示多个硒蛋白在HIV感染者和母婴传播者体内低表达,参与调控人体内的免疫功能。其中,TXNRD3基因的异常高表达与是否HIV感染呈正相关,这为艾滋病防治提供了新思路。
参 考 文 献
[1]Schomburg L.Selenium deficiency due to diet,pregnancy,severe illness,or COVID-19-A preventable trigger for autoimmune disease[J].Int J Mol Sci,2021,22(16):8532.DOI:10.3390/ijms22168532.
[2]Kamwesiga J,Mutabazi V,Kayumba J,et al.Effect of selenium supplementation on CD4+ T-cell recovery,viral suppression and morbidity of HIV-infected patients in rwanda:a randomized controlled trial[J].AIDS,2015,29(9):1045-1052.DOI:10.1097/QAD.0000000000000673.
[3]Baum MK,Campa A,Lai S,et al.Effect of micronutrient supplementation on disease progression in asymptomatic,antiretroviral-naive,HIV-infected adults in Botswana:a randomized clinical trial[J].JAMA,2013,310(20):2154-2163.DOI:10.1001/jama.2013.280923.
[4]Hurwitz BE,Klaus JR,Llabre MM,et al.Suppression of human immunodeficiency virus type 1 viral load with selenium supplementation:a randomized controlled trial[J].Arch Intern Med,2007,167(2):148-154.DOI:10.1001/archinte.167.2.148.
[5]Bogden JD,Oleske JM.The essential trace minerals,immunity,and progression of HIV-1 infection[J].Nutr Res,2007,27(2):69-77.DOI:org/10.1016/j.nutres.2007.01.002.
[6]de Menezes Barbosa EG,Júnior FB,Machado AA,et al.A longer time of exposure to antiretroviral therapy improves selenium levels[J].Clin Nutr,2015,34(2):248-251.DOI:10.1016/j.clnu.2014.03.012.
[7]Pitney CL,Royal M,Klebert M.Selenium supplementation in HIV-infected patients:is there any potential clinical benefit[J].J Assoc Nurses AIDS Care,2009,20(4):326-333.DOI:10.1016/j.jana.2009.03.006.
[8]Guillin OM,Vindry C,Ohlmann T,et al.Selenium,selenoproteins and viral infection[J].Nutrients,2019,11(9):2101.DOI:10.3390/nu11092101.
[9]Beck MA,Levander OA,Handy J.Selenium deficiency and viral infection[J].J Nutr,2003,133(5 Suppl 1):1463S-1467S.DOI:10.1093/jn/133.5.1463S.
[10]Beck MA,Nelson HK,Shi Q,et al.Selenium deficiency increases the pathology of an influenza virus infection[J].FASEB J,2001,15(8):1481-1483.DOI:10.1097/00042560-199708150-00007.
[11]Labunskyy VM,Hatfield DL,Gladyshev VN.Selenoproteins:molecular pathways and physiological roles[J].Physiol Rev,2014,94(3):739-777.DOI:10.1152/physrev.00039.2013.
[12]Avery JC,Hoffmann PR.Selenium,selenoproteins,and immunity[J].Nutrients,2018,10(9):1203.DOI:10.3390/nu10091203.
[13]Burbano X,Miguez-Burbano MJ,McCollister K,et al.Impact of a selenium chemoprevention clinical trial on hospital admissions of HIV-infected participants[J].HIV Clin Trials,2002,3(6):483-491.DOI:10.1310/A7LC-7C9V-EWKF-2Y0H.
[14]Shor-Posner G,Miguez M,Pineda LM,et al.Impact of selenium status on the pathogenesis of mycobacterial disease in HIV-1-infected drug users during the era of highly active antiretroviral therapy[J].J Acquir Immune Defic Syndr,2002,29(2):169-173.DOI:10.1097/00042560-200202010-00010.
[15]Chi BH,Mbori-Ngacha D,Essajee S,et al.Accelerating progress towards the elimination of mother-to-child transmission of HIV:a narrative review[J].J Int AIDS Soc,2020,23(8):e25571.DOI:10.1002/jia2.25571.
[16]蒲晓斌.对HIV感染的女性在孕前启动艾滋病抗病毒治疗后艾滋病母婴阻断的效果研究[J].中国社区医师,2020,36(2):59-61.DOI:10.3969/j.issn.1007-614x.2020.02.033.
[17]刘莹,刘小敏,刘俊玲,等.深圳市经性途径感染HIV/AIDS疾病进展影响因素分析[J].实用预防医学,2019,26(10):1182-1185.DOI:l0.3969/i.issn.100619,26.2019.10.008.
[18]Dyer WB,Zaunders JJ,Yuan FF,et al.Mechanisms of HIV non-progression;robust and sustained CD4+ T-cell proliferative responses to p24 antigen correlate with control of viraemia and lack of disease progression after long-term transfusion-acquired HIV-1 infection[J].Retrovirology,2008,5:112.DOI:10.1186/1742-4690-5-112.
[19]Montano M,Rarick M,Sebastiani P,et al.Gene-expression profiling of HIV-1 infection and perinatal transmission in Botswana[J].Genes Immun,2006,7(4):298-309.DOI:10.1038/sj.gene.6364297.
[20]Montano M,Russell M,Gilbert P,et al.Comparative prediction of perinatal human immunodeficiency virus type 1 transmission,using multiple virus load markers[J].J Infect Dis,2003,188(3):406-413.DOI:10.1086/376838.
[21]Barchielli G,Capperucci A,Tanini D.The role of selenium in pathologies:an updated review[J].Antioxidants(Basel),2022,11(2):251.DOI:10.3390/antiox11020251.
[22]Kamwesiga J,Mutabazi V,Kayumba J,et al.Effect of selenium supplementation on CD4+ T-cell recovery,viral suppression andmorbidity of HIV-infected patients in Rwanda:a randomized controlled trial[J].AIDS,2015,29(9):1045-1052.DOI:10.1097/QAD.0000000000000673.
[23]Baum MK,Campa A,Lai S,et al.Effect of micronutrient supplementation on disease progression in asymptomatic,antiretroviral-naive,HIV-infected adults in Botswana:a randomized clinical trial[J].JAMA,2013,310(20):2154-2163.DOI:10.1001/jama.2013.280923.
[24]Hurwitz BE,Klaus JR,Llabre MM,et al.Suppression of human immunodeficiency virus type 1 viral load with selenium supplementation:a randomized controlled trial[J].Arch Intern Med,2007,167(2):148-154.DOI:10.1001/archinte.167.2.148.
[25]Baum MK,Shor-Posner G,Lai S,et al.High risk of HIV-related mortality is associated with selenium deficiency[J].J Acquir Immune Defic Syndr Hum Retrovirol,1997,15(5):370-374.DOI:10.1097/00042560-199708150-00007.
[26]Holmgren A.Antioxidant function of thioredoxin and glutaredoxin systems[J].Antioxid Redox Signal,2000,2(4):811-820.DOI:10.1089/ars.2000.2.4-811.
[27]Xu XM,Carlson BA,Irons R,et al.Selenophosphate synthetase 2 is essential for selenoprotein biosynthesis[J].Biochem J,2007,404(1):115-120.DOI:10.1042/BJ20070165.
[28]Nwabua FI.Selenium status and birth weight in HIV positive pregnant women in lagos university teaching hospital[D].Lagos Nigeria:Faculty of Obstetrics and Gynaecology,2012.
[29]Kupka R,Mugusi F,Aboud S,et al.Randomized,double-blind,placebo-controlled trial of selenium supplements among HIV-infected pregnant women in Tanzania:effects on maternal and child outcomes[J].Am J Clin Nutr,2008,87(6):1802-1808.DOI:10.1093/ajcn/87.6.1802.
[30]Sudfeld CR,Aboud S,Kupka R,et al.Effect of selenium supplementation on HIV-1 RNA detection in breast milk of Tanzanian women[J].Nutrition,2014,30(9):1081-1084.DOI:10.1016/j.nut.2014.01.011.
(收稿日期:2023-03-09)



