于华婧 魏路阳 刘姗姗 张忠涛 管成剑

基金项目:国家自然科学基金青年科学基金(82103484、82200964)、北京市自然科学基金青年科学基金(7214218)、北京市博士后工作经费资助项目(2022-ZZ-004)、北京市教育委员会科技计划项目(KM202110025015)、北京市医院管理中心青苗计划(QMS20230116)和中国博士后科学基金面上资助(2023M732411)
摘要:目的 探究ATP柠檬酸裂合酶(ACLY)在肝细胞癌(HCC)发生发展中的作用及其对HCC免疫微环境的影响。方法 采用美国阿拉巴马大学伯明翰分校癌症数据分析网站和肿瘤基因表达谱交互分析数据库在线检索ACLY在癌症基因组图谱数据库收录的不同肿瘤中的表达情况和预后改变,选取HCC为疾病模型,分析ACLY在基因表达数据库HCC标本中的表达情况,并采集HCC患者临床标本在mRNA、蛋白水平进行表达验证;同时在细胞水平敲减ACLY,并利用转录组测序分析差异表达基因,进行细胞增殖实验等功能验证;探讨ACLY与肿瘤微环境中免疫细胞及免疫浸润的相关性,以及与免疫新抗原、免疫检查点基因的相关性。结果 ACLY基因在包括HCC在内的多种实体瘤中高表达(P均<0.05),且ACLY高表达与HCC的总体存活率具有显着相关性(P=0.005)。ACLY的高表达可影响包括肿瘤相关成纤维细胞在内的多种免疫细胞的数量以及脂代谢基因的表达(P均<0.05)。结论 ACLY与HCC的发生发展及脂代谢异常密切相关,并对HCC的免疫微环境造成一定程度的影响。
关键词:ATP柠檬酸裂合酶;肝细胞癌;肿瘤微环境;转录组测序;预后分析
中图分类号: R735.7 文献标志码: A 文章编号:1000-503X(2023)05-0743-09
DOI:10.3881/j.issn.1000-503X.15590
Expression and Clinical Significance of ATP Citrate Lyase in Hepatocellular Carcinoma
YU Huajing,WEI Luyang,LIU Shanshan,ZHANG Zhongtao,GUAN Chengjian
Department of General Surgery,National Clinical Research Center for Digestive Diseases,Beijing Friendship Hospital,Capital Medical University,Beijing 100050,China
Corresponding author:GUAN Chengjian Tel:010-63138689,E-mail:guanchengjian@mail.ccmu.edu.cn
ABSTRACT:Objective To investigate the role of ATP citrate lyase(ACLY)in the development of hepatocellular carcinoma(HCC)and the impact of this enzyme on the immune microenvironment of HCC.Methods We utilized the University of Alabama at Birmingham Cancer Data Analysis Portal and the Gene Expression Profiling Interactive Analysis to identify the changes in ACLY expression and prognosis across different tumor types from The Cancer Genome Atlas.With HCC as the disease model,we analyzed the ACLY expression in HCC samples from the gene expression database.Furthermore,we collected the clinical specimens from HCC patients to verify the mRNA and protein levels of ACLY.In addition,we conducted transcriptome sequencing after knocking down the expression of ACLY to analyze the differentially expressed genes and investigated the impact of ACLY expression interference on cell proliferation and other functions.Finally,we explored the correlations of ACLY with immune cells and immune infiltration in the tumor microenvironment,new antigens,and immune checkpoint genes.Results ACLY expression was significantly up-regulated in solid tumors including HCC(all P<0.05),and high ACLY expression was associated with overall survival rate in HCC(P=0.005).Furthermore,high ACLY expression affected the presence of immune cells(e.g.,tumor-associated fibroblasts)and the expression of genes involved in lipid metabolism(all P<0.05).Conclusions ACLY is closely related to the occurrence and development of HCC and lipid metabolism abnormalities.Moreover,it has a specific impact on the immune microenvironment of HCC.
Key words:ATP citrate lyase;hepatocellular carcinoma;tumor microenvironment;transcriptome sequencing;prognosis
Acta Acad Med Sin,2023,45(5):743-751
肝细胞癌(hepatocellular carcinoma,HCC)是全球最常见的恶性肿瘤之一,晚期HCC患者的5年总体生存率仅为10%,全球范围内每年有超过70万人因HCC死亡,并且近年来发病率有上升趋势[1]。HCC的发病率和死亡率存在显着地区差异,基于人种特异性的相关机制尚未完全阐明[2]。近年来,随着代谢组学以及免疫治疗的飞速发展,越来越多的研究表明代谢调控在包括HCC在内的多种疾病的发生发展和免疫应答中发挥关键作用[1-2]。然而HCC发生发展背后的代谢调控和免疫机制十分复杂,仍然需要研究者们进一步的探究[3-5]。ATP柠檬酸裂合酶(ATP citrate lyase,ACLY)是人体肝脏中脂肪酸和胆固醇代谢通路的核心调控酶。最新研究发现,ACLY在生物体内以不同构象的形式发挥介导乙酰辅酶A生成的关键作用,以维持细胞正常的能量代谢[6-10]。ACLY在包括HCC在内的多种癌症中表达异常,造成代谢重编程,然而ACLY引起HCC细胞代谢重编程的调控机制以及是否与肿瘤细胞免疫应答相关联还不完全清楚[11]。本研究采用生物信息学和细胞生物学的手段,探讨ACLY在HCC临床病理、转录调控、免疫微环境中的作用,旨在为临床诊治HCC开拓新的方向。
资料和方法
ACLY差异表达分析 采用美国阿拉巴马大学伯明翰分校癌症数据分析(the University of Alabama at Birmingham Cancer Data Analysis Portal,UALCAN)网站(https://ualcan.path.uab.edu/)[12-13]和肿瘤基因表达谱交互分析(Gene Expression Profiling Interactive Analysis,GEPIA)数据库(http://gepia.cancer-pku.cn/)在线检索ACLY在癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://cancergenome.nih.gov/)[14-15]收录的33种不同肿瘤中的表达情况,并找到ACLY显着差异表达的癌症种类。选取HCC为疾病模型,研究ACLY的表达与功能。采用GEPIA数据库和R语言程序,分析ACLY对HCC预后的影响情况。同时,采用基因表达数据库(Gene Expression Omnibus,GEO)(https://www. ncbi.nlm.nih.gov/geo/)收录的GSE124535及GSE144269数据子集,使用R软件分析ACLY在HCC进展中的差异表达情况,结果以箱形图呈现。
实时荧光定量PCR 采用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测HCC组织中ACLY mRNA表达水平。利用RNA抽提试剂Trizol(美国ThermoFisher公司)分别提取20对HCC患者的癌和癌旁组织的总RNA,采用RNA逆转录酶(日本Takara公司)及SYBRTM Green PCR扩增酶(美国ThermoFisher公司)进行逆转录和PCR扩增。所用引物由吉玛基因(苏州)股份有限公司合成,引物序列:ACLY上游引物:5-GGTCTCGTTGGGGTCAACC-3,下游引物5-GAA GGGCTCGATCAGAAAGTTC-3;β-actin上游引物5-TTTTGGCTATACCCTACTGGCA-3,下游引物5-CTGCACAGTCGTCAGCATATC-3。
Western blot检测 收集6对HCC患者癌和癌旁组织样本,分别采用组织匀浆的方法提取每个样本的总蛋白,SDS-PAGE分离蛋白样品,低温下转至硝酸纤维素膜上,5%脱脂牛奶封闭1 h,加入1∶1000 ACLY单克隆抗体(美国Abcam公司)封入杂交袋,4 ℃孵育过夜,等渗缓冲盐溶液洗膜3次,加入二抗室温孵育1 h,洗膜3次,采用化学发光法显影。
细胞增殖实验 将转染小干扰ACLY-1(small interfering ACLY-1,siACLY-1)、siACLY-2及阴性对照的人肝癌HepG2细胞以1×103个/孔的密度接种于96孔板中,分别培养1、2、3、4、5 d,每孔加入100 μl CCK-8试剂稀释液在37 ℃、5% CO2培养箱中孵育3 h,采用分光光度计检测490 nm波长处吸光度值,并进行数据分析。siACLY由利科丽(北京)生物科技有限公司合成,siACLY-1上游序列5-CGAGAAAGCUGA UCAAGAATT-3,下游序列5-UUCUUGAUCAGCUUUCUCGTT-3;siACLY-2上游序列5-GAGUGAAGU CGAUAAACAATT-3,下游序列5-UUGUUUAUCGA CUUCACUCTT-3。
转录组测序 将转染siACLY-1、siACLY-2及阴性对照的HepG2细胞接种于6孔板中,每组设3个重复实验,收集对数生长期细胞进行转录组测序。转录组测序委托北京诺禾致源科技股份有限公司完成。对测序数据进行过滤得到clean data用于后续分析。采用FPKM值定量转录本或基因表达水平。采用Pearson相关系数评估生物学重复相关性。采用R软件中的edgeR包对样品组间差异表达进行分析,获得差异表达基因(differentially expressed gene,DEG)集,表达量差异比以差异倍数(fold change,FC)表示。校正差异显着性P值并计算错误发现率(false discovery rate,FDR),将FC≥2且FDR<0.05设为筛选有意义的差异基因的阈值。采用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库(https://www.genome.jp/kegg/)富集siACLY相关的上调和下调通路,采用超几何检验分析通路富集的显着性。
ACLY对HCC组织免疫微环境的影响 通过Sangerbox在线分析平台(http://sangerbox.com)使用ESTMATE算法分析ACLY表达与不同肿瘤免疫浸润的关系;通过计算每个肿瘤样本的新抗原数量[16],探讨ACLY表达与抗原数量的关系。P<0.05和R>0.2为差异有统计学意义。
统计学处理 采用SPSS 26.0和Graphpad Prism 8统计软件,符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
结果
ACLY在多种肿瘤中的表达情况及预后分析 采用R软件forestplot包对TCGA数据库中食管癌、胰腺癌、胃癌、直肠腺癌、结肠癌、HCC、胆管癌7种常见消化道肿瘤患者标本的转录组测序数据和相关的临床信息进行分析,结果显示ACLY与HCC的总体存活率(overall survival,OS)具有显着的相关性(OR=1.63,95%CI=1.15~2.31,P=0.005)。采用R软件ggplot2包对ACLY在TCGA数据库不同癌和癌旁组织中mRNA的表达情况进行分析,结果显示ACLY在HCC等多种肿瘤组织中呈现高表达(P均<0.05)(图1)。
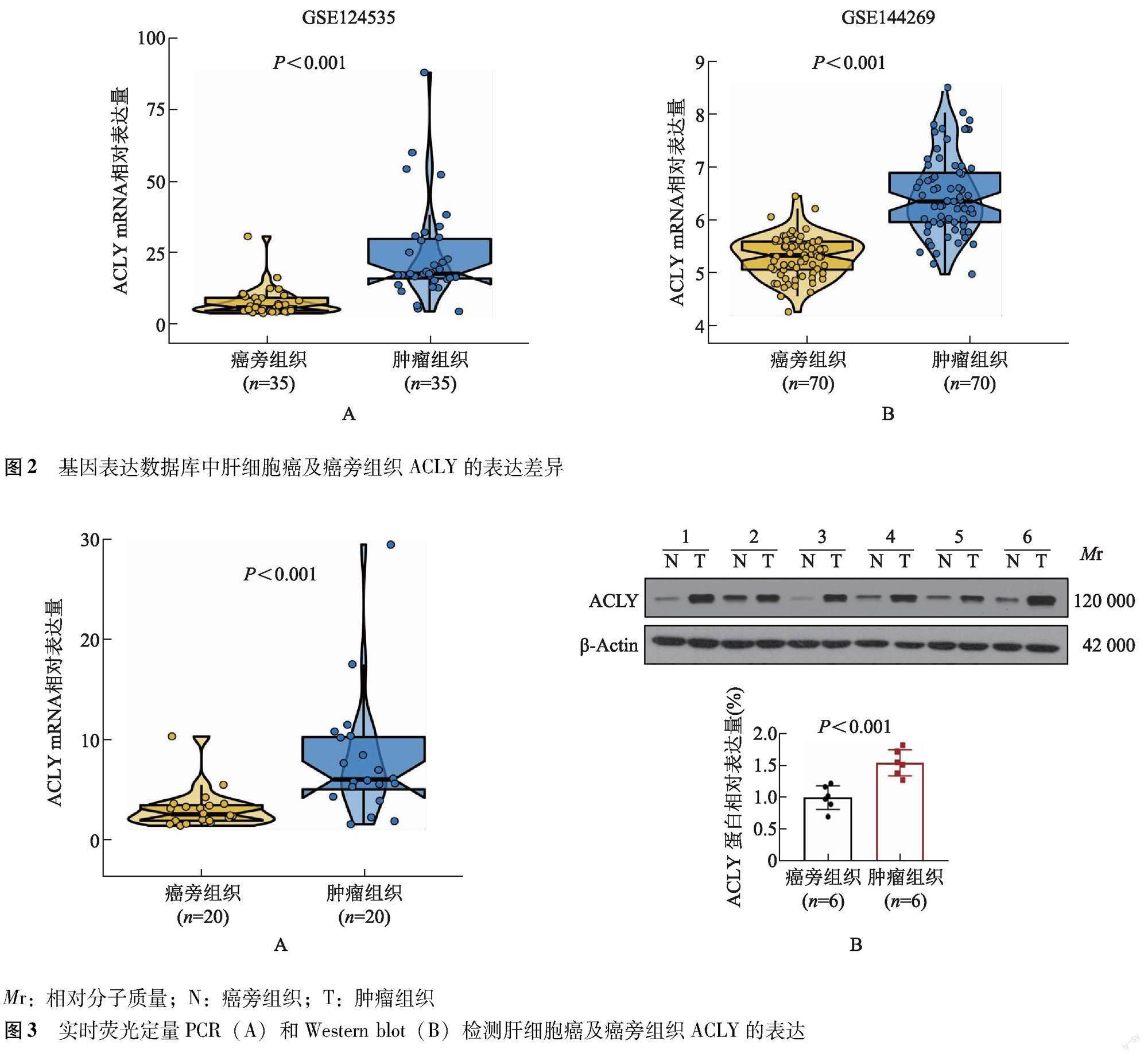
ACLY在HCC中的表达情况及验证 采用UALCAN工具分析TCGA数据库371份HCC组织和匹配的50份癌旁组织中ACLY的表达情况,结果显示ACLY在HCC中的表达显着高于癌旁组织(P<0.001),且与组织病理学分级相关,Ⅲ期ACLY mRNA水平增高最为显着(P<0.001)。采用R软件ggplot2包对GEO的GSE124535和GSE144269数据集进行分析,结果显示ACLY在HCC中异常高表达(P均<0.001)(图2)。
qRT-PCR检测结果 20对HCC及癌旁组织qRT-PCR检测结果显示,ACLY mRNA在HCC中的表达显着高于癌旁组织(P<0.001)(图3A);6对HCC及癌旁组织Western blot检测结果显示,ACLY蛋白在HCC中的表达显着高于癌旁组织(P<0.001)(图3B)。
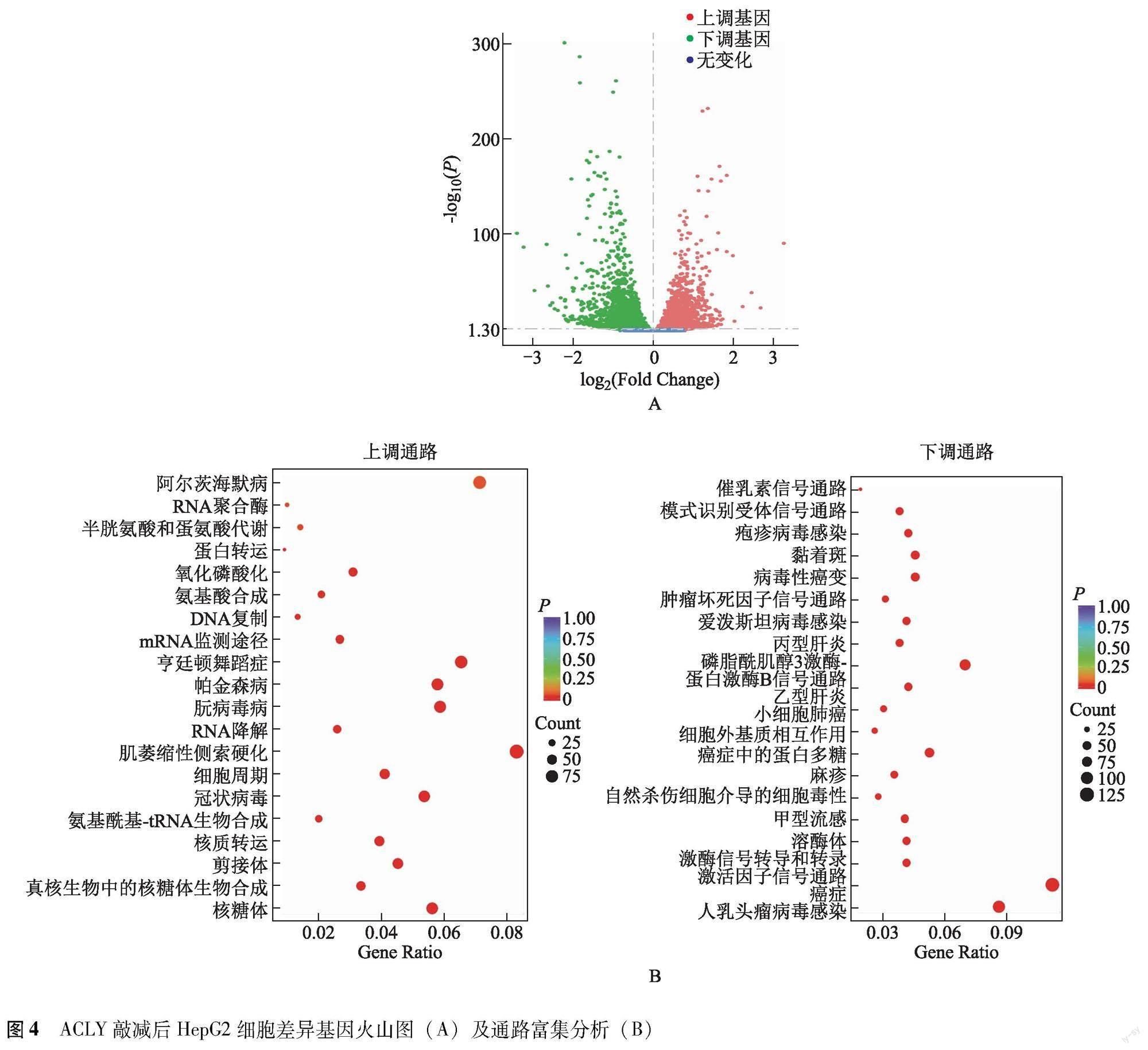
ACLY敲减在HCC转录调控中的功能分析 siACLY-1、siACLY-2和对照组转录组测序结果显示,ACLY敲减引起HepG2细胞氧化磷酸化相关基因表达的异常,导致HCC细胞的能量代谢障碍(图4)。细胞增殖实验结果显示,与对照组比较,siACLY-1和siACLY-2组HepG2细胞的增殖能力明显降低(1.406±0.015比1.685±0.005;t=29.99,P<0.001和1.101±0.007比1.685±0.005;t=110.67,P<0.001)。
ACLY表达水平与预后的相关性 生存分析曲线结果显示,ACLY高表达与HCC患者的不良预后呈显着正相关(HR=1.60,P=0.011)。
ACLY表达与肿瘤细胞免疫浸润的相关性 Sangerbox在线分析平台分析结果显示,ACLY表达与多种肿瘤细胞的免疫浸润水平相关(P均<0.05),且在HCC中ACLY表达与成纤维细胞(R=0.19,P<0.001)、CD4+T细胞(R=0.11,P=0.031)、巨噬细胞(R=-0.48,P<0.001)和其他细胞(R=0.45,P<0.001)呈正相关(图5)。
ACLY表达与免疫新抗原和免疫检查点基因的相关性 提取常见的免疫新抗原和免疫检查点相关基因,分别计算其与ACLY的表达相关性,结果显示ACLY表达与HCC等多种不同类型肿瘤的免疫检查点基因的表达水平(P均<0.05)和新抗原数量(P均<0.05)呈正相关(图6)。
讨论
近10年来,尽管Ⅲ期临床试验和基础科学研究不断深入,但HCC患者5年总体生存率仍然低于15%,并没有显着改善[1-3]。由于HCC进展快速且隐匿,确诊时多数患者伴有严重的肝硬化和肝功能损害[17-18]。此外,因受包括慢性乙型及丙型肝炎病毒感染、酒精摄入以及先天性代谢性疾病在内等致病因素的影响,目前HCC的治疗仍面临巨大挑战[19-21]。多项研究表明代谢和免疫相关蛋白的表达及生物活性的调节直接影响着HCC的发生发展,深入解析HCC相关蛋白质功能以及其调控相关信号通路的分子机制已成为分子肿瘤学领域的重要科学问题[22]。本研究发现ACLY在HCC中异常高表达,且能够通过调控细胞代谢过程和免疫微环境影响HCC的进展,是一个潜在的HCC治疗靶点。
代谢重编程是肿瘤细胞的重要特征之一,肿瘤细胞因需要满足自身快速增殖的需要而发生代谢紊乱,了解肿瘤细胞代谢重编程的机制对于癌症治疗具有重要意义。ACLY作为脂代谢的重要代谢酶,能够将三羧酸循环产生的柠檬酸盐转化为胞质中的乙酰辅酶A和草酰乙酸盐,是一种连接葡萄糖分解代谢和脂肪酸生成的关键生化酶[23-24]。乙酰辅酶A也是组蛋白乙酰化修饰的供体,提示ACLY可能是连接细胞代谢与表观遗传的重要靶点。但ACLY在调控肝癌代谢重编程中的作用、分子机制研究仍然较少。本研究经转录组测序和免疫微环境分析发现,ACLY通过引起HepG2细胞中氧化磷酸化代谢、肿瘤坏死因子信号通路、磷脂酰肌醇3-激酶/蛋白激酶信号通路相关基因的表达异常,参与肝癌细胞免疫浸润过程,提示ACLY在HCC免疫微环境中可能发挥潜在的代谢调控作用,这可能是ACLY在HCC高表达驱动细胞增殖能力的分子机制,然而ACLY如何将代谢小分子与免疫应答相连接进而参与HCC的发生发展还有待未来进一步探讨。
本研究探讨了ACLY在HCC等多种肿瘤中的表达差异,并聚焦ACLY在HCC发生发展中的临床意义,通过检测临床组织标本中ACLY mRNA和蛋白水平变化,证实了其在HCC中显着增加。并采用转录组测序技术和细胞增殖能力检测实验证实了敲减ACLY可以引起肝细胞脂代谢基因的表达异常,抑制细胞的增殖能力。此外,从免疫微环境的角度阐述了ACLY与成纤维细胞等多种免疫细胞浸润相关,揭示了其可能在免疫调控中发挥潜在作用。
综上,本研究结果表明,ACLY通过调控细胞代谢和免疫微环境参与HCC的发生发展,为HCC的代谢调控和免疫治疗领域提供新的研究靶标和理论依据。
参考文献
[1]Duran SR,Jaquiss RDB.Hepatocellular carcinoma[J].N Engl J Med,2019,381(1):e2.DOI:10.1056/NEJMc1906565.
[2]Forner A,Reig M,Bruix J.Hepatocellular carcinoma[J].Lancet,2018,391(10127):1301-1314.DOI:10.1016/S0140-6736(18)30010-2.
[3]Rimassa L,Finn RS,Sangro B.Combination immunotherapy for hepatocellular carcinoma[J].J Hepatol,2023,79(2):506-515.DOI:10.1016/j.jhep.2023.03.003.
[4]Llovet JM,Kelley RK,Villanueva A,et al.Hepatocellular carcinoma[J].Nat Rev Dis Primers,2021,7(1):6.DOI:10.1038/s41572-020-00240-3.
[5]Li XJ,Li QL,Ju LG,et al.Deficiency of histone methyltransferase SET domain-containing 2 in liver leads to abnormal lipid metabolism and HCC[J].Hepatology,2021,73(5):1797-1815.DOI:10.1002/hep.31594.
[6]Feng X,Zhang L,Xu S,et al.ATP-citrate lyase(ACLY)in lipid metabolism and atherosclerosis:an updated review[J].Prog Lipid Res,2020,77:101006.DOI:10.1016/j.plipres.2019.101006.
[7]Linder SJ,Mostoslavsky R.Put your mark where your damage is:acetyl-CoA production by ACLY promotes DNA repair[J].Mol Cell,2017,67(2):165-167.DOI:10.1016/j.molcel.2017.07.006.
[8]Sivanand S,Rhoades S,Jiang Q,et al.Nuclear acetyl-CoA production by ACLY promotes homologous recombination[J].Mol Cell,2017,67(2):252-265,e256.DOI:10.1016/j.molcel.2017.06.008.
[9]Zhang C,Liu J,Huang G,et al.Cullin3-KLHL25 ubiquitin ligase targets ACLY for degradation to inhibit lipid synthesis and tumor progression[J].Genes Dev,2016,30(17):1956-1970.DOI:10.1101/gad.283283.116.
[10]Ference BA,Ray KK,Catapano AL,et al.Mendelian randomization study of ACLY and cardiovascular disease[J].N Engl J Med,2019,380(11):1033-1042.DOI:10.1056/NEJMoa1806747.
[11]Tian M,Hao F,Jin X,et al.ACLY ubiquitination by CUL3-KLHL25 induces the reprogramming of fatty acid metabolism to facilitate iTreg differentiation[J].Elife,2021,10:e62394.DOI:10.7554/eLife.62394.
[12]管成剑,于华婧,张小东,等.基于癌症多组学数据库深度解析磷酸甘油激酶1在肝细胞癌中的表达及临床意义[J].解剖学报,2022,53(6):744-753.DOI:10.16098/j.issn.0529-1356.2022.06.008.
[13]Chandrashekar DS,Bashel B,Balasubramanya SAH,et al.UALCAN:a portal for facilitating tumor subgroup gene expression and survival analyses[J].Neoplasia,2017,19(8):649-658.DOI:10.1016/j.neo.2017.05.002.
[14]Tang Z,Li C,Kang B,et al.GEPIA:a web server for cancer and normal gene expression profiling and interactive analyses[J].Nucleic Acids Res,2017,45(W1):W98-W102.DOI:10.1093/nar/gkx247.
[15]Li C,Tang Z,Zhang W,et al.GEPIA2021:integrating multiple deconvolution-based analysis into GEPIA[J].Nucleic Acids Res,2021,49(W1):W242-W246.DOI:10.1093/nar/gkab418.
[16]何傲月,赵旭,郝洁,等.硒蛋白硫氧还蛋白还原酶3对肿瘤患者生存预后的影响[J].,2022,44(6):970-979.DOI:10.3881/j.issn.1000-503X.14848.
[17]Schulze K,Imbeaud S,Letouze E,et al.Exome sequencing of hepatocellular carcinomas identifies new mutational signatures and potential therapeutic targets[J].Nat Genet,2015,47(5):505-511.DOI:10.1038/ng.3252.
[18]Chen W.Cancer statistics:updated cancer burden in China[J].Chin J Cancer Res,2015,27(1):1.DOI:10.3978/j.issn.1000-9604.2015.02.07.
[19]Kim C,Yang H,Chon HJ.High levels of antidrug antibodies against atezolizumab as a predictive marker for clinical outcomes in patients with hepatocellular carcinoma-reply[J].JAMA Oncol,2023,9(5):725-726.DOI:10.1001/jamaoncol.2023.0111.
[20]Llovet JM,Willoughby CE,Singal AG,et al.Nonalcoholic steatohepatitis-related hepatocellular carcinoma:pathogenesis and treatment[J].Nat Rev Gastroenterol Hepatol,2023,20(8):487-503.DOI:10.1038/s41575-023-00754-7.
[21]Gao Q,Zhu H,Dong L,et al.Integrated proteogenomic characterization of HBV-related hepatocellular carcinoma[J].Cell,2019,179(5):1240.DOI:10.1016/j.cell.2019.10.038.
[22]Huang Q,Li J,Xing J,et al.CD147 promotes reprogramming of glucose metabolism and cell proliferation in HCC cells by inhibiting the p53-dependent signaling pathway[J].J Hepatol,2014,61(4):859-866.DOI:10.1016/j.jhep.2014.04.035.
[23]Ference BA,Ray KK,Nicholls SJ.Mendelian randomization study of ACLY and cardiovascular disease.Reply[J].N Engl J Med,2020,383(7):e50.DOI:10.1056/NEJMc1908496.
[24]Gu L,Zhu Y,Lin X,et al.The IKKbeta-USP30-ACLY axis controls lipogenesis and tumorigenesis[J].Hepatology,2021,73(1):160-174.DOI:10.1002/hep.31249.
(收稿日期:2023-03-22)
勘 误
2023年第45卷第1期22~27页《颈动脉支架植入术后发生血流动力学抑制的临床预测模型的构建》一文,作者及单位更改如下:
范卫东1,2,刘 坤2,乔 彤1
1南京医科大学鼓楼临床医学院血管外科,南京 210008
2南京医科大学附属宿迁第一人民医院血管外科,江苏宿迁 223800
FAN Weidong1,2,LIU Kun2,QIAO Tong1
1Department of Vascular Surgery, Drum Tower Clinical College of Nanjing Medical University, Nanjing 210008, China
2Department of Vascular Surgery, The Affiliated Suqian First People's Hospital of Nanjing Medical University, Suqian, Jiangsu 223800, China



