颜廷斐 郑春喜2 刘光震3 王中军 王文环 郭辉 韩斌 宋军莹 田润华
(1 青岛大学附属医院检验科,山东 青岛 266003; 2 青岛市妇女儿童医院检验科; 3 青岛大学附属医院放射科)
近年来的研究表明,长链非编码RNA-小核仁宿主基因15(LncRNA-SNHG15)作为LncRNA家族的成员,除具有LncRNA的生物学功能外,还在肿瘤的发生发展中发挥有重要作用[1-2]。目前研究发现LncRNA-SNHG15可通过调控miR-211-3p自噬放大系统促进乳腺癌(BC)细胞的增殖、迁移和侵袭;通过调控miR-141促进骨肉瘤细胞的增殖、侵袭以及自噬[3];在肿瘤的发生发展过程中促进肿瘤的进程[4]。但是先前的研究由于样本量较小、肿瘤类型局限等原因,致使得出的结论不一定准确可靠。随着相关的研究越来越深入,对该基因的相关功能有必要进行适时的归纳和总结。因此,本文研究通过检索中外主要数据库中关于LncRNA-SNHG15的相关文献,对LncRNA-SNHG15与中国人群中恶性肿瘤的关联性进行Meta分析,为其进一步的功能研究和临床应用提供理论依据。
1 材料和方法
1.1 检索策略和文献选择
由两名研究者独立检索了PubMed、EMBASE、Cochrane Library、Springe Link、中国知网和万方等数据库中所有研究LncRNA-SNHG15与肿瘤诊断、预后等相关文献,检索日期2019年3月10日。
1.2 文献纳入和排除标准
文献纳入标准:①患者明确诊断为肿瘤;②患者的基本资料完整且有原始研究的实验测试数据;③明确探讨LncRNA-SNHG15与肿瘤发生、发展关系的文献。文献排除标准:①重复的文献;②会议、讲座、报纸、演讲等缺乏原始数据的文献;③研究数据缺失的文献。
1.3 数据的提取
由两位研究者根据文献的纳入和排除标准独立提取数据,有争议的文献与第3位研究者讨论解决。提取的信息包括:①第一作者;②出版年限;③国家;④肿瘤类型;⑤研究设计类型;⑥肿瘤分期;⑦患者总数;⑧cut-off值;⑨随访时间;SNHG15表达检测方法;相对危险度(HR)和总体生存期(OS)的95%CI;TNM分期、淋巴结转移、远处转移等阶段的病人数。参照TIERNEY等[5]和WANG等[6]的研究,通过 Engauge Digitizer 4.1(http://digitizer.sourceforge.net)利用Kaplan-Meier曲线提取患者生存数据。
1.4 质量评估
纳入的所有研究均按照纽卡斯尔-渥太华质量评价量表进行评价。分别从研究选择、可比性和暴露性三个方面进行评价。对于可比性,最高给出2颗星。研究选择和暴露性两方面每项研究最高可获得1颗星。得分在6颗星以上的文献为高质量文献,方可纳入研究。
1.5 统计学方法
使用Stata 12.0软件进行统计分析。采用χ2检验对符合纳入标准的文献进行异质性分析。若无异质性(I2<50%,P>0.1),数据分析时首先使用固定效应模型,若存在异质性(I2>50%,P<0.1),则使用随机效应模型。使用漏斗图进行发表结果偏倚检测。生存数据的Meta分析结果使用森林图显示。
2 结 果
2.1 文献的筛选结果和质量评价
通过检索中外文数据库,共检索到263篇文献。删除重复文献后剩余137篇。阅读全文后,根据研究的纳入和排除标准,最后共纳入7篇符合要求的文献,共涉及540例患者。文献的筛选流程图见图1。根据纽卡斯尔-渥太华质量评价量表,所有文献评分均大于6颗星,文献质量总体较好。见表1。

图1 文献筛选流程图
2.2 纳入文献的主要特征
纳入研究的7篇文献均来自于中国,共涉及到BC、甲状腺癌(TC)、胃癌(GC)、肝细胞癌、非小细胞肺癌(NSCLC)、胰腺癌(PC)6种肿瘤类型,其中6篇文献报道了患者OS,2篇报道了无病生存期(DFS),1篇无生存相关数据。纳入文献的主要征见表2。6篇文献均提示上述肿瘤患者肿瘤组织中LncRNA-SNHG15表达水平增高且有淋巴结转移,说明LncRNA-SNHG15的表达增高可能与相关肿瘤发生、发展有关,且与淋巴结转移密切相关。
2.3 肿瘤患者LncRNA-SNHG15表达水平与OS和TNM分期之间的相关性
对纳入文献进行异质性检验,结果显示纳入的文献不存在异质性(OS:I2=0%,P=0.90;TNM:I2=0%,P=0.44),采用固定效应模型对肿瘤患者肿瘤组织中LncRNA-SNHG15表达水平与OS以及TNM分期(Ⅲ/Ⅳ vs.Ⅰ/Ⅱ)之间的相关性进行分析,结果显示LncRNA-SNHG15高表达与OS的缩短有着密切的关系(HR=1.89,95%CI=1.09~2.69,P<0.01),同样与肿瘤进展加快具有密切的关系(HR=1.76,95%CI=1.46~2.12,P<0.01)。肿瘤患者LncRNA-SNHG15表达与OS和TNM分期的森林图见图2、3。
2.4 肿瘤患者LncRNA-SNHG15的表达水平与淋巴转移之间的相关性
采用固定效应模型(I2=0%,P=0.51)比较纳入文献LncRNA-SNHG15高、低表达组与肿瘤患者淋巴转移之间相关性,研究结果表明LncRNA-SNHG15水平升高的肿瘤患者具有明显的淋巴转移的倾向(HR=1.80,95%CI=1.47~2.22,P<0.01)。见图4。

表1 纳入的7篇文献纽卡斯尔-渥太华质量评价

表2 纳入文献的主要特征
注:DM:远距离转移;LNM:淋巴结转移;NA:无数据

图2 肿瘤患者LncRNA-SNHG15表达与OS相关性的Meta分析森林图
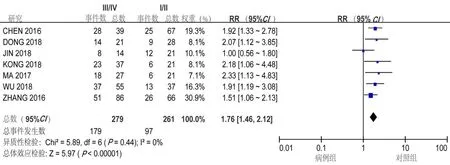
图3 肿瘤患者LncRNA-SNHG15表达与肿瘤TNM分期相关性的Meta分析森林图
2.5 发表偏倚评价
通过漏斗图和Egger检验评估所纳入文献的发表偏倚。如图5所示,漏斗图的形状是对称的,并且所有纳入文献的OS的Egger检验P值为0.242,表明在纳入的研究中不存在显着的发表偏倚。

图4LncRNA-SNHG15表达与肿瘤患者淋巴转移相关性的Meta分析森林图

图5 纳入文献发表偏倚检测的漏斗图
3 讨 论
LncRNA是一种长度为200个核苷酸的保守非编码RNA[14],作为基因表达的主要调节因子,广泛参与组织分化、细胞增殖和胚胎发育等过程,其功能异常与肿瘤的发生、发展密切相关[15-18],LncRNAs作为新的肿瘤标志物和肿瘤治疗靶标具有广阔的应用前景[19-22]。
LncRNA-SNHG15的编码基因位于7号染色体短臂的13区带中(7p13),相关研究提示其作为关键调节因子可促进肿瘤的发生发展[23-25]。本文纳入的符合要求的7篇文献均为中国学者的相关研究,共涉及540例患者,研究结果表明,上述肿瘤患者体内LncRNA-SNHG15的表达增高并且有淋巴结转移;LncRNA-SNHG15表达增高者生存率下降,预后不良;LncRNA-SNHG15表达持续增高的患者,肿瘤进展加快,病情进行性恶化。以上结果均提示LncRNA-SNHG15作为关键调节因子,在中国人群某些恶性肿瘤发生发展中起着重要作用。
研究表明,LncRNA-SNHG15在GC、NSCLC和BC等肿瘤中均有过度表达,可促进这些肿瘤细胞的增殖,但具体的机制目前尚不清楚。在所涉及的研究中,其可能通过以下途径导致肿瘤的发生发展:①作为一种内源竞争性的RNA(ceRNA),可以通过microRNA应答元件(MREs)与microRNA结合,从而影响microRNA表达,导致相应基因沉默[26-28];②可通过与zeste增强子同源物2(EZH2)结合从而抑制P15以及Kruppel样因子2(KLF2)蛋白的表达,以促进PC的增殖[13];③LncRNA-SNHG15可以通过影响乳头状甲状腺癌中的miR-200a-3p来调节YAP1-Hippo信号通路,从而对肿瘤细胞的增殖产生影响[11];④通过与miR-338-3p结合并损害其对靶标的抑制作用来促进结直肠癌的发生和进展[29];⑤在肾癌中,NF-κB可以特异性地与LncRNA-SNHG15结合从而促进肿瘤细胞的侵袭和迁移[30]。
综上所述,本研究虽然制定了严格的筛选标准,但因考虑其中的一些限制因素,故对当前的结果仍然应该谨慎解释,主要涉及以下几个方面:①该项分析纳入研究的文献数量过少;②HR均为提取的估计值;③无法对治疗方法进行亚组分析。LncRNA-SNHG15作为一种新近发现的LncRNA,多项研究结果均表明其表达水平与中国人群高发的肿瘤存在一定的相关性,因此其在肿瘤的预后评估中所起到的作用还需要进一步研究探讨。



