周娜 丁伟 宋金莲 王军 郑文祥 侯琳
(1 青岛大学医学院生物化学与分子生物学教研室,山东 青岛 266021; 2 青岛市妇女儿童医院)
神经母细胞瘤(NB)又称交感神经母细胞瘤[1],是儿童临床最常见的颅外恶性实体瘤[2]。目前,临床上针对恶性程度高、发生转移早的高危NB患者常采用超大剂量联合化疗的治疗手段,但是临床常用的化学合成药物具有毒副作用大、效果不佳、易复发及伴有明显的骨髓抑制和较高的感染发生率等缺点[3],一定程度上限制了其临床应用。天然化合物可靶向杀伤肿瘤细胞,毒副作用较小,一直以来被作为新药开发的先导化合物的优质来源[4-7],为肿瘤的临床治疗提供了新的治疗思路。
组蛋白去甲基化酶1(LSD1)是首个被发现的组蛋白特异性去甲基酶,为黄素腺嘌呤二核苷酸(FAD)依赖性的单胺氧化酶家族成员之一[8],能够特异性地去除组蛋白第三亚基四号赖氨酸(H3K4)以及组蛋白第三亚基9号赖氨酸(H3K9)的单双甲基化[9]。LSD1在上皮间质转化(EMT)[10]、细胞分化[11]及增殖[12]等过程中发挥着重要的生物学作用。KRAAL等[13]研究证明,在许多肿瘤组织中LSD1高表达。目前,临床上针对实体瘤的LSD1抑制剂的需求在很大程度上尚未得到满足。
近年来随着对吲哚类化合物的深入研究,发现含氮杂环衍生物生物碱在生物体内发挥着愈加重要的作用。吲哚-3-甲醇(I3C)是在花茎甘蓝以及抱子甘蓝等十字花科蔬菜中广泛存在的抗肿瘤天然成分[14]。张丽[15]研究证明,吲哚醌类化合物对NB细胞的增殖与迁移具有抑制作用,在临床NB患者中LSD1高表达。另外,吲哚醌类化合物为内源性的单胺氧化酶(MAO)抑制剂[16],LSD1为单胺氧化酶,I3C为吲哚类化合物,且I3C在NB细胞增殖与迁移方面的作用未见报道。因此,本研究以不同浓度的I3C处理SH-SY5Y细胞,探讨I3C对NB细胞增殖与迁移能力的影响及其可能的作用机制。
1 材料与方法
1.1 材料来源
NB细胞系SH-SY5Y由本课题组提供;CCK8试剂盒以及DMSO购自北京索莱宝科技有限公司;I3C购自美国MedChemExpress(MCE)公司;胎牛血清购自北京全式金生物技术(TransGen Biotech)有限公司;DMEM/F-12(1∶1)培养基购自福州南江生物科技有限公司;Evo M-MLV反转录试剂盒Ⅱ购买于湖南艾科瑞生物工程有限公司;荧光定量PCR Mix购买于北京全式金生物技术(TransGen Biotech)有限公司;GAPDH、LSD1、H3K4me1/2单克隆抗体购自英国Abcam公司。
1.2 研究方法
1.2.1细胞培养 SH-SY5Y细胞培养于含体积分数0.15的胎牛血清及体积分数0.01青链霉素混合溶液的DMEM/F-12(1∶1)培养基中,置于37 ℃、含体积分数0.05 CO2的恒温培养箱中常规培养,培养至汇合度达40%~60%时进行后续实验。
1.2.2CCK8实验检测SH-SY5Y细胞活力及半数致死浓度(IC50值) 将处于对数生长期的SH-SY5Y细胞,胰酶消化后接种于96孔板中,每孔约2 000个细胞,待细胞完全贴壁并进入对数生长期后,分别加入I3C使其终浓度为0、50、100、150、200、300、500 μmol/L,每种浓度设5个复孔,边缘空孔加入无菌PBS以减少水分蒸发。药物处理48 h后,每孔加入CCK8溶液10 μL,再次放入培养箱中继续孵育2 h。置于酶标仪上测定波长450 nm处各孔的吸光度(A)值,并计算细胞活力及IC50值。
1.2.3划痕实验检测SH-SY5Y细胞的迁移能力 取对数生长期的SH-SY5Y细胞,消化并接种于6孔板中,每孔约50 000个细胞,待细胞的汇合度达80%~90%时,用200 μL枪头垂直于6孔板刮擦细胞以产生划痕区域,用PBS轻轻冲洗掉刮下细胞及细胞碎片,然后加入2 mL无血清培养基,以CCK8实验结果得出的IC50值为依据,将细胞分别加入终浓度为0、30、60、90 μmol/L的I3C(分别为A、B、C、D组)作用48 h,分别于0、48 h时显微镜下拍照,记录划痕愈合情况,实验重复3次,取均值。
1.2.4实时荧光定量PCR(RT-qPCR)技术检测SH-SY5Y细胞中LSD1 mRNA的相对表达量 采用Trizol法分别提取I3C作用48 h后A~D组中SH-SY5Y细胞的总RNA,测定各组RNA浓度与纯度,反转录合成cDNA,以cDNA为模板进行RT-qPCR。以GAPDH为内参基因,根据试剂盒说明书配制反应体系,每组样品设置3个复孔,采用2-△△CT法计算各组LSD1 mRNA的相对表达量。引物序列见表1。
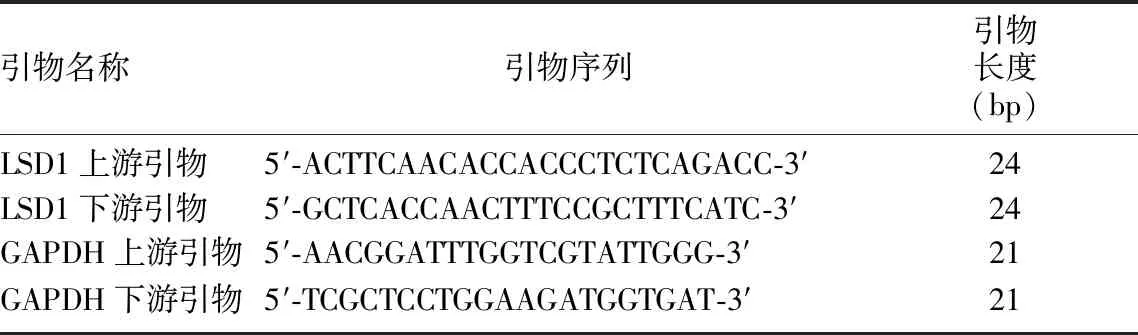
表1 RT-qPCR引物序列
1.2.5Western Blot实验检测SH-SY5Y细胞中LSD1、H3K4me1及H3K4me2蛋白的相对表达量采用RIPA法(加PMSF和蛋白酶磷酸酶抑制剂)提取I3C作用48 h后A~D组SH-SY5Y细胞的蛋白,用BCA法进行蛋白定量,加入5×loading buf-fer于水中煮沸10 min变性;配制聚丙烯酰胺凝胶,加入25 μg的蛋白样品至凝胶孔内,边缘空加入1×蛋白上样缓冲液;进行SDS蛋白电泳,PVDF转膜,以50 g/L脱脂奶粉封闭2 h,然后分别以LSD1、H3K4me1以及H3K4me2蛋白(其中H3K4me1、H3K4me2蛋白为LSD1的酶底物)单克隆抗体(1∶1 000)4 ℃孵育过夜,并以GAPDH作为内参照,TBST洗膜后二抗孵育1 h,TBST洗膜,显影拍照,使用Image J软件分析蛋白条带灰度值,计算目的蛋白的相对表达量,目的蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。实验重复3次,结果取均值。
1.3 统计学方法
使用Graphpad Prism 6软件进行数据的统计学分析。计量资料以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05表示差异具有统计学意义。
2 结 果
2.1 各组SH-SY5Y细胞增殖活力比较
CCK-8试剂盒检测结果显示,当I3C浓度为0、50、100、150、200、300、500 μmol/L时,SH-SY5Y细胞的增殖活力分别为(99.83±0.09)%、(53.11±1.10)%、(35.59±0.75)%、(33.85±0.87)%、(26.40±0.71)%、(24.43±0.30)%、(13.01±0.20)%。随着I3C浓度的递增,SH-SY5Y细胞的增殖活力明显下降(F=1 823.19,P<0.05)。计算得出I3C作用于SH-SY5Y细胞48 h的IC50值为121.00 μmol/L,即100 μmol/L浓度以内的I3C对细胞没有明显毒性,因此后续实验设定的I3C至终浓度为0、30、60、90 μmol/L。
2.2 各组SH-SY5Y细胞迁移能力比较
划痕实验结果显示,I3C作用SH-SY5Y细胞48 h后,A~D组的细胞迁移率分别为0.28±0.01、0.19±0.01、0.11±0.01、0.07±0.01,随着I3C浓度的增高,SH-SY5Y细胞的迁移能力逐渐降低(F=388.47,P<0.05),各组间比较差异均具有显着性(t=8.86~33.43,P<0.05)。
2.3 各组细胞中LSD1 mRNA的相对表达量比较
不同浓度I3C处理SH-SY5Y细胞48 h以后,RT-qPCR结果显示,A~D组细胞中LSD1 mRNA相对表达量分别为1.03±0.04、0.71±0.16、0.35±0.04、0.02±0.01,随着I3C浓度的增高,SH-SY5Y细胞中LSD1 mRNA的相对表达量逐渐下降(F=27.67,P<0.05),各组间比较差异均有显着性(t=1.95~27.93,P<0.05)。
2.4 各组细胞中LSD1及H3K4me1、H3K4me2蛋白相对表达量的影响
Western Blot实验结果显示,A~D组LSD1蛋白相对表达量随着I3C浓度的增高明显下降(F=522.41,P<0.05),各组间比较差异均有显着性(t=4.16~56.28,P<0.05)。H3K4me1以及H3K4me2蛋白的相对表达量则随着I3C浓度的增高明显升高(F=36.53、54.60,P<0.05)。见表2。

表2 各组细胞中LSD1、H3K4me1、H3K4me2蛋白的相对表达量比较
3 讨 论
目前,随着肿瘤病理学、细胞生物学、肿瘤基因学等研究的进展,发现作用于特定靶点的高效、低毒、特异性强的新型抗肿瘤药物己成为当今抗肿瘤药物研究的重要方向。近年来,靶向作用肿瘤细胞而对正常细胞损伤较轻的天然小分子化合物类药物成为研究热点,尤其如长春碱、长春新碱等毒副作用较低的天然吲哚化合物在抗肿瘤中的应用,日渐引起关注,已成为了抗肿瘤药物研究的热点[17]。I3C作为天然吲哚类化合物之一,是近年来研究较多的天然抗肿瘤活性小分子化合物。I3C可以通过多种直接或间接的方式与雌激素受体(ER)、芳烃羟化酶受体(AhR)、转录因子Sp1结合,调节与DNA损伤修复、细胞凋亡及周期调控相关基因的表达[18]。目前临床上I3C对于复发性呼吸器多发乳头瘤的治疗尚未发现即时或远期的毒副作用,证明其安全性是较高的。
NB一般体积较大、恶性程度高、生长迅速、转移性高,常在发病较短时间内冲破包膜,侵及周围组织,或经血液及淋巴转移[19]。因此,针对NB增殖能力强、易转移的特质,本研究将梯度浓度的I3C作用于NB细胞系SH-SY5Y,实验结果显示I3C作用于SH-SY5Y细胞48 h后,细胞的活力及迁移能力明显下降。大量研究证实,LSD1功能障碍能抑制急性淋巴白血病[20]、肺腺癌[21]、乳腺癌[22]等细胞的增殖。因此LSD1可作为较理想的筛选抗肿瘤药物的关键靶点[23]。为探讨I3C是否通过调节LSD1对NB细胞增殖与迁移发挥作用,本研究RT-qPCR技术以及Western Blot实验结果显示,I3C能够显着地降低NB细胞中LSD1 mRNA和蛋白的相对表达量。另外,H3K4me1、H3K4me2作为基因转录激活的标志物是LSD1的主要底物。LSD1可与CoREST复合物结合后,进而脱去靶基因启动子处H3K4me1、H3K4me2甲基化修饰,从而将染色质改变为抑制性状态,最终抑制该基因的表达[24]。本研究通过Western Blot实验得出I3C作用于SH-SY5Y细胞后H3K4me1、H3K4me2蛋白的相对表达量增高,提示I3C对NB增殖与迁移的作用可能是通过调节LSD1实现的,为LSD1抑制剂的研究拓展了思路。
总之,本研究结果显示,I3C可能具有抑制SH-SY5Y细胞增殖与迁移的能力,I3C可能通过调节LSD1的表达对NB细胞的增殖与迁移产生影响。



