蔡友银
【摘要】 目的 观察前列地尔联合胞磷胆碱治疗急性一氧化碳中毒的临床疗效。方法 选取2016年12月—2020年12月厦门大学附属第一医院杏林分院收治的96例急性一氧化碳中毒患者,随机分为对照组(n=48,常规治疗+胞磷胆碱)和观察组(n=48,常规治疗+胞磷胆碱+前列地尔),均连续治疗2周。比较2组临床疗效、苏醒时间、急性生理与慢性健康(APACHE Ⅱ)评分及血清神经元特异性烯醇化酶(NSE)、缺氧诱导因子-1α(HIF-1α)表达水平,记录迟发性脑病的发生情况。结果 观察组治疗总有效率显着高于对照组,差异有统计学意义(P<0.05)。观察组苏醒时间及APACHE Ⅱ评分显着低于对照组,差异有统计学意义(P<0.05)。治疗后,观察组血清NSE、HIF-1α水平显着低于对照组,差异有统计学意义(P<0.05)。观察组迟性脑病发生率显着低于对照组,差异有统计学意义(P<0.05)。结论 前列地尔联合胞磷胆碱能提高急性一氧化碳中毒的治疗效果,减少迟性脑病的发生。
【关键词】 急性一氧化碳中毒;前列地尔;胞磷胆碱;临床疗效
中图分类号:R459.7 文献标识码:A
文章编号:1672-1721(2023)05-0148-03
DOI:10.19435/j.1672-1721.2023.05.049
一氧化碳中毒具有明显的季节性及区域性,多发于冬季及北方地区,患者会陷入昏迷,如果抢救不及时将会损伤神经功能,甚至危及生命[1]。调查显示[2],全球每年有约250万人死于急性一氧化碳中毒,居于中毒类死亡原因的首位,给患者家庭、社会带来严重的损失。高压氧疗是临床治疗急性一氧化碳中毒的首选方法,能通过物理溶解增加血液中的氧含量,改善大脑缺氧状态[3]。但脑组织对一氧化碳较为敏感,一氧化碳进入脑组织后会造成大脑水肿、缺血缺氧,损害神经功能[4]。因此,在常规治疗的基础上联合神经营养制剂可能对急性一氧化碳中毒患者的恢复具有促进作用。既往研究发现,神经营养药胞磷胆碱能够提高急性一氧化碳中毒的疗效,减少神经功能损伤;前列地尔能够改善血液微循环,修复受损神经[5-6]。本研究将前列地尔与胞磷胆碱联合用于治疗急性一氧化碳中毒患者,进一步分析其临床价值。
1 资料与方法
1.1 一般资料 从2016年12月—2020年12月厦门大学附属第一医院杏林分院收治的急性一氧化碳中毒患者中选取96例作为研究对象,按照随机原则分为2组,各48例。对照组:男25例,女23例;年龄18~72岁,平均年龄(43.82±5.67)岁;昏迷时间20 min~6 h,平均(2.59±0.43)h。观察组:男22例,女26例;年龄18~70岁,平均年龄(43.09±5.78)岁;昏迷时间20 min~6 h,平均(2.65±0.50)h。2组一般资料比较差异无统计学意义(P>0.05)。
1.2 纳入及排除标准 纳入标准:(1)明确有一氧化碳中毒史;(2)年龄≥18岁;(3)中毒6 h内入院就诊;(4)患者家属知情同意。排除标准:(1)合并心、肝、肾功能严重异常者;(2)患有严重精神疾病者;(3)对本研究药物过敏者。
1.3 治疗方法 2组均采取常规对症治疗措施,如高压氧、维持水电解质平衡、营养支持、降颅内压等。对照组给予胞磷胆碱钠(上海旭东海普药业有限公司,国药准字H31022725,规格2 mL/0.5 g)治疗,取2 mL胞磷胆碱钠注射液溶于250 mL含5%葡萄糖注射液中,静脉滴注,1次/d。观察组在对照组基础上联合使用前列地尔(西安力邦制药有限公司,国药准字H20103101,规格1 mL/5μg),将2 mL前列地尔注射液溶解于10 mL含5%葡萄糖注射液中静脉推注,1次/d。2组治疗时间均为2周。
1.4 观察指标 (1)临床疗效:根据患者临床症状及体征制定疗效评定标准,患者意识清晰、精神状态良好,生活能够自理,临床症状及体征完全消失为痊愈;患者意识恢复,精神状态、临床症状及体征有所改善为有效;患者临床症状及体征无变化甚至加重为无效。总有效率=(痊愈+有效)/总例数×100%。(2)苏醒时间及APACHE Ⅱ评分:记录2组患者苏醒时间,并于治疗前后采用急性生理与慢性健康(APACHE Ⅱ)评分对患者预后进行评估,APACHE Ⅱ主要包括急性生理、年龄、慢性健康状况三个方面,其中急性生理方面评价指标共12项(包括体温、心率、血压、氧合指数等),年龄方面赋值范围0~6分(根据年龄段不同),慢性健康状况方面评价内容共5项(分别为呼吸、肝脏、心脏、肾脏、免疫),总分为0~71分,分数越高提示患者预后越差。(3)于治疗前后采集患者肘静脉血5 mL,检测血清中神经元特异性烯醇化酶(NSE)、缺氧诱导因子-1α(HIF-1α)表达水平。(4)对2组患者进行为期3个月的电话随访,记录发生迟发性脑病的患者人数。
1.5 统计学方法 以SPSS 22.0统计学软件对数据进行分析,计量资料以x±s表示,组内比较采用配对t检验,组间比较采用成组t检验,计数资料以百分比表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
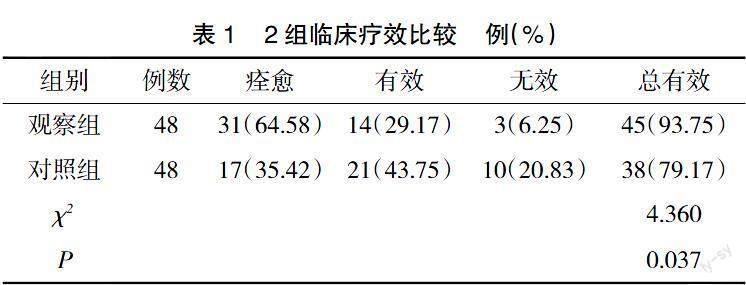
2.1 临床疗效 观察组治疗总有效率为93.75%,明显高于对照组的79.17%(P<0.05),见表1。
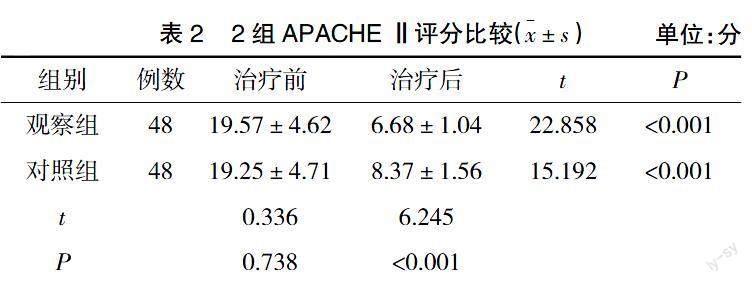
2.2 苏醒时间及APACHE Ⅱ评分 观察组和对照组苏醒时间分别为(4.50±1.28)h、(6.39±1.42)h,观察组明显短于对照组(t=6.849,P<0.001)。治疗前,2组APACHE Ⅱ评分无显着差异(P>0.05);治疗后,2组APACHE Ⅱ评分均降低,且观察组显着低于对照组(P<0.05),见表2。
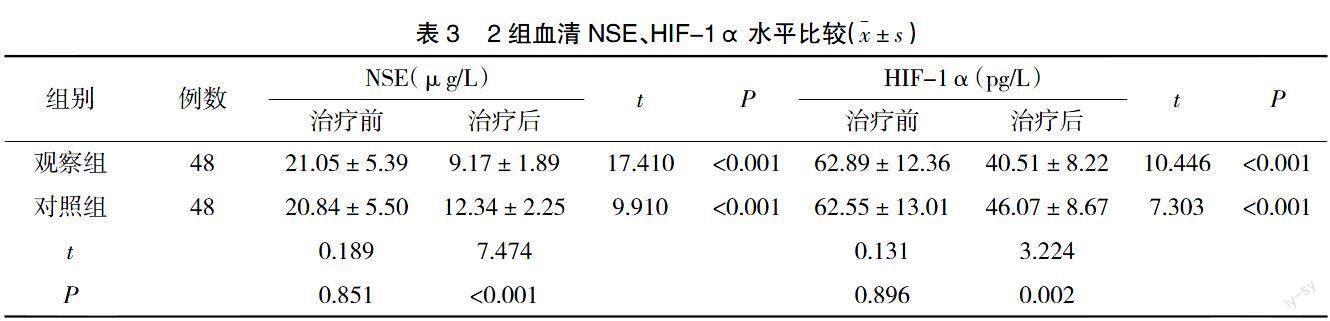
2.3 血清NSE、HIF-1α水平 治疗前,2组血清NSE、HIF-1α水平比较无显着差异(P>0.05);治疗后,2组血清NSE、HIF-1α均降低,且观察组降低更明显(P<0.05),见表3。
2.4 迟发性脑病发生情况 观察组和对照组迟发性脑病发生率分别为4.17%(3/48)、18.75%(3/48),差异有统计学意义(χ2=5.031,P=0.025)。
3 讨论
急性一氧化碳中毒是一氧化碳吸入过多形成的一种急性缺血缺氧症状,由于一氧化碳与血红蛋白的亲和力比氧气高240倍,且二者形成的复合物不易解离,一氧化碳一旦进入血液后就会降低血液氧含量,造成组织缺氧,导致患者陷入昏迷,累及中枢神经系统[7]。因此治疗急性一氧化碳中毒的目标为改善脑组织缺氧状态,降低神经功能损伤。高压氧疗是临床治疗一氧化碳中毒的首选方法,在高压氧环境下,一氧化碳与血红蛋白形成的复合物会加速解离,促使一氧化碳排出,恢复血红蛋白携氧能力,从而增加血液中氧浓度,使大脑组织获得足够的氧含量,促进脑损伤后恢复;另一方面高压氧疗能通过降低脑血管通透性,改善脑内血液微循环,进而改善一氧化碳中毒症状。但单纯高压氧疗治疗一氧化碳中毒的效果有限,临床通常与神经节苷脂、胞磷胆碱、前列地尔等药物联用,以改善患者预后。本研究旨在观察胞磷胆碱联合前列地尔对急性一氧化碳中毒的疗效,结果显示,观察组治疗总有效率显着高于对照组,苏醒时间及APACHEⅡ评分显着低于对照组(P<0.05),说明前列地尔与胞磷胆碱联合用药能够提高急性一氧化碳中毒的临床疗效,缩短苏醒时间,促进机体恢复。胞磷胆碱是合成细胞膜重要成分——卵磷脂的前体,通过外源性补充胞磷胆碱能减少细胞膜损伤,修复受损的神经细胞,对急性一氧化碳中毒患者的神经功能恢复有促进作用[8]。前列地尔主要成分为前列腺素E1,具有扩张脑血管、改善血液微循环的作用。因此,联合使用前列地尔还能够增加血液及组织中的氧含量,进一步改善脑缺氧状态,与章文龙等[9]的研究结果一致。前列地尔可改善患者脑组织缺氧状况,降低或预防神经系统并发症。
NSE是神经内分泌细胞和神经元细胞内的一种蛋白,主要作用是保护神经元,当脑组织受到损伤时,神经元细胞破损、凋亡,大量的NSE通过血脑屏障进入血液,导致血清含量升高,可作为反映神经功能损伤程度或急性一氧化碳中毒预后的生物学指标[10]。HIF-1α是一种氧调节因子,研究发现[11],脑组织缺氧缺血会导致HIF-1α基因发生多态化,而且与急性一氧化碳中毒患者中枢神经损伤密切相关,可作为一氧化碳中毒后迟发性脑病的预测依据。本研究结果显示,观察组血清NSE、HIF-1α显着低于对照组(P<0.05),提示前列地尔与胞磷胆碱联合治疗提高急性一氧化碳中毒疗效的机制可能与NSE、HIF-1α表达降低有关。前列地尔降低NSE、HIF-1α表达的作用机制可能有以下几个方面:(1)扩张颅内血管,改善缺血区血流量;(2)提高腺苷酸环化酶活性,从而抑制血小板聚集及血栓形成;(3)降低自由基的脂质过氧化反应,减少神经细胞损伤;(4)抑制炎症反应。迟发性脑病是一氧化碳中毒后严重并发症,具有较高的致残率。谭永明[12]等应用静息态功能磁共振成像技术证实,与健康人相比,一氧化碳中毒后迟发性脑病患者全脑中心度值明显升高,揭示了脑网络重要节点异常是一氧化碳中毒后迟发性脑病的发生机制之一。本研究结果显示,观察组迟发性脑病发生率显着低于对照组(P<0.05),说明前列地尔联合胞磷胆碱能够降低迟发性脑病的发生,其可能与前列地尔改善脑微循环、恢复脑血流灌注,减少神经功能损伤作用有关。
综上所述,急性一氧化碳中毒患者采取前列地尔与胞磷胆碱联合治疗效果更好,能显着促进神经功能恢复,减少迟发性脑病的发生,值得临床推广。
参考文献
[1] GUO J,MENG J,HAN T.MRI-based comparison of brain damage between acute carbon monoxide poisoning and delayed encephalopathy after acute carbon monoxide poisoning [J].Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi,2014,32(7):533-536.
[2] 卫鹏羽,卫霄青,李海燕.居民非职业性一氧化碳中毒的KAP影响因素及健康教育需求的调查研究[J].中国卫生统计,2018,35(4):549-552.
[3] HOWELL R S,CRISCITELLI T,WOODS J S,et al.Hyperbaric Oxygen Therapy:Indications,Contraindications,and Use at a Tertiary Care Center[J].AORN Journal,2018,107(4):442-453.
[4] AKCALI G,UZUN G,ARZIMAN I,et al.The relationship between intoxication severity and blood interleukin 6, interleukin 10 and CRP levels in carbon monoxide-poisoned patients[J].Undersea Hyperb Med,2018,45(6):646-652.
[5] ALEJANDRA,JACOTTE-SIMANCAS,DAVID,et al.Effects of voluntary physical exercise,citicoline, and combined treatment on object recognition memory,neurogenesis,and neuroprotection after traumatic brain injury in rats[J].J Neurotrauma,2015,32(10):739-751.
[6] 刘斌,王霞,徐瑾媛,等.高压氧联合前列地尔对急性一氧化碳中毒心肌损伤的临床研究[J].中国急救医学,2019,39(1):38-42.
[7] YANAGIHA,KUMI,ISHII,et al.Acetylcholinesterase inhibitor treatment alleviated cognitive impairment caused by delayed encephalopathy due to carbon monoxide poisoning:Two case reports and a review of the literature[J].Medicine,2017,96(8):6125.
[8] 彭霈,邵回龙.大剂量胞二磷胆碱配合醒脑开窍针刺疗法对一氧化碳中毒迟发性脑病患者氧化应激状态和神经康复的影响[J].现代中西医结合杂志,2019,28(26):2878-2882.
[9] 章文龙,韦华,杨文东.前列地尔对有脑卒中史CABG患者术后神经系统并发症的预防作用观察[J].山东医药,2015,7(19):66-67.
[10] ZHANG L,ZHAO J,HAO Q,et al.Serum NSE and S100B protein levels for evaluating the impaired consciousness in patients with acute carbon monoxide poisoning[J].Medicine,2021,100(25):26458.
[11] 李晟,刘伟,池学锋,等.HIF-1α基因多态性与CO中毒患者急性期中枢神经损伤的相关性研究[J].浙江医学,2017,39(23):2089-2092.
[12] 谭永明,郭祺锟,吴开富,等.一氧化碳中毒后迟发性脑病患者脑损伤的功能磁共振研究[J].临床放射学杂志,2020,39(7):1263-1267.
(收稿日期:2022-11-09)



