江丽琴
【摘要】 目的 探讨产妇发生弥散性血管内凝血(DIC)的危险因素及相应的护理对策。方法 选取2017年1月—2022年7月上杭县医院收治的96例产妇为研究对象,根据是否发生DIC分为DIC组(n=15)和非DIC组(n=81)。比较2组产妇临床资料,并采用Logistic回归分析产妇发生DIC的影响因素。结果 2组产妇孕周、分娩方式、糖尿病、高血压、高血脂比较差异无统计学意义(P>0.05)。DIC组产妇年龄、经产妇占比、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)、纤维蛋白原(Fbg)水平、D-二聚体(D-D)水平均高于非DIC组,血小板计数低于非DIC组,差异有统计学意义(P<0.05)。Logistic回归模型分析显示,年龄(OR值=1.537,95%CI:1.185~3.659)、APTT(OR值=5.872,95%CI:3.757~13.571)、D-D(OR值=2.151,95%CI:1.384~4.662)、Fbg(OR值=1.228,95%CI:1.019~2.386)、血小板(OR值=3.946,95%CI:2.003~7.458)为产妇发生DIC的独立危险因素(P<0.05)。结论 产妇发生DIC的影响因素较多,临床上应当加强产妇围生期管理,采取针对性的干预措施,以降低DIC发生风险。
【关键词】 产妇;弥散性血管内凝血;危险因素;护理对策
中图分类号:R714.2 文献标识码:A
文章编号:1672-1721(2023)21-0052-03
DOI:10.19435/j.1672-1721.2023.21.017
弥散性血管内凝血(disseminated intravascular coagulation,DIC)是一种以凝血功能障碍为病理特征的严重产科并发症,具有病情凶险、进展快、致死率高等特点[1]。目前,关于DIC的病理机制逐渐清晰,在多种诱发因素的共同作用下,产妇机体动静脉、毛细血管等出现微血栓,凝血因子激活后被大量消耗,导致大量纤维蛋白沉积于血管,致使产妇血液呈高凝状态,最终引发DIC[2-3]。临床认为DIC的诱发因素较多,如羊水栓塞、产后出血、急性脂肪肝、宫缩乏力以及妊高症等均可能导致DIC的发生[4-5]。也有研究指出[6],高龄产妇、产次>1次的产妇发生DIC的风险更高。本研究对96例产妇的临床资料进行回顾性分析,探讨了产妇发生DIC的危险因素及护理对策,报告如下。
1 对象与方法
1.1 研究对象 选取2017年1月—2022年7月上杭县医院收治的96例产妇为研究对象,根据是否发生DIC分为DIC组(n=15)和非DIC组(n=81)。纳入标准:(1)均在该院建档,且定期产检者;(2)单胎妊娠者;(3)临床资料齐全,无信息遗漏或缺失者;(4)均为本地区常驻人口者。排除标准:(1)合并血液系统疾病或自身免疫性疾病者;(2)恶性肿瘤患者;(3)产前存在全身性急、慢性疾病者。
1.2 DIC诊断标准 参考2012年中华医学会血液学分会血栓与止血组制定的《弥散性血管内凝血诊断与治疗中国专家共识》中对于DIC的诊断标准[7],若同时满足下述4项即可诊断为DIC:(1)血小板<100×109/L,或血小板进行性降低;(2)纤维蛋白原(Hbg)进行性降低或<1.5 g/L;(3)D-二聚体(D-D)阳性,或3P试验阳性,或血浆纤维蛋白降解物水平>20 mg/L;(4)凝血酶原时间(PT)延长超过3 s,或活化部分凝血活酶时间(APTT)延长超过10 s。
1.3 临床资料收集 采用该院自制的妇产科临床资料收集表整理并收集纳入产妇的临床资料,包括姓名、年龄、孕周、产次、分娩方式、基础疾病(糖尿病、高血压、高脂血症)、APTT、PT、凝血酶时间(TT)、纤维蛋白原(Fbg)、D-D、血小板等。信息收集完成后,由专人整理并妥善保管,采用双录入校对的方式录入Excel,制成最终的电子数据库。
1.4 统计学方法 以SPSS 21.0统计学软件进行数据处理,计量资料以x±s表示,采用t检验,计数资料以百分比表示,采用χ2检验,多因素分析采用Logistic回归分析,P<0.05为差异具有统计学意义。
2 结果
2.1 DIC产妇的临床特征分析 15例DIC产妇均存在不同程度的阴道出血倾向,其中5例伴有切口渗血,7例伴有皮肤黏膜出血,4例伴有腹腔内血肿,2例伴有血尿,1例伴有消化道出血。出血量:1例出血量<1 000 mL,7例出血量为1 000~2 000 mL,5例出血量为2 000~3 000 mL,2例出血量>3 000 mL。主要临床表现:休克8例,意识异常3例,紫绀5例,寒颤7例,呼吸困难7例。累及器官功能受损:受损器官≤1个者9例,受损器官>1个者6例。
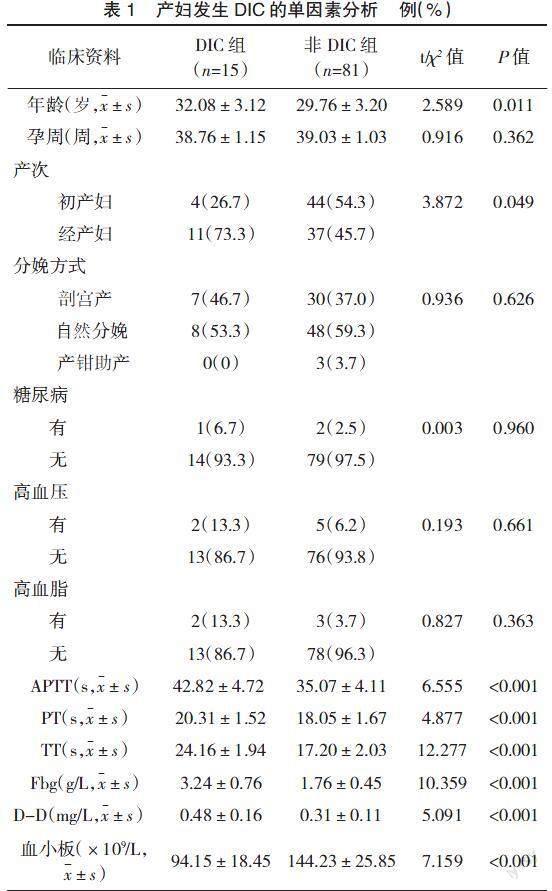
2.2 产妇发生DIC的单因素分析 2组产妇孕周、分娩方式、糖尿病、高血压、高血脂比较差异无统计学意义(P>0.05);DIC组产妇年龄、经产妇占比、APTT、PT、TT、Fbg水平、D-D水平均高于非DIC组,血小板计数低于非DIC组,差异有统计学意义(P<0.05),见表1。
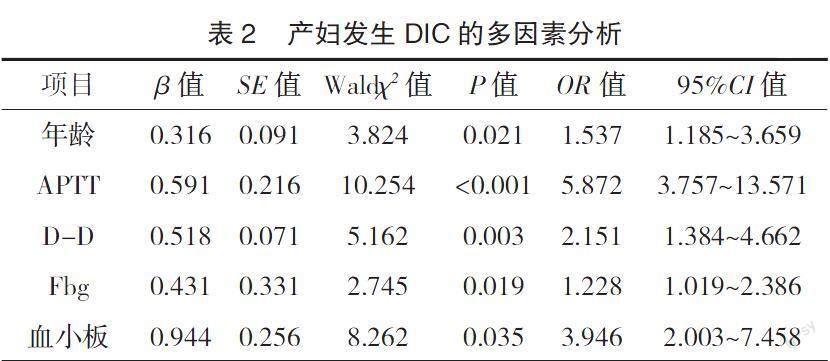
2.3 产妇发生DIC的多因素分析 以产妇是否发生DIC为因变量(发生=0,未发生=1),以表1中差异有统计学意义的因子为自变量进行赋值(经产妇=0,初产妇=1;年龄、APTT、PT、TT、Fbg、D-D、血小板计数均以原始数据录入方程),建立Logistic回归模型,分析显示,年龄、APTT、D-D、Fbg、血小板是产妇发生DIC的独立危险因素(OR>1,P<0.05),见表2。
3 讨论
有资料显示[8],DIC是导致产妇多器官功能衰竭和产妇死亡的主要因素之一,其致死率高达31%~80%,给母婴生命安全带来了极大的威胁。DIC的诱发因素复杂,任何能引起血管内细胞损伤的物质或促凝物质进入机体血液循环后均可能导致DIC发生[9-10]。即便如此,DIC的具体诱因相对容易确定,临床上一旦确 定病因后可针对性地干预,以阻止DIC病情发展。本研究结果显示,DIC组产妇年龄、经产妇占比、APTT、PT、TT、Fbg水平、D-D水平均高于非DIC组,而血小板计数低于非DIC组(P<0.05),提示产妇发生DIC与高龄、产次等因素有关。在国内的一项研究中,雷鸽等[11]选取了90例产妇为研究对象,根据是否发生DIC分为DIC组和非DIC组,结果显示DIC组产妇年龄、PT、APTT、Fbg水平、D-D水平均显着高于非DIC组(P<0.05),与本研究结果一致。
Logistic回归模型分析显示,年龄、APTT、D-D、Fbg、血小板均是产妇发生DIC的独立危险因素(OR>1,P<0.05)。随着年龄的增加,产妇子宫肌纤维的弹力降低,分娩阶段更容易出现子宫收缩乏力,无论是自然分娩亦或是剖宫产均可能增加产后出血的风险;在外界致病因素的作用下可导致产妇毛细血管、动静脉内血小板聚集,形成广泛的微血栓,进一步引起循环功能障碍,导致DIC的发生。另外,王晓慧[12]也指出,DIC是在多种致病因素的作用下导致的全身微血管内血小板聚集及纤维蛋白沉积,进而引发重要器官功能受损或衰竭,由此可见,血小板计数增加也可能预示着DIC的发生。此外,高龄产妇并发妊娠期高血压、妊娠期糖尿病的风险相对升高也可能导致DIC的发生。但本研究显示高血压、糖尿病都不是产妇发生DIC的危险因素,这可能是由于样本量偏小导致。
APTT是反映内源性凝血功能的重要指标,TT是纤维蛋白原转变成纤维蛋白的时间,PT则是反映外源性凝血功能的指标,APTT、TT、PT异常变化说明机体可能存在凝血功能障碍。周黎明等[13]研究指出,与健康产妇相比,DIC产妇的APTT、TT、PT均显着延长(P<0.05),提示DIC产妇可能存在明显的凝血功能异常,这在本研究中也得以体现。Fbg属于一种功能性糖蛋白,参与了机体凝血、止血的过程,该指标水平的增加提示机体血液呈高凝状态。D-D是纤维蛋白降解的产物之一,可以反映机体纤维蛋白溶解功能,目前已被证实对深静脉血栓、脑卒中以及冠状动脉粥样硬化等血栓类疾病具有良好的辅助诊断效能。在本研究中,APTT、Fbg水平、D-D水平异常是导致DIC发生的独立危险因素,提示通过监测APTT、Fbg水平、D-D水平变化有助于早期诊断或预测DIC的发生,对临床及时采取干预措施具有指导作用。
临床认为,早期诊断、及时有效的治疗及护理是改善DIC产妇预后的关键所在,有助于提高救治成功率。对于DIC的护理要点,可从以下几个方面入手:(1)加强健康宣教,提高孕产妇对DIC的认知水平,密切监测高龄产妇、高危产妇的凝血功能和生命体征,必要时可遵医嘱给予抗凝药物治疗,以防血液高凝。(2)大出血是DIC的典型症状表现,DIC产妇容易因失血过多导致休克,危及生命安全,因此需要密切留意产妇是否存在出血倾向,若发现异常及时上报处理,给予抗凝、输血、抗纤溶等治疗。(3)治疗期间注意产妇病情变化,定期检测凝血功能,并加强常规护理,如体位护理、消化道护理、饮食护理以及心理护理等。(4)密切监测患者心脏、肝肾、脑部、消化道等重要脏器组织的功能变化,观察是否出现肝肾功能损伤、呼吸衰竭、心功能异常等连锁反应,及时调整护理措施。
综上所述,产妇发生DIC的影响因素较多,包括高龄、APTT、Fbg、D-D以及血小板等,临床上应当加强产妇围生期管理,采取针对性的干预措施,以降低DIC发生风险。
参考文献
[1] 胡艳晶,张益明,宋景春,等.凝血酶-抗凝血酶复合物联合纤溶酶-α2抗纤溶酶复合物诊断创伤性弥散性血管内凝血的临床价值[J].医学研究生学报,2020,33(12):1283-1287.
[2] KADOHIRA Y,YAMADA S,MATSUURA E,et al.Aortic aneurysm-associated disseminated intravascular coagulation (DIC) that responded well to a switch from warfarin to rivaro-xaban[J].Intern Med,2017,56(21):2913-2917.
[3] HARAM K,MORTENSEN J H,MASTROLIA S A,et al.Disseminated intravascular coagulation in the HELLP syn-drome:how much do we really know?[J].J Matern-Fetal Neom,2017,30(7):779-788.
[4] 白月婷,史峻梅,赵怿,等.产科弥散性血管内凝血的病因分析及其临床特点[J].中国医师杂志,2020,22(12):1915-1917.
[5] 张月梅.经产妇发生弥散性血管内凝血的相关因素分析[J].中国生育健康杂志,2020,31(4):361-363.
[6] 龚晓莹,臧彬.产科相关弥散性血管内凝血如何诊断和处理[J].中国实用内科杂志,2021,41(6):475-479.
[7] 中华医学会血液学分会血栓与止血学组.弥散性血管内凝血诊断与治疗中国专家共识(2012年版)[J].中华血液学杂志,2012,33(11):978-979.
[8] 关金乐.产科弥散性血管内凝血的病因和临床特点及护理实施方法分析[J].当代医学,2018,24(24):171-172.
[9] 王湘平,李娇.凶险性前置胎盘产妇发生弥散性血管内凝血和失血性休克及子宫切除的相关因素分析[J/CD].临床医药文献电子杂志,2020,7(41):59.
[10] 隋峰,姚文鹏,耿墨钊,等.妊娠期弥散性血管内凝血的临床诊疗进展[J].医学综述,2022,28(2):313-320.
[11] 雷鸽,何美元.产科弥散性血管内凝血的高危因素分析及护理措施[J].血栓与止血学,2022,28(3):1035-1036.
[12] 王晓慧.凝血检验指标在弥散性血管内凝血诊断中的应用价值研究[J].中国实用医药,2021,16(30):207-209.
[13] 周黎明,陈秋莎,邓燕,等.弥漫性血管内凝血产妇围术期凝血与纤溶系统指标的检测及临床意义[J].现代生物医学进展,2020,20(11):2076-2079.
(收稿日期:2023-04-28)



