胡抢 孙元水★ 鲁航 唐智亮 章国梁
ω-3不饱和脂肪酸强化的肠内免疫营养在胃癌患者术后的临床应用
胡抢孙元水★鲁航唐智亮章国梁
目的 探讨ω-3不饱和脂肪酸强化的肠内免疫营养在胃癌患者术后的影响。方法 选取胃癌患者48例,肠内营养液中含有ω-3不饱和脂肪酸的为肠内免疫组,肠内营养液中不含有ω-3不饱和脂肪酸的为标准营养组,两组各有胃癌患者24例。两组患者均在术前1d,术后3、7、14d测定营养、免疫指标以及住院时间和住院费用。结果 术后7、14d,患者血液中白蛋白,转铁蛋白,免疫球蛋白IgG、IgA、IgM的含量以及淋巴细胞亚群CD4+、CD8+、CD4+/CD8+的值在免疫营养组中较标准营养组显着升高,差异有统计学意义(P均<0.05),同时免疫营养的住院时间和住院费用均低于标准营养组,差异有统计学意义(P<0.05)。结论 ω-3不饱和脂肪酸强化的肠内免疫营养可明显增强患者的抵抗力和改善患者的营养状况,缩短住院时间,节省住院费用,值得临床推广使用。
ω-3不饱和脂肪酸 肠内免疫营养 胃癌
肠内免疫营养(enteral immunonutrition)是指肠内营养液中加入免疫营养制剂,其可以通过自身发挥作用来刺激机体免疫细胞增生,维持正常、适度的免疫反应,减轻有害或过度的炎症反应,并保护肠屏障功能的完整性,减少肠道细菌的移位。临床上常用的免疫营养制剂有精氨酸(arginine)、ω-3脂肪酸(ω-3 fatty acids)、核甘酸(nucleotides)和谷氨酰胺(glutamine)[1],目前临床上对精氨酸、谷氨酰胺和核苷酸的作用机制研究较多,对ω-3不饱和脂肪酸的研究较少,本研究在胃癌患者术前1d和术后3、7、14d肠内营养支持中加入ω-3不饱和脂肪酸,观察其对胃癌患者免疫功能、营养状态以及术后住院时间和住院费用的影响。
1 临床资料
1.1一般资料 选取2015年1月至2016年1月在浙江省立同德医院行胃癌手术患者48例,其中24例患者肠内营养使用含有ω-3不饱和脂肪酸的免疫营养制剂(免疫营养组),另外24例患者使用不含有ω-3不饱和脂肪酸的标准营养制剂(标准营养组)。免疫营养组中男14例,女12例;年龄45~80岁,平均年龄(56.50±5.34)岁;平均体重(63.96±3.79)kg。标准营养组中男12例,女12例;年龄40~70岁,平均年龄(54.92±7.93)岁;平均体重(66.21±4.32)kg。两组患者年龄、性别、体重差异均无统计学意义(P均>0.05)。免疫营养组中行全胃切除术8例,行近端胃切除术6例,行远端胃切除术10例;标准营养组中患者行全胃切除术5例,行近端胃切除7例,行远端胃切除12例。患者入组标准:(1)经胃镜加组织活检确诊为胃癌患者。(2)术前未接受任何形式的放化疗。(3)肠道功能正常。(4)所有患者术前无内分泌、代谢性疾病,心、肺、脑、肝或肾功能正常。(5)能耐受麻醉和手术。本研究经过医院伦理委员会批准,提前告知患者并签署知情同意书。
1.2肠内营养方法 两组术中均放置空肠造瘘管,术后12h经空肠营养管滴注5%葡萄糖盐水500ml,若患者无不适,则术后第2天开始肠内营养,用营养压力泵向免疫营养组的空肠造瘘管持续滴注含有ω-3不饱和脂肪酸的瑞能(华瑞制药公司生产),剂量为20~25ml/(kg·d),第1天的速度约为20ml/h,以后逐日增加20ml/h,向标准营养组的空肠造瘘管滴注不含ω-3不饱和脂肪酸瑞素(华瑞制药公司),剂量30ml/(kg·d),第1天的速度约为20ml/h,后逐日增加20ml/h,两组均需根据患者临床表现情况调整滴速;同时两组患者均接受等量氮及等量热卡的肠内营养液,目标能量供给为25kJ/(kg·d),氮供给量为0.20g/(kg·d)左右,直至术后13d,此外,两组的肠内营养液中均应常规加入水溶性维生素、脂溶性维生素、矿物质等。
1.3观察指标 (1)检测两组患者的免疫指标:检测两组患者术前第1天以及术后3、7、14d血液中免疫球蛋白IgG、IgA、IgM的含量以及T淋巴细胞亚群CD4+、CD8+、CD4+/CD8+的值。(2)检测两组患者的营养指标:检测两组患者术前第1天以及术后3、7、14d血液中白蛋白(ALB)和转铁蛋白(TRF)的含量。(3)记录两组患者的住院费用和住院时间。
1.4统计学方法 采用SPSS 22.0 统计软件。计量资料以(±s)表示,两个独立样本的比较采用t检验,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1两组患者中主要免疫指标的比较 术后7、14d,免疫营养组中的IgG、IgA,IgM的含量以及CD4+、CD8+、CD4+/CD8+的值较标准营养组显着升高,差异有统计学意义(P均<0.05)。见表1。
表1 两组免疫指标的比较(±s)
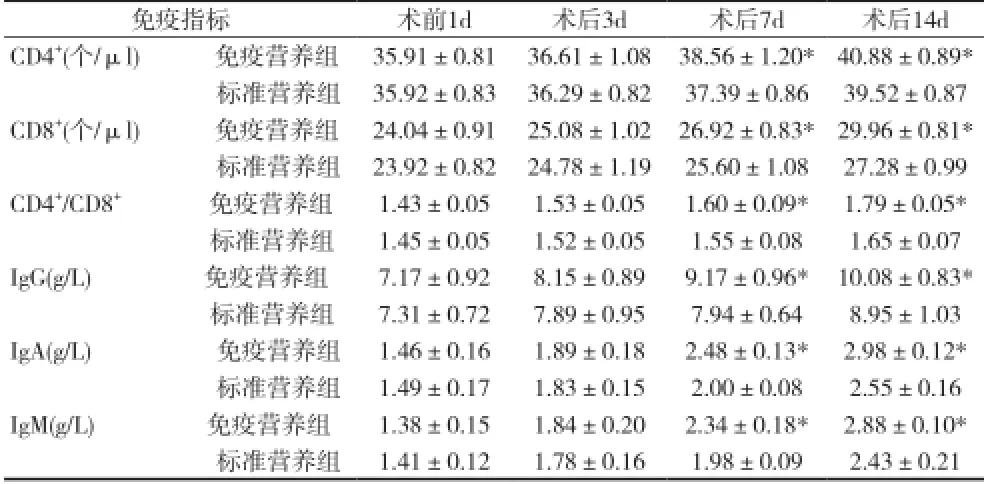
表1 两组免疫指标的比较(±s)
注:与标准营养组比较,*P<0.05
免疫指标术前1d术后3d术后7d术后14d CD4+(个/μl) 免疫营养组35.91±0.8136.61±1.0838.56±1.20*40.88±0.89*标准营养组35.92±0.8336.29±0.8237.39±0.8639.52±0.87 CD8+(个/μl) 免疫营养组24.04±0.9125.08±1.0226.92±0.83*29.96±0.81*标准营养组23.92±0.8224.78±1.1925.60±1.0827.28±0.99 CD4+/CD8+ 免疫营养组1.43±0.051.53±0.051.60±0.09*1.79±0.05*标准营养组1.45±0.051.52±0.051.55±0.081.65±0.07 IgG(g/L) 免疫营养组7.17±0.928.15±0.899.17±0.96*10.08±0.83*标准营养组7.31±0.727.89±0.957.94±0.648.95±1.03 IgA(g/L) 免疫营养组1.46±0.161.89±0.182.48±0.13*2.98±0.12*标准营养组1.49±0.171.83±0.152.00±0.082.55±0.16 IgM(g/L) 免疫营养组1.38±0.151.84±0.202.34±0.18*2.88±0.10*标准营养组1.41±0.121.78±0.161.98±0.092.43±0.21
2.2两组患者主要营养指标的比较 免疫营养组中术后7、14d患者血液中ALB和TRF含量较标准营养组高,差异有统计学意义(P均<0.05),见表2。
表2 两组营养指标的比较[g/L,(±s)]
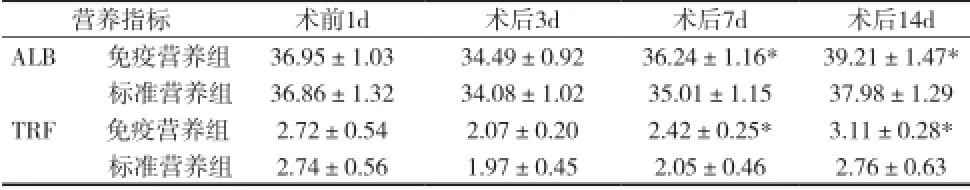
表2 两组营养指标的比较[g/L,(±s)]
注:与标准营养组比较,*P<0.05
营养指标术前1d术后3d术后7d术后14d ALB 免疫营养组36.95±1.0334.49±0.9236.24±1.16*39.21±1.47*标准营养组36.86±1.3234.08±1.0235.01±1.1537.98±1.29 TRF 免疫营养组2.72±0.542.07±0.202.42±0.25*3.11±0.28*标准营养组2.74±0.561.97±0.452.05±0.462.76±0.63
2.3两组患者住院时间和住院费用的比较 免疫营养组患者的住院时间和和住院费用均低于标准营养组,差异有统计学意义(P均<0.05),见表3。
表3 两组住院时间和住院费用比较(±s)
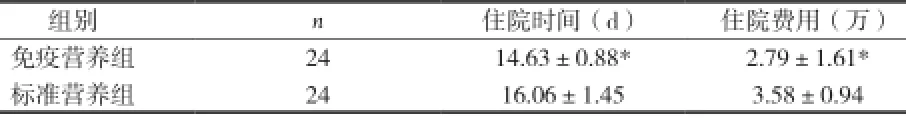
表3 两组住院时间和住院费用比较(±s)
注:与标准营养组比较,*P<0.05
组别n住院时间(d)住院费用(万)免疫营养组2414.63±0.88*2.79±1.61*标准营养组2416.06±1.453.58±0.94
3 讨论
胃癌是世界上最常见的第四大恶性肿瘤,其也是男性癌症死亡的第三大原因和女性癌症死亡的第五大原因,5年存活率在美国为26%,在欧洲为20%和中国为25%,手术切除仍为其主要的治疗方式[2],胃癌发展至中晚期会出现营养不良,甚至恶质病的发生,严重影响患者的生活质量。营养不良和物理损伤与手术创伤增加辅助性T细胞2(Th2)细胞的表达,使细胞的免疫介导受损,下丘脑-垂体-肾上腺轴与皮质醇和儿茶酚胺的释放,激活交感神经系统驱动Th2细胞的发展。Th2型细胞因子的产生表达为髓源性抑制细胞在淋巴组织中的积累,从而导致淋巴细胞功能受损,现在越来越多的证据表明,免疫调节肠配方中添加ω-3不饱和脂肪酸可以逆转免疫介导的变化和减少重大手术及创伤后的不良影响[3]。
ω-3脂肪酸包括二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),其在鱼油中发现的,一直被用来研究各种疾病状态的治疗成分。研究初步揭示的ω-3脂肪酸和EPA具有保护和抗炎作用,后续临床研究亦表明ω-3脂肪酸有治疗心血管疾病和慢性炎症的作用。前瞻性随机对照试验也证明了肠内ω-3不饱和脂肪酸补充剂在恶性肿瘤和癌性恶病质中有抗肿瘤细胞增殖,改善营养不良和纠正恶质病的作用[4]。
Jianmin Xu等[5]将60例胃癌患者随机分为两组,一组中加标准肠内营养液,另一组中加入标准肠内营养液的同时还加入了ω-3不饱和脂肪酸,术后7d加入ω-3不饱和脂肪酸的免疫营养组前白蛋白(PALB)和TRF较单纯肠内标准营养的组高,IgG在免疫营养组(13.35±2.06)较标准肠内营养组(9.59±2.23)高(P<0.05),CD4+/CD8+在免疫营养组(2.10±0.51)较单纯肠内营养组(1.62±0.52)高(P<0.05);C. Finco等[6]对14例胃肠肿瘤患者使用肠内免疫营养制剂(标准ω-3不饱和脂肪酸),其他14例胃肠肿瘤患者使用标准肠内制剂,在术后7d和术后1个月免疫营养组血液中ALB、PALB、淋巴细胞亚群和免疫球蛋白含量均高于单纯使用标准肠内营养组;Hua LIU等[7]和Jianmin Xu等[8]研究也表明加入ω-3不饱和脂肪酸的肠内免疫营养制剂的血清总蛋白(STP)、ALB、PALB和TRF以及CD4+/CD8+比值均比单纯使用标准肠内营养的高。
ω-3不饱和脂肪酸强化的肠内免疫营养制剂可以缩短胃癌患者术后的住院时间,节省住院费用,Urs Giger等[9]研究表明,使用ω-3不饱和脂肪酸肠内营养的患者住院时间(19.7±2.3)d较不加ω-3不饱和脂肪酸肠内营养患者的住院时间(20.1±1.3)d短,MBraga等[10]的研究发现使用ω-3不饱和脂肪酸强化免疫营养的胃癌患者住院期间总花费较使用普通肠内营养制剂低(P<0.05);也有研究发现肠内免疫营养可以降低C反应蛋白的含量,缩短炎症反应(SIRS)的时间[11-12]。
本研究中免疫营养组中术后7、14d患者血液中ALB、TRF含量较标准营养组显着升高,差异有统计学意义(P均<0.05);淋巴细胞亚群CD4+、CD8+、CD4+/CD8+的值以及免疫球蛋白IgG、IgA,IgM的含量在免疫营养组中较标准营养组术后7、14d高,差异有统计学意义(P均<0.05),同时免疫营养可以缩短患者的住院时间以及节省住院费用。
总之,ω-3不饱和脂肪酸强化的肠内免疫营养制剂能改善胃癌术后的营养和免疫状态,缩短住院时间,节省住院费用,提高胃癌术后患者的生活质量,值得临床推广。
[1]KG. Kreymann, MM. Berger, NEP Deutz, et al. ESPEN Guidelines on Enteral Nutrition: Intensive care. Clinical Nutrition, 2006, 25(2):210-223.
[2]Zeng Zongyue, Wang Jiangen, Zhao Liuyang, et al. Potential Role of microRNA-21 in the Diagnosis of Gastric Cancer: A Meta-Analysis. PLoS One, 2013,18(9):1-7.
[3]Marik PE,Flemmer M.Immunonutrition in the surgical patient. Europe PMC,2012,78(3):336-342.
[4]DH Jho, SM Cole, EM Lee, et al. Role of Omega-3 Fatty Acid Supplementation in Inflammation and Malignancy. Integr Cancer Ther June, 2004,3(2):98-111.
[5]Jianmin Xu,Yunshi Zhong,Dayong Jing,et al.Preoperative Enteral Immunonutrition Improves Postoperative Outcome in Patients with Gastrointestinal Cancer.World Journal of Surgery, 2006, 37(7): 1284-1289.
[6]C. Finco,P. Magnanini,G. Sarzo,M,et al.Prospective randomized study on perioperative enteral immunonutrition in laparoscopic colorectal surgery.Surgical Endoscopy,2007,21(7):1175-1179.
[7]Hua Liu,Wei Ling,Zhi Yong Shen,et al.Clinical application of immune-enhanced enteral nutrition in patients with advanced gastric cancer after total gastrectomy.Journal of Digestive Diseases, 2012, 13(8):401-406.
[8]Jianmin Xu,Yunshi Zhong,Dayong Jing,et al.Preoperative enteral immunonutrition improves postoperative outcome in patients with gastrointestinal cancer.world journal of surgery, 2006, 30(7): 1284-1289.
[9]Urs Giger, Markus Büchler, Jian Farhadi, et al. Preoperative immunonutrition suppresses perioperative inflammatory response in patients with major abdominal surgery-a randomized controlled pilot study. Ann Surg Oncol,2007,14(10):2798-2806.
[10]M Braga,L Gianotti,A Vignali,et al.Hospital resources consumed for surgical morbidity: effects of preoperative arginine and ω-3 fatty acid supplementation on costs.Nutrition,2005,21(11):1078-1086.
[11]Yoshiki Okamoto, Keiichi Okano, Kunihiko Izuishi, et al. Attenuation of the systemic inflammatory response and infectious complications after gastrectomy with preoperative oral arginine and ω-3 fatty acids supplemented immunonutrition. World Journal of Surgery,2009,33(9):1815-1821.
[12]Y. Cerantola, M. Hübner, F. Grass, et al.Immunonutrition in gastrointestinal surgery.British Journal of Surgery, 2011,98(1):37-48.
Objective To investigate the effect of ω-3 fatty acid enhanced enteral nutrition on postoperative patients with gastric cancer. Methods Select 48 cases of patients with gastric cancer,enteral nutrition liquid containing ω-3 fatty acid of enteral immune group and enteral nutrition liquid does not contain ω-3 fatty acid as the standard nutrition group,two groups of 24 gastric cancer patients,two groups of patients were in the preoperative first day,postoperative 3,7,14 days measured nutrition,immune index and hospitalization time and cost of hospitalization. Results On postoperative day 7,14,albumin in the blood of patients,transferrin,immunoglobulin IgG,IgA,IgM in the serum and lymphocyte subsets CD4+,CD8+,CD4+/ CD8+value in the immunonutrition group compared with standard nutrition group were significantly increased,the difference was statistically significant(P<0.05),at the same time immune nutrition hospitalization time and cost of hospitalization were lower than the standard nutrition group,the difference has statistical significance(P<0.05). Conclusions ω-3 fatty acid enhanced enteral nutrition can significantly enhance the patient's resistance and improve the nutritional status of patients,shorten hospital stay,save hospitalization costs,it is worthy of clinical application.
ω-3 fatty acid Enteral immunonutrition Gastric cancer
310053 浙江中医药大学第二临床医学院(胡抢 鲁航唐智亮)
310012 浙江省立同德医院胃肠外科(孙元水 章国梁)



