杨洁怡
糖尿病(DM)是一组以持续性高血糖水平为特征的代谢性疾病[1]。长期高血糖对身体各种组织及器官造成严重的功能障碍,糖尿病周围神经病变(DPN)是糖尿病常见的远期微血管慢性并发症之一,是排除其他病因后出现周围神经功能障碍的相关症状和体征,多以下肢对称性的疼痛和(或)感觉异常为主要表现,临床体格检查深感觉明显减弱或消失,可见跟腱反射、膝腱反射减弱甚至消失,且震动、位置等感觉减弱或消失,严重影响患者生活及工作[2]。DPN一旦确诊,除有效控制血糖水平外,积极的临床治疗是改善患者病变状态和神经功能的主要措施。作者应用依帕司他联合甲钴胺治疗DPN,疗效满意,现报道如下。
1 临床资料
1.1 一般资料 选择2015年1月至2017年2月本院DPN患者102例,DPN诊断标准[3]:(1)糖尿病临床诊断明确。(2)DPN发生于诊断糖尿病时或之后。(3)排除其他病因引起的末梢神经损害。(4)临床症状和体征符合DPN表现。(5)有DPN的自觉症状。(6)双侧跟腱反射减退或消失。(7)双侧内踝振动觉减弱或消失。(8)≥2个神经分别有≥1项检查出现明显异常。(9)有明确的糖尿病植物神经损害表现。符合(1)(2)(3)(4)条再符合(5)(6)(7)任意 2 条或(8)(9)其中1条即可明确DPN诊断。随机分为单纯组与联合组,各51例。单纯组男28例,女23例;年龄41~65岁,平均年龄(56.37±4.34)岁。DM病程5~14年,平均(10.16±3.47)年。DPN 病程 1~6年,平均(3.68±1.24)年。BMI(27.12±3.86)kg/m2;联合组男26例,女25例。年龄42~63岁,平均年龄(55.62±5.27)岁。DM病程5~16年,平均(9.86±4.29)年。DPN病程1~7年,平均(4.05±1.07)年。BMI(26.92±3.56)kg/m2。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入及排除标准 纳入标准:(1)DM及DPN临床诊断明确。(2)患者及家属同意参加,并自愿签署同意书。(3)入组前1个月未进行相关针对性治疗或参与类似临床研究。(4)临床表现主要为不同程度的对称性疼痛、感觉异常、便秘、腹胀等。(5)患者年龄>18岁,<70岁。(6)无其他严重并发症或其他严重基础病。(7)精神状态及顺从性良好。排除标准:(1)与DM及DPN临床诊断不符。(2)对治疗药物过敏或过敏体质者。(3)心、肺、肾等功能严重不全者。(4)特殊人群:妊娠及哺乳期妇女、结核、精神异常。(5)出现增殖性视网膜病变。(6)中途主动退出。
1.3 方法 两组患者均给予常规降糖、饮食与运动治疗,单纯组患者在此基础上给予依帕司他口服,50mg/次,3次/d;联合组则在单纯组基础上联合甲钴胺口服治疗,0.5mg/次,3次/d,30d为1个疗程,治疗3个疗程。
1.4 疗效评价评价标准[4](1)显效:治疗后临床症状消失或明显改善,神经反射检查好转或恢复正常,肌电图示运动神经传导速度(MNCV)、感觉神经传导速度(SNCV)明显增加或正常。(2)有效:治疗后临床症状好转,神经反射检查得到一定改善,肌电图示MNCV、SNCV有所提高,但<5m/s。(3)无效:未达有效标准或病情加重。有效率(%)=(显效+有效)/单组总例数×100%。
1.5 观察指标 (1)治疗前后采用密歇根糖尿病神经病变评分量表(MDNS)评价患者神经病变的严重程度,MDNS评分标准[5]:量表包括感觉、肌力、反射和体格检查四项,并按评分评价周围神经病变程度,得分越高,越严重,MDNS>6分为存在周围神经病变,0~6分为无;7~12分为轻度;13~29分为中度;30~46分为重度。(2)比较两组患者神经电生理包括MNCV和SNCV治疗前后的变化。(3)比较两组患者血清超氧化物歧化酶(SOD)、MDA和8-羟基脱氧鸟苷酸(8-OhdG)治疗前后的变化。
1.6 统计学方法 采用SPSS 22.0统计软件。计量资料用(±s)表示,用t检验,计数资料用%表示,用χ2检验。P<0.05差异有统计学意义。
2 结果
2.1 临床疗效比较 见表1。
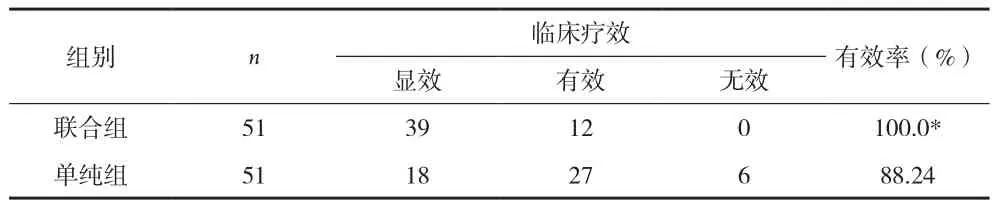
表1 两组患者临床疗效比较(n)
2.2 两组患者治疗前后神经病变的严重程度比较 见表2。
表2 治疗前后两组患者MDNS评分比较(±s)

表2 治疗前后两组患者MDNS评分比较(±s)
注:与治疗前比较,*P<0.05,与单纯组比较,#P<0.05
组别 n MDNS评分治疗前 治疗后联合组 51 27.62±5.66 8.47±3.10*#单纯组 51 25.45±5.27 15.32±4.35*
2.3 两组患者MNCV、SNCV治疗前后的变化 见表3。
表3 两组患者MNCV、SNCV治疗前后变化比较(±s)
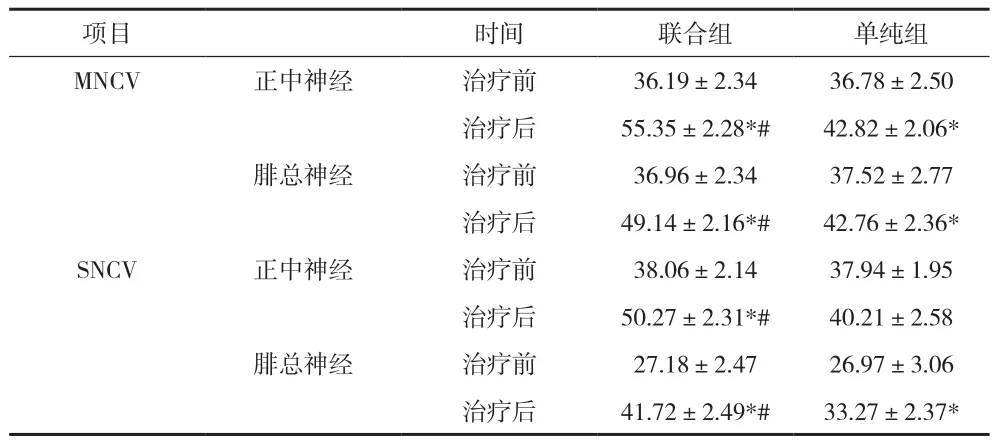
表3 两组患者MNCV、SNCV治疗前后变化比较(±s)
注:与治疗前比较,*P<0.05,与单纯组比较,#P<0.05
项目 时间 联合组 单纯组MNCV 正中神经 治疗前 36.19±2.34 36.78±2.50治疗后 55.35±2.28*# 42.82±2.06*腓总神经 治疗前 36.96±2.34 37.52±2.77治疗后 49.14±2.16*# 42.76±2.36*SNCV 正中神经 治疗前 38.06±2.14 37.94±1.95治疗后 50.27±2.31*# 40.21±2.58腓总神经 治疗前 27.18±2.47 26.97±3.06治疗后 41.72±2.49*# 33.27±2.37*
2.4 两组患者SOD、MDA和8-OhdG治疗前后变化 见表4。
表4 两组患者SOD、MDA和8-OhdG治疗前后变化(±s)
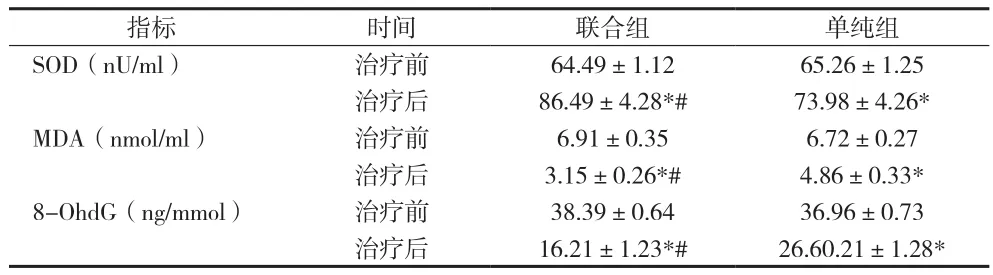
表4 两组患者SOD、MDA和8-OhdG治疗前后变化(±s)
注:与治疗前比较,*P<0.05,与单纯组比较,#P<0.05
指标 时间 联合组 单纯组SOD(nU/ml) 治疗前 64.49±1.12 65.26±1.25治疗后 86.49±4.28*# 73.98±4.26*MDA(nmol/ml) 治疗前 6.91±0.35 6.72±0.27治疗后 3.15±0.26*# 4.86±0.33*8-OhdG(ng/mmol) 治疗前 38.39±0.64 36.96±0.73治疗后 16.21±1.23*# 26.60.21±1.28*
3 讨论
DPN其发病机制尚未完全明确,但相关临床研究表示DPN与醛糖还原酶、氧化应激反应、自身免疫和神经营养因子有密切关系[6]。氧化应激在DM患者中已被熟识,DM患者在血糖水平不稳定出现波动时机体产生糖化氧化或自氧化作用,此过程中出现大量的活性氧,对机体细胞内线粒体DNA具有一定的损伤作用,而丙二醛可有效反映细胞损伤程度,SOD可有效反映机体的抗氧化能力,24h 8-OhdG是反映氧化应激反应和自由基水平有效指标[7]。另外,SNCV及MNCV是反映DPN患者神经功能的直接性指标,有研究表示,多元醇旁路的激活在DPN发病中起重要的作用,醛糖还原酶参与的限速反应可使细胞外肌醇进入细胞减少,最终导致 Na/K-ATP酶活性下降,细胞内钙离子聚集,从而导致神经传导速度下降[8]。
依帕司他是作用于多元醇通路的特异性药物,在糖尿病慢性并发症治疗中应用十分广泛,可通过可逆性抑制醛糖还原酶的活性,减少果糖和山梨醇在细胞内的堆积,恢复Na/K-ATP酶活性和肌醇的活性,内皮细胞NO含量增多,蛋白激酶C信号通路、内皮细胞的粘附、高糖介导的中性粒细胞和内皮粘附因子的表达被抑制,从而减少机体内羧甲基赖氨酸产物,起到治疗DPN的作用[9];甲钴胺是维生素B12的衍生物,也是DPN临床治疗的主要药物之一,通过参与体内甲基转移作用,促进核酸、蛋白质及卵磷脂的合成,对神经髓鞘和轴突的形成与再生具有重要的作用,从而改善患者神经功能、修复受损的神经细胞,起到治疗 DPN 的作用[10]。
本资料显示,单纯组和联合组临床治疗有效率分别为88.24%和100%,治疗后两组MDNS评分、MNCV与SNCV以及SOD、MDA和8-OhdG水平均有所改善,但联合组患者几项指标治疗后改善程度较单纯组更为明显,差异均有统计学意义(P<0.05)。提示依帕司他联合甲钴胺治疗DPN临床效果明显,能够有效提高神经传导功能,改善氧化应激水平,值得临床应用推广。



