张建明 钟建国
直肠肿瘤是消化系统常见疾病,包括直肠腺瘤与直肠癌,其中直肠腺瘤是由腺上皮异常增生所引起的直肠良性肿瘤,属大肠息肉中肿瘤性息肉,且直肠腺瘤与直肠癌的发生存在紧密联系,同时直肠肿瘤性质不同,其治疗及预后同样存在一定的差异,而准确鉴别直肠肿瘤的良恶性及临床分期是合理选择治疗方案的关键[1]。目前常采用MRI、CT、直肠指检、直肠腔内超声(IRUS)、肠镜等诊断直肠肿瘤。为探讨IRUS与多层螺旋CT(MSCT)鉴别直肠良恶性肿瘤的临床价值,作者对本院收治的80例直肠肿瘤患者的临床资料进行了回顾性分析,现报道如下。
1 资料与方法
1.1 一般资料 本院2013年4月至2016年5月收治的80例直肠肿瘤患者的临床资料。所有患者入院后均接受IRUS及MSCT检查,有明确病理学结果,且临床及影像学资料完整。其中男46例,女34例;年龄23~76岁,平均(55.1±3.6)岁。体重 45~88kg,平均(65.3±10.7)kg。其中直肠癌62例,直肠腺癌18例。
1.2 方法 (1)IRUS检查。采用美国ATL公司HDI 5000型彩色多普勒超声诊断仪,经直肠腔内探头,直径1cm,探头频率5~9MHz,扫描角度145°。扫描前所有患者均灌肠准备,左侧卧,伸直左腿,屈曲右腿,先行直肠指检明确肿块情况,随后向直肠内注入400ml左右生理盐水,超声探头表面涂耦合剂,橡胶套保护,排空气体,涂耦合剂后缓慢进入肛门,探头指向脐部,通过肛管后,缓慢转动探头,指向骶尾骨,抵达直肠壶腹部后转向脐部,观察直肠内肿块情况,观察其形态、方位、大小、血流、回声、浸润情况、淋巴结及附近组织受累情况,时间15~20min。(2)MSCT检查。采用美国GE公司Lightspeed 16多层螺旋CT扫描仪进行盆腔扫描,检查前1d进流质,检查前0.5~1h作肠道准备,清洁灌肠,经肛门注气800ml,充分扩张直肠,仰卧位作CT平扫,自下而上作断层扫描,并作增强扫描,经肘静脉注射碘对比剂碘海醇,速率3.0ml/s,总剂量50ml,自骶髂关节上侧1cm扫描至肛缘下侧3cm,确保全肠扫描,设定管电压120kV,电流250mAs,螺距0.8~1.0,层厚5mm,矩阵512×512,动脉期延迟30s,静脉期延迟70s,平衡器延迟180s。所有数据均作1mm重建,传输至工作站。
1.3 图像分析 选择2名高资历、经验丰富影像科医师对获取超声、CT图像进行阅片,两人意见不一时协商取一致意见。
1.4 直肠癌分期标准 参照国际抗癌联合会、美国癌症联合会制定的直肠癌TNM病理分期标准[2]。T分期:T1期:肿瘤侵犯黏膜下层或局限于黏膜层;T2期:侵犯固有肌层;T3期:穿透固有肌层到达浆膜下层,或侵犯无腹膜覆盖结直肠旁组织;T4期:肿瘤突破肌层,侵犯或粘连其他组织结构。区域淋巴结(N分期)。N0:无区域淋巴结转移;N1:1~3枚淋巴结转移;N2:≥4枚区域淋巴结转移。
1.5 IRUS及MSCT直肠癌分期 IRUS分期参照TNM分期标准;多层螺旋CT分期参照通过的国际抗癌联合会、美国癌症联合会制定的直肠癌MSCT分期标准[3]。T0期:无发现;T1期:肠壁局限性增厚>5mm,肠腔未见狭窄,或见肠壁内肿块隆起,肠壁无变形或挛缩;T2期:肠壁局限性增厚>6mm,肠壁外缘光整,脂肪层清晰,肠壁挛缩变形,但无明显狭窄;T3期:肿瘤侵犯肠壁外侧但局限于肠壁内,外缘不光整,肠腔见狭窄,外周脂肪密度增高且模糊,但无条索状高密度影,未累及周围脏器官及组织;T4期:肿瘤突破肠壁外层,肠壁增厚变形,伴狭窄,外周脂肪增高且模糊,伴条索状、线状高密度延长,蔓延至肠壁外。N分期同病理分期标准。
1.6 统计学分析 采用SPSS 20.0统计软件。计数资料以()表示,组间比较采用t检验,计量资料采用构成比(%)表示,进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 病理结果 80例患者中直肠癌62例,其中腺癌47例,黏液腺癌12例,印戒细胞癌2例,恶性间质瘤1例;直肠腺瘤18例,其中绒毛状腺癌5例,管状腺腺瘤6例,绒毛状腺瘤不典型增生3例,管状绒毛状腺瘤2例,管状腺瘤不典型增生2例。
2.2 IRUS与MSCT诊断直肠肿瘤良恶性准确率比较 见表1。

表1 IRUS与MSCT诊断直肠肿瘤良恶性准确率比较[n(%)]
2.3 IRUS、MSCT对直肠癌分期准确性比较 见表2。
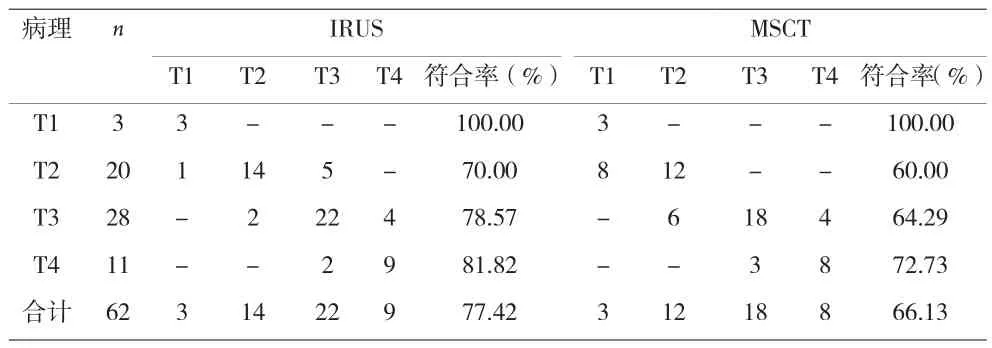
表2 IRUS、MSCT对直肠癌分期准确性比较(n)
2.4 直肠肿瘤IRUS图像表现 18例直肠腺瘤超声均可见肿物自黏膜层向肠腔突起,多层赘生性生长,表现为乳头状或类圆形,超声探头触及有移动感,肌层、浆膜层、黏膜层均清晰可见(见图1)。62例直肠癌大部分均见低回声图块,形态不规则,呈溃疡型或隆起型,部分肿物占据整个肠腔,同伴肠腔狭窄或肠梗阻,肠壁僵硬,浸润直肠壁,部分肿瘤突破浆膜层,浸润及粘连周围组织(见图2)。其中41例伴直肠周围多发淋巴结,淋巴结呈圆形或椭圆形,直径0.3~1.0cm,呈不均质低回声,内部见丰富血流信号,术后经病理证实阳性淋巴结29例,阴性淋巴结12例(见图3)。直肠癌患者可见血管自肠壁突入肿瘤内,见丰富、粗细不均红蓝色血流,呈点状或条索状,走向迂回,分布杂乱(见图4)。

图1 直肠腺瘤超声图像

图2 直肠癌超声图像

图3 直肠癌伴淋巴结超声图像
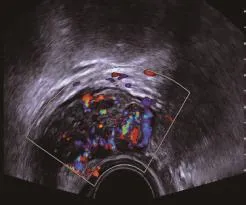
图4 直肠癌超声血流信号图
2.5 直肠肿瘤MSCT图像表现 直肠腺瘤平扫见肠壁增厚,增厚直径<5mm,肠腔内见突起结节,厚度<5mm,边缘光滑,软组织密度均匀(见图5),增强扫描见肿块均匀强化,肠壁缘光滑,肠轴系膜清晰(见图6);直肠癌平扫见环周肠壁明显增厚,呈局限性肿瘤生长,肠腔内见不规则菜花样、分叶状形,浸润肠壁,突破浆膜层,肠壁外缘模糊(见图7),见细小毛刺或结节(见图8),增强扫描见肿块强化,静脉期密度降低,呈快进快出特点,肿瘤环肠壁全周者肠壁僵硬,肠腔狭窄,上下肠管对比明显,部分见转移淋巴结。
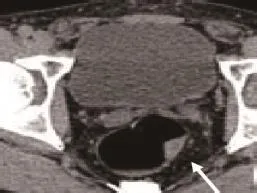
图5 直肠腺瘤MSCT平扫

图6 直肠腺瘤MSCT增强动脉期

图7 直肠癌T3期MSCT平扫

图8 直肠癌T4期MSCT平扫
3 讨论
直肠癌是消化系统常见恶性肿瘤,近年来发病率有所上升[4]。且直肠癌患者早期常无典型症状,部分就诊时已进展至晚期,而早期确诊直肠癌,明确其病理分期则是指导临床治疗的关键。目前腔内超声以其操作简便、敏感度高、无痛苦、可重复等优势已成为直肠肿瘤筛查的首选方案,其可准确定位肿瘤位置,清晰显示肿瘤形态、大小及直肠壁层次结构,有助于观察肿瘤浸润深度及与邻近组织解剖关系[5]。既往研究[6]显示,IRUS对直肠癌术前分期准确性在82%~96%之间,且对鉴别直肠肿瘤良恶性有重要的价值。一般可通过对比直肠肿瘤大小、形态、边界、内部回声、肠壁结构、肠周淋巴结等来鉴别病变的良恶性程度[7]。
直肠腺瘤通常比较小,当腺瘤直径>3cm时其恶性可能性增高,同时肿瘤基底增宽者其腺瘤癌变可能性亦较高。而直肠癌肿块相对较大,部分可占据整个肠腔,可见肠腔狭窄。在形态方面,直肠腺瘤呈类圆形或乳头状,边界清晰,触及可移动,而直肠癌则呈溃疡或隆起型,形态不规则,边界模糊,且无包膜[8]。在病理方面,直肠腺瘤通常见腺体密集,管腔大小不均,其细胞核常位于基底,无异型性,而直肠癌管腔大小不均,大部分见细胞核增大,排列不齐,均可见异性,且呈浸润性生长。在回声方面,一般直肠腺瘤内部回声尚且均匀,多呈稍强回声,而直肠癌多呈不均质或低回声[9]。在肠壁结构方面,直肠腺瘤肠壁黏膜层、浆膜层、肌层均清晰,而直肠癌患者肠壁僵硬,直肠壁浸润明显,且部分肿瘤突破浆膜层,与附近组织粘连。此外,直肠癌淋巴结转移率较高。而IRUS对直肠周围淋巴结转移检出率较高,其在超声声像图常表现为低回声,呈圆形。另血流动力学也是鉴别良恶性肿瘤的重要依据,一般恶性肿瘤内部血供较为丰富,微血管密度高[10]。
本资料中,80例直肠肿瘤患者均完成IRUS及MSCT检查,结果发现IRUS对直肠腺瘤、直肠癌检出率均高于MSCT,但差异无统计学意义,可能与本组纳入样本数量较小有关,而IRUS诊断准确率高于MSCT则可能与IRUS对肿瘤肠壁结构显示清晰有关。既往研究报道[11],IRUS对直肠癌分期准确性达80%~90%,本资料IRUS结果略低于早期报道结论,可能与本组高位直肠癌、肠腔狭窄例数较多,探头无法进入肠腔有关。此外,本组3例肿瘤周围炎症反应较为明显,而IRUS无法区分肿瘤及附近炎症反应,导致分期错误。另外由于肠道准备不充分、部分肿物(子宫内膜异位囊肿、淋巴瘤、脓肿)突入肠腔及早期直肠癌侵犯黏膜层与绒毛腺瘤难以区分均可能导致误诊。本资料还发现,在直肠癌术前分期中IRUS存在过高分期的缺陷,主要与肿瘤周围组织反应,包括炎症反应及结缔组织增生存在密切关联,其导致肠壁黏膜下层强回声中断,导致分期过高。
综上所述,IRUS对直肠肿瘤诊断准确性高,对良恶性直肠肿瘤鉴别价值高,在评定肿瘤浸润深度方面有显着优势,且价格低廉、操作简单,可作为良恶性直肠肿瘤鉴别的首选诊断方式。



