王晓明 凌池芳 宋燕薇 曹怡健 宋斌斌
结外NK/T细胞淋巴瘤鼻型在亚洲和南美洲较为常见,西方国家相对罕见[1]。近期研究证实,放射治疗是早期NK/T淋巴瘤的重要治疗手段[2],50 Gy高剂量放疗不仅能提高局部控制率,还能改善远期生存率[3]。该肿瘤具有黏膜下广泛侵犯和易侵犯鼻背鼻翼处皮肤、上颌窦等临近结构的特征,早期推荐采用局部扩大野IMRT照射[4]。由于高能X线存在建成区,浅表区域肿瘤剂量不足,通常需要在患者肿瘤对应体表部位放置一定厚度的组织补偿物,以提高肿瘤表面剂量,使靶区剂量分布更加均匀。然而,鼻腔的位置体表起伏较大,补偿物和体表间存在一定空隙。本文旨在探讨鼻腔NK/T细胞淋巴瘤放疗时组织补偿物的两种引入方式的剂量学差异,以期为临床治疗选择提供依据。
1 资料与方法
1.1 临床资料 选取2017年1月至2020年5月于嘉兴市第一医院行首次调强放疗的早期原发鼻腔NK/T细胞淋巴瘤患者27例,均根据2008年WHO淋巴瘤诊断标准进行病理学确诊,无远处转移。其中,男21例、女6例,年龄平均(54.9±17.9)岁。所有患者放疗前均签署知情同意书,定位及验证均基于CT扫描,据此分为定位组和验证组,定位组采用虚拟组织补偿物设计逆向调强计划,验证组使用真实补偿物获得治疗计划。
1.2 方法 (1)固定方式:采用头颈肩热塑膜固定,制作时尽量均匀拉伸,使面膜平整贴合于患者体表面,冷却定型20 min,充分收缩使其达到稳定状态[5]。(2)CT扫描:使用GE Light Speed 4排CT模拟定位机(美国通用公司)进行模拟定位及扫描验证。扫面范围从额窦上5 cm至锁骨头下缘5 cm,扫描层厚0.3 cm,标出体位定位线和CT-Marker点。CT定位扫描后得到的图像命名为CT-A1。验证扫描时患者的体位及扫描方式与定位扫描一致,扫描前于患者鼻前区放置密度为1.03 g/cc、尺寸为15 cm×15 cm的组织补偿物(美国MEDTEC公司),放置位置尽可能与定位组计划的虚拟组织补偿物一致,扫描后得到的图像命名为CT-A2。定位组和验证组的图像均通过DICOM接口传输至Pinnacle 9.2计划系统(荷兰飞利浦)。(3)靶区勾画及放疗计划:根据CT、MRI等影像资料以及ICRU62和83号报告原则勾画放疗靶区及危及器官,使用Pinnacle 9.2治疗计划系统,采用6MV-X线7野调强放射治疗技术优化靶剂量。处方剂量:50Gy/2Gy/25f;靶区剂量:V95%≥98%、V100%≥95%、V110%≤2%;危及器官(OAR)限量要求:脊髓最大剂量Dmax<40Gy;脑干、视神经、视交叉最大剂量Dmax<50Gy;晶体最大剂量小于8Gy;腮腺V30≤50%;眼球、口腔、颞叶、垂体等保证靶区覆盖前提下受量尽量降低。①定位组:在CT-A1图像上自动添加0.5 cm虚拟组织补偿物,密度1.0 g/cm3,利用系统工具测量并修剪虚拟补偿物尺寸至15 cm×15 cm,使其尽量贴合热塑膜表面,记录补偿物边界与中心点的位置尺寸。按照上述靶区剂量及OAR限量的要求优化治疗计划,直至得到满足临床要求的治疗计划。②验证组:使用计划系统图像融合功能将CT-A1内靶区及OAR轮廓分别复制到CT-A2图像,用QA工具将定位计划移植到CT-A2图像,不需重新优化剂量,直接计算得到验证计划。
1.3 剂量学评估指标 (1)D98%、D2%、V95%、V100%、V110%、CI、HI:Dx%代表受到x%处靶区体积所受到的照射剂量;Vx%代表受到x%处方剂量照射的靶区体积占靶区总体积的百分比;适形性指数(CI),计算公式为CI=Vptv95%2/(Vptv×V95%),其中Vptv95%为95%等剂量线包括的体积,Vptv为PTV的总体积;均匀性指数(HI),计算公式为 HI=(D2%-D98%)/D50%。(2)OAR评估,包括左右晶体Dmax、脑干Dmax、左右视神经Dmax、视交叉Dmax。
1.4 统计学方法 采用SPSS 19.0统计软件。计量资料以()表示,符合正态分布采用配对样本t检验,不符合正态分布采用Wilcoxon符号秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组计划靶区的剂量学指标比较 见表1。定位组CI、HI优于验证组,验证组的靶区剂量覆盖不能满足临床要求。
表1 两组计划靶区的剂量学指标比较()
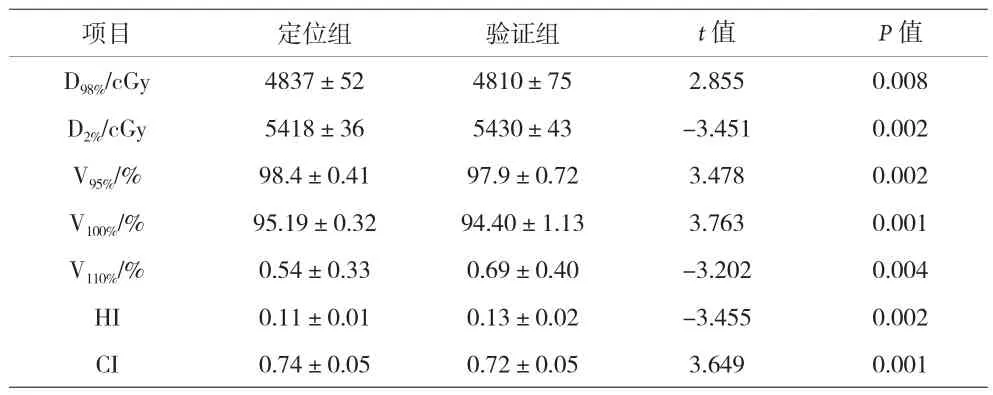
表1 两组计划靶区的剂量学指标比较()
项目 定位组 验证组 t值 P值D98%/cGy 4837±52 4810±75 2.855 0.008 D2%/cGy 5418±36 5430±43 -3.451 0.002 V95%/% 98.4±0.41 97.9±0.72 3.478 0.002 V100%/% 95.19±0.32 94.40±1.13 3.763 0.001 V110%/% 0.54±0.33 0.69±0.40 -3.202 0.004 HI 0.11±0.01 0.13±0.02 -3.455 0.002 CI 0.74±0.05 0.72±0.05 3.649 0.001
2.2 两组OAR剂量学指标比较 见表2。验证组左右两侧晶体各出现1次最大剂量>800 cGy,说明组织补偿物的不同引入方式可能导致危及器官受量超出临床处方剂量的限值。
表2 两组OAR剂量学指标比较()
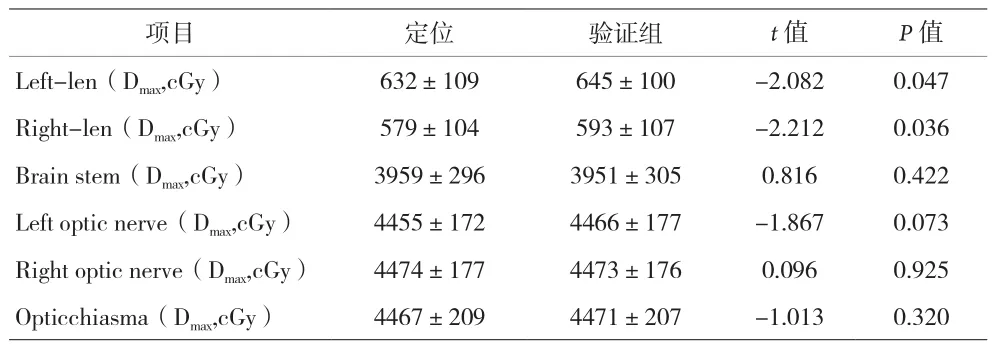
表2 两组OAR剂量学指标比较()
项目 定位 验证组 t值 P值Left-len(Dmax,cGy) 632±109 645±100 -2.082 0.047 Right-len(Dmax,cGy) 579±104 593±107 -2.212 0.036 Brain stem(Dmax,cGy) 3959±296 3951±305 0.816 0.422 Left optic nerve(Dmax,cGy) 4455±172 4466±177 -1.867 0.073 Right optic nerve(Dmax,cGy) 4474±177 4473±176 0.096 0.925 Opticchiasma(Dmax,cGy) 4467±209 4471±207 -1.013 0.320
3 讨论
放射治疗是早期结外型鼻腔NK/T细胞淋巴瘤的根治性手段[2],ⅠE期和ⅡE期患者靶区根据肿瘤局部受侵范围需要,包括双侧鼻腔、部分或全部上颌窦、筛窦、硬腭鼻旁组织器官或颈部淋巴结[6]。因此,眼球、晶体、视神经、视交叉等临近危及器官的保护尤为重要。设计计划时应考虑到鼻腔的解剖结构,给予更多射野或使用更加复杂的照射技术来减小空腔效应的影响[7],IMRT技术能够解决上述问题[4,8]。鼻腔NK/T细胞淋巴瘤靶区包括鼻腔黏膜下,由于位置浅表,IMRT计划设计时会使用组织补偿物。因为大多数的组织补偿物具有一定的硬度,不能紧贴皮肤表面,补偿物与体表之间存在大小不等的空腔,尤其是Bolus置于热塑膜之上时形成的一个个独立空腔。组织补偿物从定位、计划至每1次放疗实施几乎不会完全重复。空腔厚度是造成剂量沉积的重要因素,空腔厚度≤2 mm时,对浅层剂量沉积没有影响[9];空腔厚度≤5 mm时,最大剂量深度基本不变;随着空腔厚度进一步增加,最大剂量深度逐渐减小。此外,照射角度、射野大小等也可影响空腔下的组织剂量沉积,所以Bolus应用过程中需要确保其与皮肤之间的空隙≤5 mm,这在浅表肿瘤的治疗中十分重要[10]。补偿物与皮肤之间的空腔是放射治疗的一个难题,侯彦杰等[11]利用3D打印技术制作组织补偿物,使其与患者轮廓更加契合,取得了良好效果。
本研究对临床常用的两种补偿物引入方式进行对比研究。定位组计划中引入虚拟补偿物会填入热塑膜的每个小孔内,需要使用轮廓编辑工具手工将小孔及空腔部分填入的补偿物修剪去除,并对各个边界进行修剪,使其尽可能接近真实情况。即便如此,定位组和验证组的放疗计划仍存在明显差异,验证组的靶区覆盖率显着降低。OAR受量比较,两组差异无统计学意义,但两种计划逐项比较均存在不同程度的剂量差异。值得关注的是,两组计划的晶体受量存在显着差异(P<0.05),可能与晶体位于浅表,其剂量受组织补偿物引入差异的影响较大相关[10]。分析晶体受量变化较大的患者计划,发现与靶区接近的患侧晶体剂量变化更加明显。结果表明,外加虚拟组织补偿不能预先了解实际照射时的空气间隙和位置大小,而定位、验证或治疗实施中Bolus的空间位置均不固定,从而导致治疗不精确,与BUTSON等[9,12]的研究结果一致。
本治疗中心在热塑膜制作前,将备好的大小合适的补偿物放置在患者鼻腔前区,其下界平外鼻孔以保证患者呼吸通畅,并以胶布固定防止滑动;将头颈肩热塑膜尽量均匀拉伸,使面膜与患者体表面平整贴合,轻轻按压鼻翼两侧,使热塑膜、补偿物贴合皮肤,以减少空腔;待其充分冷却后,画出补偿物界限,用3M双面胶固定于面膜内侧,按压使其充分贴合;取下后,使用针线将其与面膜网孔缝合,防止放疗疗程中补偿物脱落;三种组织补偿物引入方式的CT横断面图像,见图1。通过热塑膜内放置补偿物设计放疗计划,发现靶区剂量及危及器官的限量均得到良好的剂量学分布。逐层看计划时Bolus与体表贴合紧密,仅在鼻翼两侧后方出现较小的空腔,该方法与面膜外放置补偿物放疗计划的比较有待进一步研究,但后者具备良好重复性,与目前研究的通过各种方法提高摆位重复性、更好地还原放疗计划目的一致。

图1 三种组织补偿物引入方式的CT横断面图像
综上,鼻腔NK/T细胞淋巴瘤调强放疗时组织补偿物的引入不一致会导致靶区欠量及危及器官受量的改变,故而放射治疗过程中应该密切关注补偿物引入方式不一致的问题,以保证治疗计划实施的准确性。在面膜制作前于热塑膜内放置组织补偿物,可以提高治疗实施中组织补偿物空间位置的一致性,但该方法的剂量学优势以及能否转化为临床获益有待进一步验证。



