俞清江 张浩 王清清
肝癌是导致恶性肿瘤相关死亡的第三大病因[1]。多数患者发现时往往已是中晚期,或失去手术机会,即使行根治性手术,5年内复发转移率高达60%~70%,预后极差[2-4]。索拉菲尼(Sorafenib)是晚期肝癌的一线推荐用药[5],但长期使用可引起患者耐药,其疗效有所限制。研究表明,大黄素(Emodin)可作为辅助用药增强化疗药物的敏感性[6],其广泛存在于大黄、虎杖、何首乌等中药材中,是一种天然蒽醌衍生物,目前已被用于胰腺癌、胃癌、直肠癌等多种恶性肿瘤的临床治疗[7-8]。本研究初步探讨大黄素增强肝癌索拉菲尼耐药细胞对索拉菲尼的药物敏感性的作用机制,为临床上治疗晚期肝癌索拉菲尼耐药提供理论基础。
1 材料与方法
1.1 细胞与试剂 人肝癌Huh7细胞株,购自中国科学院上海生命科学院细胞所;胎牛血清(FBS),购自美国Gibco公司;DMEM/F12培养基,购自美国Hyclone公司;大黄素(Emodin)购自成都普瑞法科技开发有限公司;一抗兔抗人Akt、p-Akt、Bcl-2、Bax、Caspase3、GAPDH均购自美国Abcam公司;RIPA裂解液、胰酶细胞消化液、PMSF、SDS-PAGE凝胶配制试剂盒、BCA蛋白定量试剂盒、Annexin-FITC凋亡试剂盒均购自上海碧云天生物科技有限公司。
1.2 研究方法 (1)细胞培养:本课题组前期已用浓度递增诱导法成功诱导人肝癌Huh7SR细胞[9],使用含10% FBS的DMEM/F12培养基,置于37 ℃、5% CO2的培养箱中培养Huh7SR细胞,取生长状态良好、对数生长期的Huh7SR细胞经胰酶消化后,制成浓度5×104/L的细胞悬液,之后接种于96孔板上,每孔100 μL,37 ℃、5% CO2培养箱中培养,待细胞贴壁后,丢弃培养液,加入不同浓度(10 μM、20 μM、30 μM、40 μM、50 μM)大黄素的培养基作为实验组,不含Emo的培养基作为对照组,只含培养基无细胞为空白组,各组干预48 h。(2)CCK8检测大黄素对人肝癌索拉菲尼耐药细胞活性的影响:实验组、对照组和空白组培养基上每孔加入CCK8溶液10 μL,在37 ℃下继续培养1.5 h,采用酶标仪(波长450 nm)检测各孔的吸光度(A)值,计算细胞存活率,细胞存活率=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。(3)分组:根据处理因素的不同进行分组,对照(Con)组人肝癌Huh7SR细胞不作处理,索拉菲尼(Sora)组加入2 μM索拉菲尼,大黄素(Emo)组加入25 μM大黄素、联合(Com)组加入2 μM索拉菲尼和25 μM大黄素,经干预处理48 h后,用预冷的PBS清洗三次。(4)流式细胞术检测大黄素对Huh7SR凋亡的影响:将经胰酶消化、离心后收集的Huh7SR细胞重悬于500 μL结合缓冲液中,之后加入5 μL Annexin V-FITC溶液轻轻混匀,再加入10 μL 碘化丙啶(PI)染色混匀,室温避光下继续染色30 min,1 h内完成检测,重复3次取平均值。(5)蛋白免疫印迹法(Western blot)检测相关蛋白:Con组、Sora组、Emo组和Com组均加入细胞蛋白裂解液(RIPA裂解液:PMSF=100∶1),置于冰山裂解30 min,提取各组细胞总蛋白,在4 ℃环境中、以12,000 r/min离心15 min,留取上清液;使用BCA蛋白定量试剂盒测定蛋白浓度;沸水煮沸10 min使蛋白变性后储存备用;各组取约30 μg蛋白置于10%SDSPAGE电泳分离,湿转法转至NC膜上,加入5%脱脂牛奶在室温下封闭1 h;各组分别加入相应的一抗4 ℃孵育过夜,PBST漂洗3次,辣根过氧物酶标记的二抗在室温下孵育1.5 h,PBST再次漂洗3次后加入ECL化学发光液显影,化学发光仪器采集图片,Image J软件分析灰度值并计算目标蛋白的相对表达量。
1.6 统计学方法 采用SPSS 17.0统计软件。计量资料以(±s)表示,两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度大黄素对人肝癌Huh7SR细胞增殖活力的影响 CCK-8实验结果显示,随着大黄素浓度的增加,人肝癌Huh7SR细胞的增殖活力逐渐下降,呈现浓度梯度关系。见图1。
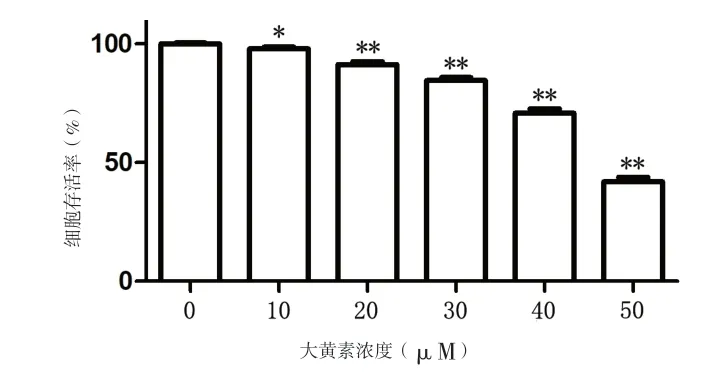
图1 大黄素干预后人肝癌Huh7SR细胞的生存率变化
2.2 大黄素对肝癌Huh7SR细胞凋亡的影响 流式细胞术检测结果显示,Com组凋亡率高于Con组、Sora组和Emo组,提示大黄素能够促进Sora对肝癌Huh7SR细胞发生凋亡。见图2。

图2 四组肝癌Huh7SR细胞的凋亡率比较
2.3 大黄素对人肝癌Huh7SR细胞凋亡相关蛋白表达的影响 Western blot实验结果显示,Com组的促凋亡相关蛋白Bax、Caspase3表达显着高于Con组、Sora组和Emo组,抑凋亡相关蛋白Bcl-2表达显着低于Con组、Sora组和Emo组,差异均有统计学意义(P<0.01)。见图3、表1。

图3 四组人肝癌Huh7SR细胞凋亡相关蛋白表达变化
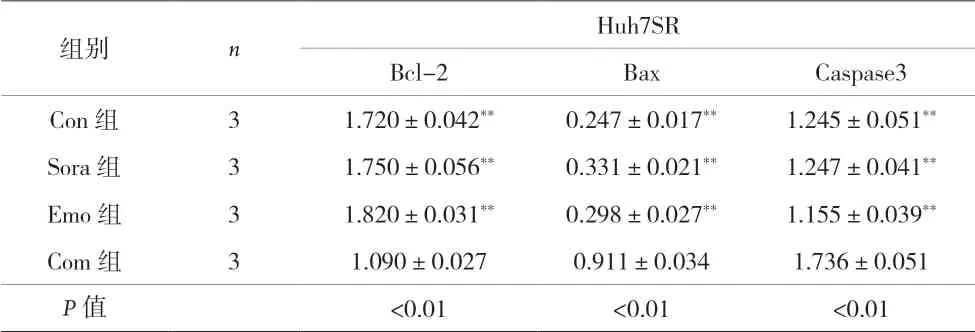
表1 四组人肝癌Huh7SR细胞凋亡相关蛋白相对表达量的比较
2.4 大黄素对人肝癌Huh7SR细胞PI3k/Akt信号通路相关蛋白表达的影响 Western blot实验结果显示,Com组的p-Akt蛋白表达显着低于Con组、Sora组和Emo组,差异有统计学意义(P<0.01);Akt蛋白表达四组比较,差异无统计学意义(P>0.05)。见图4、表2。
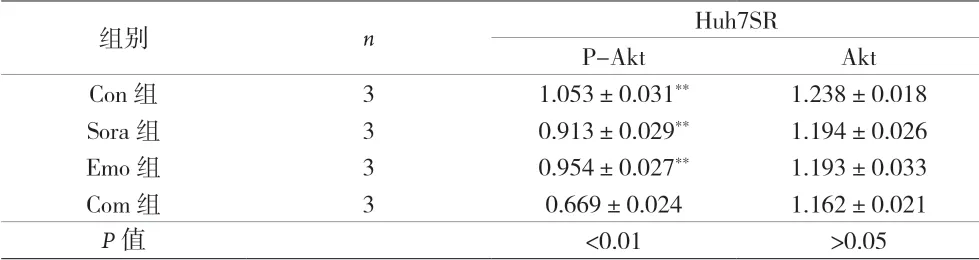
表2 四组人肝癌Huh7SR细胞PI3k/Akt信号通路蛋白相对表达量的比较

图4 四组人肝癌Huh7SR细胞PI3k/Akt信号蛋白的表达变化
3 讨论
大黄素具有抗癌、抗炎、抗病毒、抗菌、抗过敏、抗骨质疏松、抗糖尿病、免疫抑制、神经保护和护肝等药理作用[10],与多种化疗药物联合应用能够诱导肿瘤细胞凋亡,抑制肿瘤细胞生长[11-12]。目前,关于大黄素联合小剂量索拉菲尼对肝癌索拉菲尼耐药细胞的增殖抑制和凋亡诱导的研究甚少,而分子水平的调控机制尚不明确。
PI3k/Akt信号通路是细胞内重要信号转导通路之一,通过调控细胞的增殖、凋亡、耐药,参与多种肿瘤的发生发展过程。本课题组前期研究发现,肝癌索拉菲尼耐药与PI3k/Akt信号通路激活密切相关,LY294002呈时间和浓度依赖性,通过抑制PI3k/Akt信号通路可以抑制人肝癌索拉菲尼耐药细胞的增殖[9]。由于PI3k/Akt信号通路参与大黄素联合低浓度索拉菲尼诱导人肝癌Huh7SR细胞凋亡的机制研究甚少,本研究将人肝癌Huh7SR细胞根据处理药物的不同分为Con组、Emo组、Sora组和Com组,探讨四组PI3k/Akt信号通路相关蛋白和凋亡相关蛋白表达差异。Western blot结果显示,Com组的p-Akt蛋白表达水平显着下降,促凋亡蛋白Caspase3、Bax显着升高,而抗凋亡蛋白Bcl-2的表达水平显着下降。石雪萍等[13]研究提出,PI3k/Akt 信号通路通过使Akt激活为p-Akt,调节其下游的凋亡相关蛋白Caspase3、Bax 和Bcl-2等,调控细胞增殖以及凋亡。本课题组研究指出,大黄素联合低浓度索拉菲尼可能通过抑制PI3k/Akt信号通路进而诱导肝癌索拉菲尼细胞的凋亡。
综上,大黄素联合低浓度索拉菲尼抑制肝癌索拉菲尼耐药细胞的增殖,并诱导其凋亡,其机制可能与PI3k/Akt信号通路抑制有关。因本研究未行相对应的体外实验,故尚有一定局限性。



