吴小平 方红薇* 张秋实 刘怀莉 马静
动脉粥样硬化是一种进行性慢性炎症性疾病,脂质、免疫细胞、血管平滑肌细胞和细胞外基质等成分在内皮下逐渐积聚形成粥样硬化性病变[1]。心血管事件的发生风险与斑块组成和稳定性密切相关,研究显示炎症反应是斑块稳定的决定性因素[2]。CD36是一种在多种组织中表达的跨膜糖蛋白,文献报道其与血管生成、炎症反应、脂质代谢、血小板活化等相关,可溶性CD36(sCD36)以配体结合复合物的形式参与循环[3-4]。鉴于CD36在炎症、脂质代谢和血小板功能等方面的作用,本文探讨其对动脉粥样硬化斑块稳定性的影响。
1 资料与方法
1.1 临床资料 选择2018年1月至2021年1月本院接受治疗的冠状动脉粥样硬化性心脏病患者127例。纳入标准:所有患者均接受血管内超声检查及经皮冠状动脉介入治疗。排除标准:①既往接受冠状动脉外科手术;②心力衰竭;③存在治疗或检查的禁忌证。参照西雅图心绞痛量表(seattle angina questionnaire,SAQ)中过去4周内患者胸痛、胸部紧榨感和心绞痛的平均发作次数[5],将患者分为3组,A组42例,发作<1次/周;B组44例,发作1~3次/周;C组41例,发作>1次/d。
1.2 方法 (1)血浆sSD36水平检测:患者空腹采集静脉血,室温下以3,000 r/min,离心15 min获得血浆样本。通过酶联免疫吸附测定(ELISA)并依据厂家使用说明书(Aviscera Bioscience,Santa Clara)对血浆样本中sCD36浓度进行检测,检测采用人sCD36 ELISA试剂盒(SK00196-06),其检查范围为312.5~20,000 pg/mL。(2)动脉粥样硬化斑块检查:整合背向散射的血管内超声(integrated backscatter-IVUS,IB-IVUS)能够更准确分析冠状动脉粥样硬化斑块的组织特征,检查采用IVUS成像系统(VISIWAVE,Terumo)和40 MHz、5 Fr IVUS成像导管(ViewIT™,Terumo)进行。IB-IVUS影像使用电动回拉系统以0.5 mm/s的速度获得,狭窄位置的责任斑块范围内以轴向1 mm的间距进行分析。斑块体积计算为每个横截面上的斑块面积及介质的总和。IBIVUS分析通过测量来自组织的背向散射信号的IB分数将组织分为四个成分:脂质(蓝色)、纤维(绿色)、致密纤维(黄色)和钙化(红色)。自每个横截面上按照同样的方式计算脂质、纤维、致密纤维和钙化组织的体积,然后通过与整体斑块的体积相比获得相应成分的百分比。常规IVUS分析是根据美国心脏病学会临床专家共识文件关于血管内超声研究的采集、测量和报告标准进行的[6]。文献中报道脂质>65%的冠状动脉斑块与ACS相关,因此研究中将富含脂质的斑块定义为脂质体积>65%,脂质体积越高,表示斑块越不稳定[7]。
1.3 统计学方法 采用SPSS 19.0统计软件。计量资料以(±s)表示,组间比较采用Kruskal-Wallis H检验,计数资料以n(%)表示,组间比较采用卡方检验。线性回归分析血浆sCD36水平与IVUS参数间的关联,采用单变量和多变量逻辑回归分析确定富含脂质斑块的独立预测因素,P<0.05表示差异具有统计学意义。
2 结果
2.1 3组患者基本资料比较 见表1。
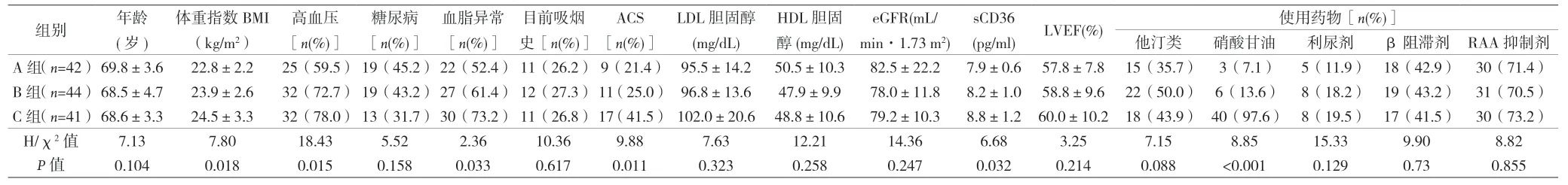
表1 3组患者基本资料比较
2.2 动脉粥样硬化斑块特征比较 总斑块体积组间基本一致,C组总脂质体积增高,而纤维体积和致密纤维体积低于其他两组(P<0.05)。线性回归结果显示,血浆sCD36水平与脂质体积显着相关(r=0.352,P<0.001),而与纤维体积呈负相关(r=-0.344,P<0.001)。见表2。
表2 IB-IVUS下动脉粥样硬化斑块特征比较(±s)
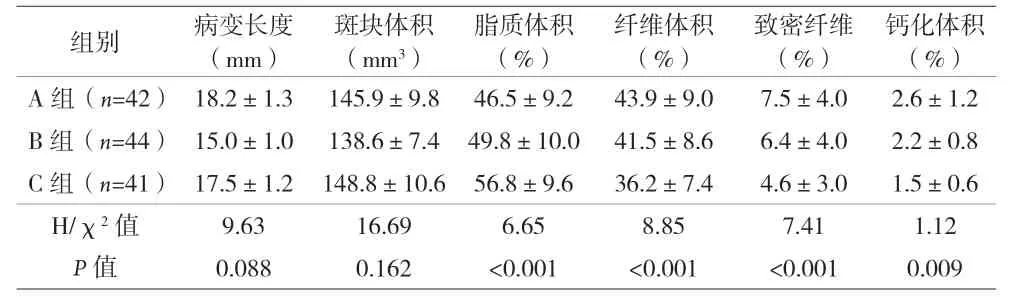
表2 IB-IVUS下动脉粥样硬化斑块特征比较(±s)
组别 病变长度(mm)斑块体积(mm3)脂质体积(%)纤维体积(%)致密纤维(%)钙化体积(%)A组(n=42)18.2±1.3 145.9±9.8 46.5±9.2 43.9±9.0 7.5±4.0 2.6±1.2 B组(n=44)15.0±1.0 138.6±7.4 49.8±10.0 41.5±8.6 6.4±4.0 2.2±0.8 C组(n=41)17.5±1.2 148.8±10.6 56.8±9.6 36.2±7.4 4.6±3.0 1.5±0.6 H/χ2值 9.63 16.69 6.65 8.85 7.41 1.12 P值 0.088 0.162 <0.001 <0.001 <0.001 0.009
2.3 富含脂质斑块的独立预测因素分析 富含脂质斑块的预测因素分析中单变量分析显示高血压、eGFR和sCD36水平与富含脂质斑块形成显着相关(P<0.05)。多变量分析显示,sCD36水平与富含脂质斑块存在显着相关(P<0.001)。见表3。
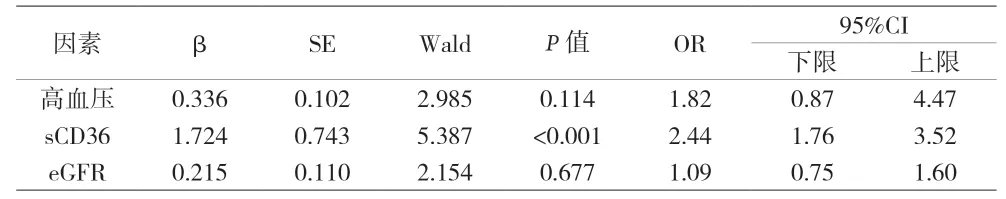
表3 富含脂质斑块多因素回归分析
3 讨论
CD36被认为通过结合和修饰低密度脂蛋白而在动脉粥样硬化的发生和发展中发挥重要作用,促进富含脂质的巨噬细胞逐渐成为泡沫细胞。以往研究中已经证实CD36表达升高与动脉粥样硬化病情进展同时存在,尤其见于泡沫细胞和较大的巨噬细胞[8]。有研究指出CD36是氧化低密度脂蛋白(LDL)颗粒的主要巨噬细胞清道夫受体,通过结合和内在修饰低密度脂蛋白而在动脉粥样硬化的发生和发展中起重要作用,即促进富含脂质的巨噬细胞形成泡沫细胞[9]。目前研究已表明sCD36以配体结合复合物的形式参与循环,或存在于细胞脱落的微颗粒中,或各种刺激触发后的脂肪细胞内。血浆sCD36浓度与胰岛素抵抗呈正相关,其水平可能提示巨噬细胞激活和动脉粥样硬化相关的炎症反应[10]。
本资料结果显示,与临床症状较轻的患者相比,症状较为严重患者的血浆sCD36表达水平显着升高,且其与斑块中脂质含量升高呈正相关,而与纤维体积呈负相关,从而间接证实其与冠状动脉粥样硬化斑块不稳定间的密切关联。有研究通过免疫染色技术显示在症状明显的患者中CD36表达明显增强,主要见于动脉粥样硬化斑块脂肪核心位置负载脂质的巨噬细胞内,进一步支持CD36与动脉粥样硬化密切关联的结论,且症状严重组患者的血浆sCD36水平显着高于其他2组患者[11]。目前以可溶形式释放CD36的机制尚不清楚,但有学者认为血浆sCD36水平变化可作为疾病进展相关的标志物,如炎症反应、脂蛋白水平变化等[12]。
泡沫细胞凋亡与斑块不稳定和血栓形成及急性缺血事件相关,有研究指出载脂巨噬细胞的凋亡可能是CD36释放增加的途径之一[13]。近期出现症状患者的血浆sCD36水平升高可能亦与此相关,急性症状具有时间依赖性,至少部分反映在粥状硬化斑块不稳定期间CD36的释放加剧。CD36不仅在单核细胞和巨噬细胞上表达,且还见于内皮细胞核血小板上[14]。有研究指出与血小板相关的CD36可能是氧化应激反应的感应指标和血小板活化的调节剂,缺血诱导的活化血小板可能是导致近期出现临床症状患者血浆内sCD36水平升高的原因之一[15]。通过与血小板反应蛋白-1的相互作用,CD36可能与基质金属蛋白酶-9的释放增加相关,后者亦是斑块不稳定的标志物之一,进一步支持CD36与不稳定斑块间的关联。
本资料中单变量及多变量分析显示,sCD36水平与富含脂质斑块存在显着相关,而与常见的糖尿病、血脂异常、吸烟史及他汀类药物治疗等因素无统计学意义。一方面可能是由于研究纳入的样本量较小,其次未对具体的基础水平各变量的影响进行展开研究;另一方面文中采用IVUS对斑块进行检测,且依据文献中报道定义脂质成分越高的斑块越不稳定,光学相干断层成像(OCT)技术可更详细识别斑块征,因此需要多中心大样本研究对CD36表达水平与粥样硬化斑块稳定性的关联进一步加以证实。
综上所述,血浆sCD36在临床症状严重的患者中表达升高,并与斑块脂质体积显着相关,可作为冠状动脉粥样硬化斑块不稳定的标志物。



