李 琛 罗定存
甲状腺癌是内分泌系统最常见的恶性肿瘤,也是近年发病率上升最快的恶性肿瘤,其中又以甲状腺乳头状癌为主,患者预后较好,10年生存率超过90%,但早期较易发生淋巴转移[1~3]。通常认为甲状腺癌的转移模式为原发灶-Ⅵ区淋巴结-颈侧淋巴结-远处转移[4,5]。但目前国内对于甲状腺乳头状癌临床颈部淋巴清扫的适应证、时机和范围尚没有统一标准。本研究旨在通过观察分析甲状腺乳头状癌淋巴结转移的规律,探讨患者性别、年龄、肿瘤大小和血清TSH与甲状腺乳头状癌颈部淋巴结转移的关系。
资料与方法
1.一般资料:笔者所在科室2010年1月~2011年1月经初治甲状腺乳头状癌患者166例,其中男性32例,女性134例;年龄8~76岁,中位年龄46岁;单侧甲状腺癌140例,双侧甲状腺癌26例。166例患者中微小癌(直径≤1cm)135例,癌灶最大直径范围0.1~5.0cm,平均0.79cm。
2.手术方式及清扫范围:以术中病理回报为准,单侧甲状腺癌患者行单侧腺叶加峡部切除并行同侧中央区淋巴结清扫,双侧甲状腺癌患者行甲状腺全切加中央区淋巴结清扫,如术前颈部B超或增强CT提示颈侧区淋巴结转移可疑,则术前穿刺或术中活检确诊后行该侧改良颈清(Ⅱ~Ⅴ区)。
3.统计学方法:数据用SPSS 17.0软件包进行统计分析。采用χ2检验比较影响颈部淋巴结转移率的单因素差异,采用t检验来比较有无颈部淋巴结转移患者的术前血清TSH水平及癌灶最大直径,以P<0.05为差异有统计学意义,采用Logistic模型进行多因素分析。采用ROC曲线获得癌灶最大直径与颈部淋巴结转移相关的最佳临界点。
结 果
1.颈淋巴结转移情况:166例患者中仅行中央区淋巴结清扫的共114例,淋巴结转移36例;改良颈清52例,淋巴结转移41例,其中3例仅有中央区淋巴结转移。共检出淋巴结1821枚(0~103枚),平均10.97枚/例;转移淋巴结共284枚(1~42枚),平均3.69 枚/例。
2.甲状腺乳头状癌颈淋巴结转移的影响因素:本组166例甲状腺乳头状癌患者中,甲状腺乳头状癌淋巴结转移率与性别无关,与单侧或双侧甲状腺癌无关,见表1;而与患者年龄和肿瘤大小密切相关。年龄<45岁患者颈淋巴结转移概率57.89%,年龄≥45岁患者颈淋巴结转移概率36.67%,二者差异有统计学意义(P=0.008)。由表2可见,甲状腺乳头状癌淋巴结转移率与癌灶直径呈正相关,甲状腺乳头状微小癌的淋巴结转移率为40.44%,而癌灶直径>1cm甲状腺乳头状癌淋巴结转移率为73.33%,二者统计学有显着性差异(P=0.001)。表2显示,甲状腺乳头状癌淋巴结转移率与血清TSH水平的高低无明显相关性。通过图1的ROC曲线分析提示癌灶直径和淋巴结转移相关的临界点为0.55cm,敏感性和特异性分别为0.78和0.60,曲线下面积0.741(95%CI:0.667~0.815),进一步分析显示肿瘤直径>0.5cm患者的淋巴结转移率为63.54%,而肿瘤直径 <0.5cm者仅为22.86%,两者有统计学差异(P<0.001)。由表3可见,多因素分析显示年龄<45岁、癌灶直径>0.5cm是颈淋巴转移的独立危险因素。甲状腺乳头状癌淋巴结转移范围与肿瘤最大直径的关系,中央区、外侧区淋巴结转移平均癌灶直径分别为0.65、1.60cm,肿瘤的直径与淋巴结转移的区域呈正相关(P <0.01)。
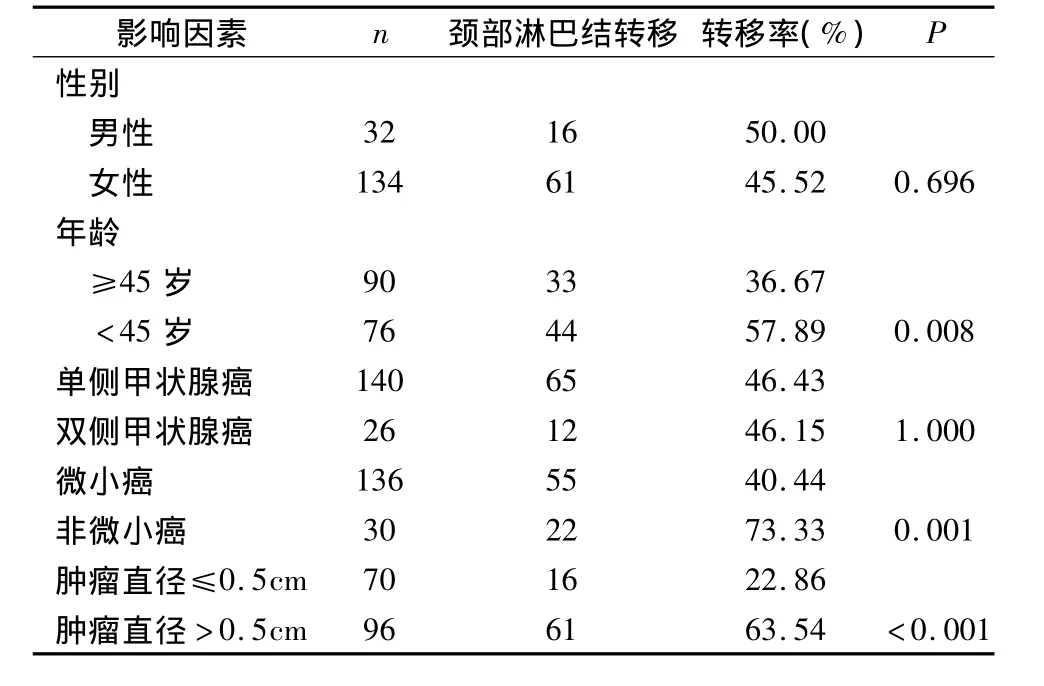
表1 甲状腺乳头状癌淋巴结转移相关因素的关系

表2 甲状腺乳头状癌淋巴结转移与血清TSH水平及癌灶最大直径的关系
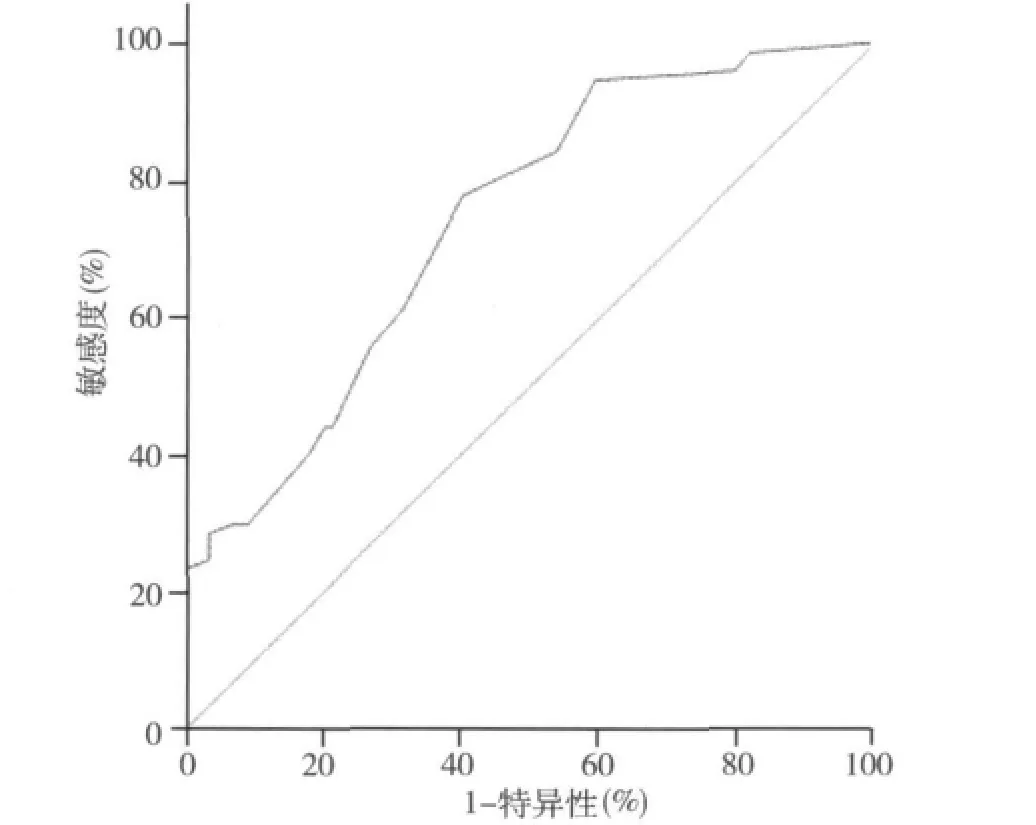
图1 甲状腺乳头状癌肿瘤最大直径判断颈部淋巴结转移的ROC曲线
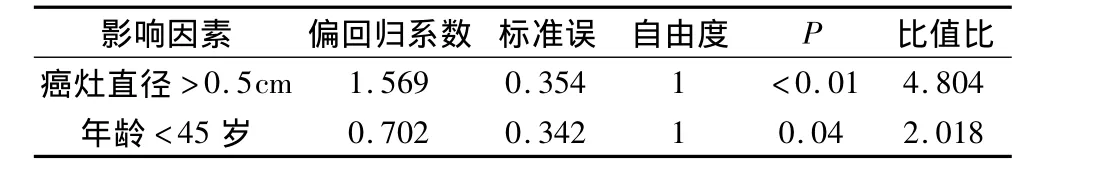
表3 甲状腺乳头状癌淋巴转移Logistic多因素回归分析
讨 论
甲状腺乳头状癌占甲状腺恶性肿瘤的90%以上,虽预后较好,但在早期容易发生区域淋巴结转移[6]。Noguchi等[7]报道在甲状腺乳头状癌中体检发现淋巴结肿大只占患者的30%,而术后病理证实的淋巴转移率则高达80%。国外部分学者[8,9]报道甲状腺乳头状癌的区域淋巴转移率为60.5%~66.0%。本组病例转移率为46.3%(77/166),本研究淋巴结转移率低可能与患者病期较早有关,随着当代B超,CT设备的进步,患者得以尽早发现甲状腺病变。
1.甲状腺乳头状癌颈部淋巴结的转移率与年龄有关:甲状腺乳头状癌虽然好发于女性,本组男女性别比例约为1∶4,但是甲状腺乳头状癌颈部淋巴结的转移率与性别无关(P=0.696)。然而,甲状腺乳头状癌颈部淋巴结的转移率与年龄密切相关,患者越年轻颈部淋巴结转移的可能越大,从表1可见,年龄<45岁的年轻患者与≥45岁的年长患者相比,二者有显着性差异(P=0.008)。Koo等[10]分析111例甲状腺乳头状癌,也显示患者越年轻颈部淋巴结转移越多,年轻人颈部淋巴结转移多见,其原因尚不清楚,可能与年轻患者新陈代谢较快有关,所以我们对年轻甲状腺乳头状癌患者要重视颈部淋巴结的转移情况。
2.甲状腺乳头状癌颈部淋巴结的转移率及转移范围与肿瘤直径有关:Koo等[10]等认为肿瘤直径>1cm是甲状腺乳头状癌淋巴转移独立危险因素,毋庸置疑,肿瘤负荷大容易发生淋巴结转移;但是肿瘤大小与淋巴结转移率的量化关系尚无报道。本组研究肿瘤直径>1cm者淋巴结转移率为73.33%,而肿瘤直径≤1cm者(即微小癌)淋巴结转移率为40.44%。而通过ROC曲线分析,我们发现癌灶直径和淋巴结转移相关的临界点则为0.55cm,敏感性和特异性分别为0.78和0.60,曲线下面积0.741(95%CI:0.667~0.815)。我们进一步把肿瘤直径以5mm为界分为两组,发现肿瘤直径≤0.5cm者淋巴结转移率仅为22.86%,肿瘤直径>0.5cm者为63.54%,两者有统计学差异(P<0.001)。因此,对于双侧甲状腺癌,如果一侧肿瘤直径≤0.5cm者,在保护甲状旁腺没有把握时,我们认为同测中央区预防性清扫可以不做。当然,如果双侧甲状旁腺保护满意,我们还是行中央区预防性清扫。甲状腺乳头状癌癌灶的直径与淋巴结转移的区域呈正相关,Lim等[11]研究了62例甲状腺乳头状癌患者的颈清扫标本后认为肿瘤越大者,其颈侧区淋巴结转移的可能越大(OR=1.449),其中Ⅲ区淋巴结转移的概率最大(68%),其次为Ⅱ区(21%)和Ⅳ区(59%)。在本组77例颈淋巴结转移患者中,43例仅有中央区转移,其平均直径为0.65cm,而存在颈侧区淋巴结转移的34例患者的肿瘤平均直径为1.60cm,两者有统计学差异(P<0.001)。说明原发灶越大,颈侧区淋巴结转移的可能性也越大,有文献报道,CT、B超诊断甲状腺癌颈淋巴结转移的准确率为60%~81%,所以在判断颈侧区淋巴结转移情况时,要结合原发病灶的大小综合考虑,制定合理的手术方式[12,13]。
3.甲状腺乳头状癌颈部淋巴结的转移率与单侧或双侧甲状腺癌无关:本组166例患者中甲状腺单侧癌140例,甲状腺双侧癌26例,其颈部淋巴结转移率分别为46.43%、46.15%,二者无统计学差异(P=1),见表1。这说明甲状腺双侧癌各侧颈部淋巴结的转移率跟同侧肿瘤相关,依据左右各侧肿瘤状况处理同侧颈部淋巴结。因此,处理甲状腺双侧癌的颈部淋巴结转移时,既要对待甲状腺单侧癌一样认真对待左右各侧,同时要重视双侧甲状旁腺和喉返神经的保护。
4.甲状腺乳头状癌颈部淋巴结的转移率与血清TSH水平无关:目前有学者认为TSH在甲状腺癌发生发展的过程中起着重要作用,Boelaert等研究显示,在细胞学检查不能确定甲状腺结节性质的患者中,血清TSH浓度较低者结节为恶性的可能性较小。但是,血清TSH水平与甲状腺乳头状癌颈部淋巴结的转移率有无关系尚无报道。本组77例甲状腺乳头状癌伴颈部淋巴结转移患者的平均血清TSH 2.28mU/L,89例甲状腺乳头状癌无颈部淋巴结转移患者平均血清 TSH 2.64mU/L,二者无统计学差异(P=0.162)。说明血清TSH水平与甲状腺乳头状癌颈部淋巴结转移并无明显相关性。
1 向俊,吴毅.甲状腺癌临床诊治新特点(附572例临床分析)[J].中国实用外科杂志,2008,28(5):365-367
2 郑泽霖,孙辉,盖宝东.甲状腺疾病外科治疗的热点和难点[J].中国普外基础与临床杂志,2008,15(5):307-310
3 Mazzaferri EL,Massol N.Management of papillary and follicular(differentiated)thyroid cancer:new paradigms using recombinant human thyrotorpin[J].Endocr Relat Cancer,2002,9(4):227-247
4 Gardner RE,Tuttle RM,Bunnan KD,et al.Prognostic importance of vascular invasion in papillary thyroid carcinoma[J].Arch Otolaryngol Head Neck Surg,2000,126(3):309-312
5 Sebastian SO,Gonzalez JM,Paricio PP,et al.Papillary thyroid carcinoma:prognostic index for survival including the histological variety[J].Arch Surg,2000,135(3):272-277
6 任国胜,苏新良.分化型甲状腺癌颈淋巴结清扫术式的选择[J].中国普外基础与临床杂志,2010,17(8):765-767
7 Noguchi M,Kumaki T,Taniya T,et al.Bilateral cervical lymph node metastases in well-differentiated thyroid cancer[J].Arch Surg,1990,125(6):804-806
8 Simon D,Goretzki PE,Witte J,et al.Incidence of regional recurrence guiding radicality in differentiated thyroid carcinoma[J].World J Surg,1996,20(7):860-866
9 Miralie E,Visset J,Sagan C,et al.Localization of cervical node metastasis of papillary thyroid carcinoma[J] World J Surg,1999,23(9):970-974
10 Koo BS,Choi EC,Yoon YH,et al.Predictive factors for ipsilateral or contralateral central lymph node metastasis in unilateral papillary thyroid carcinoma[J].Ann Stag,2009,249(5):840-844
11 Lim YS,Lee JC,Lee YS,et al.Lateral cervical lymph node metastases from papillary thyroid carcinoma:predictive factors of nodal metastasis[J].Surgery,2011,150(1):116-121
12 Ahn JE,Lee JH,Yi JS,et al.Diagnostic accuracy of CT and ultrasonography for evaluating metastatic cervical lymph nodes in patients with thyroid cancer[J].World J Surg,2008,32(7):1552-1558
13 Kim E,Park JS,Son KR,et al.Preoperative diagnosis of cervical metastatic lymph nodes in papillary thyroid carcinoma:comparison of ultrasound,computed tomography,and combined ultrasoundwit computed tomography[J].Thyroid,2008,18(4):411-418



