华彩成 万远太
银杏叶提取物(ginkgo biloba extract,GbE)是从银杏叶中分离纯化而提取的一种药物,既往在临床中多用于治疗心、脑血管疾病及癌症等[1,2]。近些年来,此药物已在较多动物实验和临床应用中证明具有抗肝纤维化的作用[3,4]。本研究拟观察GbE对肝纤维化大鼠Ⅰ、Ⅲ型胶原及TIMP-1 mRNA、MMP-1mRNA表达的影响,并探讨其抗肝纤维化的作用机制。
材料与方法
1.实验动物:雄性Wistar大鼠30只,普通级,体重180±40g,购自华中科技大学同济医学院实验动物中心。
2.实验试剂及药物:GbE购自西安中鑫生物技术有限公司,CCl4购自北京精细化工厂,Ⅰ、Ⅲ型胶原抗体购自北京中山生物技术有限公司,二抗、DAB显色试剂盒均购自武汉博士德生物技术有限公司,反转录酶、Taq酶、dNTP均为Promega公司生产。TIMP-1及MMP-1上下游引物由上海博亚公司合成。
3.实验分组和处理:实验大鼠随机分为3组,每组各10只。模型组:40%CCl4溶液背部皮下注射,注射剂量0.3ml/100g,2次/周,共注射8周,同时予以治疗组灌胃相同剂量生理盐水处理;治疗组:造模方法同模型组,同时给予银杏叶提取物悬浊液灌胃,剂量3g/100g,1次/天,共灌胃8周;对照组,给予等量生理盐水背部皮下注射,并予以相同剂量生理盐水灌胃处理8周。
4.常规病理学检查:8周后处死全部大鼠,取部分肝脏组织在4%多聚甲醛溶液固定处理24h,石蜡包埋,连续切片,切片厚度为4μm,常规做HE染色,在光镜下行常规病理学检查,按相关标准判断肝纤维化程度分级(0~Ⅳ级)[5]。
5.免疫组织化学染色:采用免疫组织化学染色方法半定量检测各组肝脏组织Ⅰ、Ⅲ型胶原表达水平。Ⅰ、Ⅲ型胶原实验浓度为1∶100,均设有空白对照(磷酸盐缓冲液)和阴性对照(正常兔血清)。以细胞质、膜或间质等部位出现棕黄色颗粒或线状沉积为表达阳性。采用免疫组化图像分析软件在低倍镜下计算阳性面积百分比(%),每张切片随机选取5个视野,取其平均值。
6.RT-PCR方法:称取每只大鼠50~100mg重量的肝组织,Trizol提取液提取肝脏组织总RNA,测定A260/A280值。取2μg总RNA,42℃温度下反转录处理90min。PCR条件为:95℃变性 40s,52℃退火 40s,74℃延伸 60s,共 30 个循环,最后74℃彻底延伸7min。内参照GAPDH PCR方法相同。取5μl体积的PCR产物2%琼脂糖凝胶电泳。凝胶图像分析系统检测其PCR条带灰度,TIMP-1/GAPDH及MMP-1/GAPDH比值依次表示TIMP-1 mRNA和MMP-1 mRNA的相对表达水平。引物序列见下:TIMP-1(393bp),上游引物:5'-CATGGAGAGCCTCTGTGGAT-3',下游引物:5'-GTTCAGGCTTCAGCTTTTGC-3';MMP-1(649bp),上游引物:5'-TCAGTTCGTCCTCACTCCAG-3',下游引物:5'-TTGGTCCACCTGTCATCTTC-3';GAPDH(300bp),上游引物:5'-GAGGACCAGGTTGTCTCCTG-3',下游引物:5'-GGATGGAATTGTGAGGGAGA -3'。
7.统计学方法:SPSS 10.0统计软件进行数据分析,采用t检验,以P<0.05为差异有统计学意义。
结 果
1.肝脏组织常规病理学检查:各组大鼠肝组织行HE染色,普通显微镜下观察,可见模型组门管区纤维结缔组织增生明显,肝小叶分界清楚,被纤维间隔分隔,有假小叶形成;治疗组可见纤维程度较轻,肝小叶结构基本正常,细胞气球样变仍明显,无假小叶和纤维间隔组织结构形成。肝纤维化程度分级可知模型组肝纤维化程度明显高于治疗组(表1及图1)。
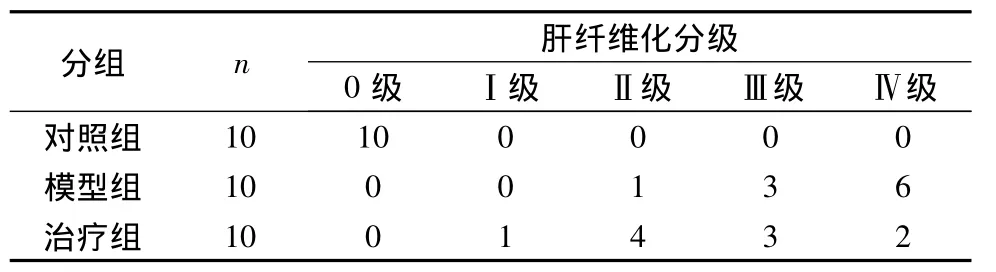
表1 各组肝纤维化程度分级
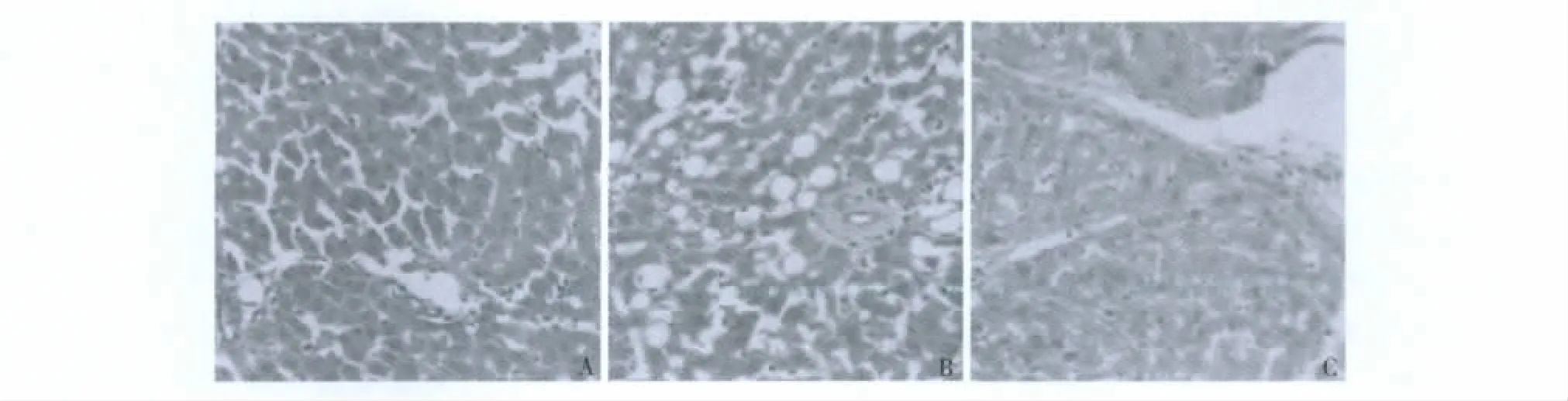
图1 各组大鼠肝组织HE染色(×200)
2.Ⅰ、Ⅲ型胶原表达情况:模型组及治疗组肝脏组织Ⅰ、Ⅲ型胶原表达水平明显高于对照组,差异有统计学意义(P<0.01);经GbE灌胃处理后,治疗组肝脏组织Ⅰ、Ⅲ型胶原表达水平明显低于模型组(P<0.01,表2 及图2)。
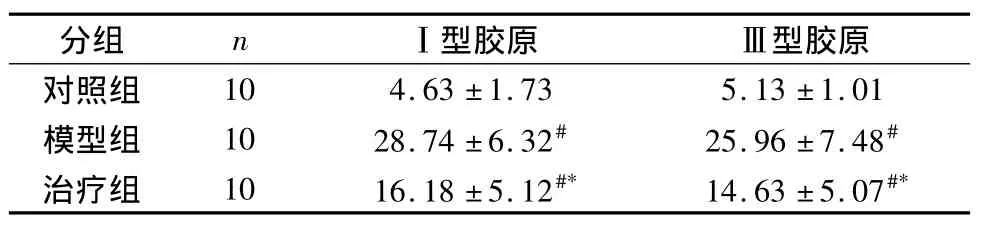
表2 各组Ⅰ、Ⅲ型胶原表达情况(%)
3.TIMP-1 mRNA和MMP-1mRNA表达情况:模型组及治疗组肝脏组织TIMP-1 mRNA、MMP-1 mRNA表达水平较对照组均显着增高(P<0.01),且治疗组TIMP-1 mRNA表达水平明显低于模型组(P<0.01),治疗组MMP-1 mRNA表达水平明显高于模型组(P <0.01,表3)。
讨 论
肝脏组织纤维化是慢性肝病共同的病理过程,其主要是各种致病因素导致肝脏出现慢性损伤,细胞外基质(ECM)合成量明显增多和(或)降解明显减少,从而使得ECM尤其Ⅰ、Ⅲ、Ⅳ型胶原在肝组织中过度增生和沉积最终造成的病理性结果[6]。已有大量研究结果表明某些条件下肝纤维化可发生逆转,但目前临床治疗方面仍缺乏疗效显着的抗纤维化药物[7]。

表3 各组TIMP-1 m RNA和MMP-1 m RNA表达情况
GbE主要药理成分为黄酮甙,该分子中含有一种具有还原性羟基功能的基团,可捕捉各种类型的自由基,其作用机制是对上述自由基发挥氢原子供体的药理性作用,进而终止细胞内自由基的连锁反应链,避免引起氧自由基和脂质过氧化等反应的加剧,最终减轻氧自由基和脂质过氧化所导致的损害严重程度[8~10]。此外还有相关研究发现,GbE具有保护肝窦状内皮细胞的药理作用,可明显改善因慢性肝脏组织受到损伤后所产生的微循环紊乱状态[11]。因此笔者推测GbE对CCl4所致肝纤维化大鼠具有一定的保护作用。
本研究采用CCl4制作肝纤维化大鼠模型,同时予以GbE进行干预,结果显示,造模8周后模型组大鼠肝脏组织观察可见有大量胶原纤维沉积于汇管区,有假小叶出现,证实肝纤维化模型成功建立。治疗组予以GbE处理后,可见肝小叶结构基本正常,虽然仍存在细胞气球样变,但未发现明显假小叶和纤维间隔组织结构形成。肝纤维化程度分级结果也显示,治疗组肝脏纤维化程度较模型组明显减轻。免疫组化染色结果显示,对照组和治疗组Ⅰ、Ⅲ型胶原仅在汇管区有所表达,而模型组中,除汇管区外Ⅰ、Ⅲ型胶原主要弥漫性分布在肝纤维隔内,经GbE灌胃处理后,治疗组肝脏组织Ⅰ、Ⅲ型胶原表达水平明显低于模型组(P<0.01)。上述结果证实GbE对CCl4所致肝纤维化具有明显的防治作用,可明显减轻Ⅰ、Ⅲ型胶原在肝脏组织中的大量沉积。
国内外研究发现肝纤维化的实质是ECM合成与代谢失衡,ECM合成过多或降解减少而在肝内过度沉积引起的,主要是Ⅰ、Ⅲ型胶原的沉积。在肝内参与ECM降解的主要是基质金属蛋白酶(MMPs),其中间质胶原酶(MMP-1)在降解肝纤维化肝脏ECM的主要成分-Ⅰ、Ⅲ型胶原的降解过程中起重要作用,而对MMP-1的活性起重要作用是基质金属蛋白酶组织抑制因子 -1(TIMP-1),TIPM-1通过MMPS(主要是MMP-1)的活性的抑制促进肝纤维化的形成和发展[12]。正常生理状态下,MMPs与TIMPs处于一种动态平衡状态,共同调节肝脏组织中ECM的生成和降解过程,并维持ECM的稳定状态。而在病理状态下,MMPs和TIMPs之间失去平衡,从而导致Ⅰ、Ⅲ型胶原在肝脏组织内出现过度沉积现象,最终引起肝纤维化[13]。
本研究结果显示模型组及治疗组肝脏组织TIMP-1 mRNA、MMP-1 mRNA表达水平较对照组均显着增高(P<0.01),且治疗组TIMP-1 mRNA表达水平明显低于模型组(P<0.01),治疗组MMP-1 mRNA表达水平明显高于模型组(P<0.01)。结果提示,GbE可通过提高MMP-1表达和抑制TIMP-1表达的作用。
综上所述,抑制TIMP-1表达和增强MMP-1表达并进一步促进Ⅰ、Ⅲ型胶原的降解是GbE抗肝纤维化的作用机制之一。本研究为GbE应用于肝纤维化的临床防治提供了理论依据。
1 邵海云,盛延良,李颖,等.银杏叶提取物的药理作用及临床应用[J].中医中药,2007,34(4):43 -44
2 李海龙,李红.银杏叶提取物的神经保护作用机制的研究进展[J].中医药导报,2007,13(7):111 -112
3 罗燕军,于皆平,罗和生,等.银杏叶提取物对四氯化碳诱发大鼠肝纤维化的预防作用[J].中华消化杂志,2004,24(5):307-309
4 陈炎,陈亚蓓,陶荣芳,等.银杏叶对慢性乙型肝炎肝纤维化的治疗作用[J].世界感染杂志,2004,4(3):225 -227
5 中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(2):324
6 张春兰,石亚玲.肝纤维化指标与病毒含量及病理的关系[J].肝脏病学杂志,2000,16(4):15
7 贾乐陶,邓素兰,潘金水.银杏叶提取物保肝降酶作用的实验研究[J].江苏中医药,2002,23(3):39 -40
8 Okazaki I,Watanabe T,Hozawa S,et al.Molecular mechanism of the reversibility of hepatic fibrosis:with special reference to the role of matrixmetalloproteinase[J].JGastroenterology Hepatology,2000,15(supp1):26-32
9 卢忠明.银杏叶提取物药理作用的生理基础及其临床应用[J].广西中医学院学报,2001,4(1):131 -133
10 Bridi R,Crossetti FP,Steffen VM,et al.The antioxidant activity of standardized extractof ginkgo biloba(EGb 761)in rats[J].Phytother Res,2001,15(5):449 -451
11 Zhang C,Zu J,Shi H,et al.The effect of ginkgo biloba extract(EGb 761)on hepatic sinusoidal endothelial cells and hepaticmicrocirculation in CCl4rats[J].Am JChin Med,2004,32(1):21 -31
12 蕲艾提取液对免疫性肝纤维化大鼠Ⅰ、Ⅲ型胶原及基质金属蛋白酶抑制因子-1表达的影响[J].中西医结合肝病杂志,2009,19(4):227-228
13 帅峰.中药小柴胡汤对肝纤维化大鼠MMPs与TIMPsn mRNA的影响[J].安徽医药,2009,13(2):139-141



