施 通 吴 辉 刘付丽 杜永均 高元兴 岳 军 徐旭仲
姜黄素(curcumin)是姜科姜黄属植物姜黄(Curcuma longa L)的活性成分 ,它在1815年首次被Vogel和Pelletier从根茎中提取的一种酚类天然色素,但直到1870年才被Daube获得纯晶体姜黄素,大约30 年后 Ivanov 和 Gajevsky 才阐明其结构[1,2]。在传统的印第安医学中它被用以治疗各种各样的疾病,包括风湿病、躯体疾病、皮肤病、消化功能紊乱、间歇性发热、白斑病和闭经等[3,4]。最近几年,大量研究数据阐明了姜黄素非在体条件下的潜在药理学作用,包括抗微生物、抗病毒、抗真菌、抗炎和抗肿瘤等作用。
作为一种纯天然成分,姜黄素被美国食品和药物监管机构(FDA)认为是安全的[5]。但许多文献报道了姜黄素对各种细胞的毒性作用,同时姜黄素剂量依赖性诱导心肌细胞坏死最近已经被报道,并指出在非在体模型中高浓度姜黄素能导致心肌细胞损伤[6~9]。而且有文献指出高剂量姜黄素会增加细胞内储存钙的释放从而增高胞内钙浓度[10,11]。
姜黄素是否会影响大鼠心室肌细胞离子通道至今尚不清楚。本项目的研究目的就是为了阐明是否高浓度姜黄素会带来心脏毒性,同时我们测试了高浓度姜黄素对大鼠心室肌细胞瞬时外向钾电流(transient outward potassium current,Ito)和内向整流钾电流(inward rectifier potassium current,Ik1)电生理作用。
材料与方法
1.实验动物和试剂:成年清洁级SD大鼠250~300g,由温州医学院动物中心提供。Ⅰ型胶原酶(collagenaseⅠ),牛血清蛋白(bovine serum albumin,BSA),姜黄素(curcumin),二甲基亚砜(DMSO),N-2-羟乙基哌嗪 -N'-2-乙磺酸(HEPES),乙二醇-双四乙酸(EGTA),氯化镉(CdCl2),谷氨酸(L-glutamic acid),牛磺酸(taurine),CaCl2,K2ATP为Sigma公司产品。其余化学试剂为国产分析纯试剂。
2.溶液配制:分离心室肌细胞和记录离子通道电流所使用的溶液配制如下:①无钙台氏液:NaCl 137mmol/L,KCl 5.4mmol/L,MgCl21.0mmol/L,NaH2PO40.33mmol/L,HEPES 10mmol/L,Glucose 10mmol/L,用NaOH调 pH 值至7.35;②KB液:KCl 40mmol/L,KH2PO420mmol/L,MgSO43.0mmol/L,KOH 80mmol/L,谷氨酸 50mmol/L,牛磺酸 20mmol/L,HEPES 10mmol/L,Glucose 10mmol/L,EGTA 0.5mmol/L,用 KOH 调 pH 值至7.35;③Ito和 Ik1电极内液:KCl 65mmol/L,KF 80mmol/L,MgCl21.0mmol/L,K2ATP 5.0mmol/L,EGTA 10mmol/L,HEPES 10mmol/L,KOH调pH值至7.3,记录Ito和Ik1的细胞外液为台氏液;④50μmol/L姜黄素灌流液:用DMSO配制10mmol/L姜黄素溶液,然后分别用不同通道外液将其稀释至50μmol/L备用。所有液体均用双蒸水(RIOS5+,MILLIPORE美国)配制。
3.SD大鼠心室肌细胞分离:SD大鼠麻醉后取心分别以无钙台式液和Ⅰ型胶原酶行Langendoff灌流后,获得酶解分离后的心室肌细胞,并置入含BSA的KB液稳定1h后备用。
4.全细胞膜片钳记录:在倒置显微镜(TE2000-U,Nikon,日本)下选择边缘清楚,表面光滑,横纹清晰,无收缩的细胞。采用Hamill等首创的全细胞膜片钳记录方法,在电压钳制模式下记录各种通道电流。
5.通道电流的刺激参数设置:记录Ito时细胞外液中加入CdCl20.3mmol/L以阻断钙电流,加入CoCl21mmol/L以阻断钙激活氯电流(Ito2)。记录Ito的I-V曲线时Vh为-90mV,先给予1个25ms~-40mV的去极化刺激以灭活 INa。Vs从-40mV开始,以10mV阶跃刺激至+50mV,时程400ms,频率0.2Hz。记录Ik1细胞外液中加入CdCl20.3mmol/L以阻断钙电流。记录Ik1的I-V曲线时Vh为-40mV,Vs从-120mV开始,以10mV 阶跃刺激至 +50mV,时程400ms,频率0.2Hz。
6.姜黄素灌流和数据采集:每个通道电流记录时细胞灌流药物前采集对照电流曲线,然后用微灌流系统(DADVC-8PP,ALA SCIENTIFIC,美国),灌流50μmol/L 姜黄素 5min,记录灌药后的电流曲线,然后用空白细胞外液冲洗5min再次记录电流曲线。原始电流数据采用pulsefit进行分析和测量,Originpro8.5 绘图。
7.统计学方法:实验数据以均数±标准差(x±s)表示,给药前后采用配对t检验,P<0.05为差异有统计学意义。
结 果
1.姜黄素对大鼠心室肌细胞钾离子通道的抑制率:(1)Ito:以测试电压50mV,对5个大鼠心室肌细胞的Ito峰值电流密度作观察指标,得出50μmol/L姜黄素对Ito的抑制率为(84±11)%(表1)。图1为50 μmol/L姜黄素对Ito影响的原始电流图。(2)Ik1:以测试电压-80mV,对5个大鼠心室肌细胞的 Ik1峰值电流密度作观察指标,得出50μmol/L姜黄素对Ik1的抑制率为(59±8)%(表1)。图2为50μmol/L姜黄素对Ik1影响的原始电流图。

表1 姜黄素(50μmol/L)对大鼠心室肌细胞Ito和Ik1的影响(x±s)

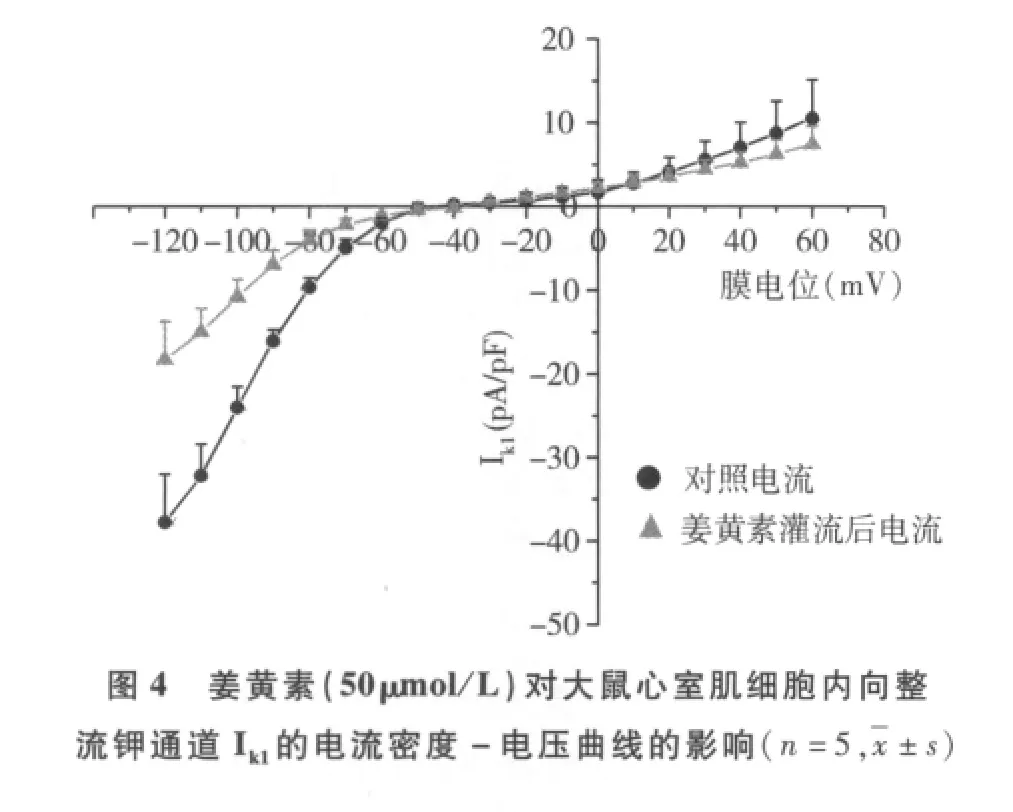
2.姜黄素对大鼠心室肌细胞Ito和Ik1电流密度-电压曲线的影响:(1)50μmol/L姜黄素对Ito电流密度-电压曲线的影响如图3所示,Ito的激活电压在-10mV,电流随刺激电压增高而增大,并呈现出外向整流的特点。50μmol/L的姜黄素对所有指令电压条件下均引起Ito的降低,但不改变其外向整流的特点。(2)50μmol/L姜黄素对Ik1电流密度-电压曲线的影响如图4所示,Ik1在-70~-40mV的刺激电压以下呈现很强的内向整流特点,随后转为外向整流。50μmol/L的姜黄素对所有指令电压条件下均引起Ik1的降低,但不改变其整流性的两个阶段。

讨 论
在本项研究中,我们测试了姜黄素对急性酶解分离大鼠心室肌细胞离子通道功能的影响。姜黄素自从结构被确定以来,被证明有多种药理学效果和治疗作用,同时也是最近研究的热点。在药物对心肌的治疗作用和毒性反应中起主要作用的3种离子通道分别是钠、钾和钙通道。用一种相对简单的构效关系来解释就是药物通过改变一种细胞膜或胞内离子通道的活性来干预心脏功能,引起节律细胞、传导纤维和(或)收缩细胞不正常的除极和(或)复极从而导致心脏节律的破坏和心脏收缩舒张功能失常。现在普遍认为药物引起心脏的毒性作用不仅仅是指传统意义上的心血管药物,而可以是任何化学结构的药物,只要它能影响心脏功能,甚至在某一时刻能引起致命的影响。我们通过观察姜黄素对离子通道的作用来评估其对心脏电生理的影响。我们发现姜黄素和离子通道的关系对研究和探讨心脏毒性、不良反应和治疗效果都有至关重要的作用。
最近,Enyeart等报道了姜黄素是目前对牛肾上腺束状带细胞Kv1.4钾通道最强的抑制剂,同时它还抑制bTREK-1钾离子通道,并刺激肾上腺皮质细胞分泌皮质醇。他们假设姜黄素的某些生物学特性包括它的治疗作用,可能通过调节钾离子通道的抑制率来实现的。Kv1.4通道的电流相对于大鼠心室肌细胞而言就是Ito电流。它是一种心脏动作电位早期复极中瞬间激活和失活的钾电流。Ito电流量的下降会明显减慢1期复极,并抬高动作电位平台。同时Ito电流改变导致的动作电位复极改变会对L型钙电流幅度和时程有较大影响,从而相应的影响肌质网钙离子负荷、释放和细胞收缩能力。同时,我们发现姜黄素能抑制Ik1电流,而Ik1电流又是心肌细胞动作电位中稳定静息膜电位,决定兴奋起点和启动复极的主要电流。这种电流的特点是当细胞膜轻度去极化时钾离子外流,而进一步去极化时,钾离子外流反而减少甚至消失。具有明显的内向整流性质,所以被命名为内向整流钾电流,其典型的电流曲线呈“N”形。因此,调节Ik1电流对于心脏兴奋性和心脏节律相当重要,Ik1电流被抑制会导致QT间期延长,尖端扭转性室性心动过速,室性心室颤动甚至猝死。
根据本课题组另一项对大鼠心脏离体灌流的实验观察发现,低浓度姜黄素(0.1 ~10.0μmol/L)具有剂量依赖性的心脏功能增强作用,而高浓度姜黄素(10~50μmol/L)能产生剂量依赖性的心脏功能抑制和致心律失常作用。同时在本实验中发现浓度>50μmol/L的姜黄素灌流液会使心肌细胞短期内死亡,所以以50μmol/L的浓度为例探讨姜黄素对心肌细胞的毒性作用,结果表明高浓度姜黄素(50μmol/L)对心室肌细胞多通道的综合作用,可以解释离体灌流心脏的心电图产生的PR间期延长、QRS电压下降和时程延长等现象,同时也可以解释心肌功能抑制,收缩力减弱,心律失常等现象。
本实验初步研究了高浓度姜黄素对大鼠心室肌细胞离子两种钾离子通道的影响,提示高浓度姜黄素对心脏具有一定的心肌抑制和致心律失常作用。低浓度的姜黄素是否也会对心肌细胞离子通道电流产生影响还需进一步研究明确。
1 Milobedzka J,Kostanceki V,Lampe V.Structure of curcumin[J].Chem Ber,1910,10(43):2163
2 Heath DD,Khwaja F,Rock CL.Curcumin content of turmeric and curry powders[J].FASEB J,2004,2004(18):A125
3 Singh S.From exotic spice to modern drug?[J].Cell,2007,130(5):765-768
4 Aggarwal BB,Sundaram C,Malani N,et al.Curcumin:the Indian solid gold[J].Adv Exp Med Biol,2007,595(10):1 -75
5 NCID.Clinical development plan:curcumin[J].J Cell Biochem Suppl,1996,26:72 -85
6 Kuttan R,Bhanumathy P,Nirmala K,et al.Potential anticancer activity of turmeric(Curcuma longa)[J].Cancer lett,1985,29(2):197-202
7 Bhaumik S,Anjum R,Rangaraj N,et al.Curcumin mediated apoptosis in AK-5 tumor cells involves the production of reactive oxygen intermediates[J].FEBS Lett,1999,456(2):311 - 314
8 Fujisawa S,Atsumi T,Ishihara M,et al.Cytotoxicity,ROS - generation activity and radical-scavenging activity of curcumin and related compounds[J].Anticancer Res,2004,24(2B):563 - 569
9 Tanwar V,Sachdeva J,Kishore K,etal.Dose-dependentactions of curcumin in experimentally induced myocardial necrosis:a biochemical,histopathological,and electron microscopic evidence[J].Cell Biochem Funct,2010,28(1):74 -82
10 Su CC,Lin JG,Li TM,et al.Curcumin-induced apoptosis of human colon cancer colo 205 cells through the production of ROS,Ca2t and the activation of caspase - 3[J].Anticancer Res,2006,26(6B):4379-4389
11 Das R,Roy A,Dutta N,et al.Reactive oxygen species and imbalance of calcium homeostasis contributes to curcumin induced programmed cell death in Leishmania donovani[J].Apoptosis,2008,13(7):867-882



