黄林静 黎关龙 郑梦晓 马迎春 金可可 王万铁
研究表明,肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)上存在多种氯离子通道,但是其中含量最多的为容量激活性氯离子通道(volume activated chloride channels,CLC3),并且CLC3在肺动脉平滑肌细胞的增殖方面起到了非常重要的作用[1]。低氧可以引起大鼠肺动脉平滑肌细胞上JNK、ERK1/2 和p38MAPK 这3 类酶的激活[2]。而目前关于氯离子通道功能及其表达上下游信号通路研究的文献报道相对较少。本实验利用细胞培养方法观察了容量激活性氯离子通道在大鼠低氧性PASMCs 中mRNA 和蛋白表达的变化,并探讨其与p38 丝裂原活化蛋白激酶(p38 mitogen activated protein kinase,p38MAPK)信号通路的关系。
材料与方法
1.材料:SPF 级健康雄性Sprague - Dawley(SD)大鼠10只,体质量为200 ±50g,由温州医科大学实验动物中心提供实验动物许可证号:SCXK(浙)2010 -0101 号。
2.试剂及仪器:SB203580 (美国Sigma 公司);茴香霉素(Anisomycin,美国Sigma 公司);二甲基亚砜(dimethyl sulfoxide,DMSO 上海申工生物技术有限公司);胎牛血清、DMEM高糖培养基、胰酶/EDTA(美国Gibco 公司);SM -α -actin 鼠单克隆抗体、辣根过氧化物酶(HRP)标记的羊抗兔二抗(英国abcam 公司);HRP 标记β-actin(上海康城公司);CLC3 兔抗鼠多克隆抗体(美国Sigma 公司);RT - PCR 试剂盒、50bp DNA Marker(Fermentas life sciences 公司);BCA 蛋白定量试剂盒、增强化学发光试剂盒(美国Pierce 公司);RT -PCR 引物(上海生工生物工程技术服务有限公司);PVDF 膜(美国,Milipore 公司);彩色预染蛋白maker(MBI,Fermentas 公司)。低氧培养箱(Herareus,美国);显微外科用显微镜(Olympus,日本);生物倒置相差显微镜XDS-1B(重庆光学仪器设备厂);蛋白电泳转移系统(Bio -Rad 公司);稳压稳流电泳仪(DYY-3 型,北京六一仪器厂);EXL -808 酶标仪(USA);恒温二氧化碳培养箱(Thermo Forma,美国);凝胶定量软件Quantity One(Bio-Rad 公司);722N 分光光度计(上海精密科学仪器有限公司);PCR 仪(Thermo Hybaid,美国)。
3.方法:(1)PASMCs 的获取和处理:①酶消化法提取PASMCs;②PASMCs 的传代培养;③PASMCs 的冻存和复苏;④PASMCs 存活率的测定;⑤差异贴壁法纯化细胞[3]。(2)PASMCs 的鉴定:倒置相差显微镜下观察细胞形态并摄片;激光共聚焦免疫荧光染色法分别检测PI 标记的细胞核及FITC标记的平滑肌α-actin 抗体。(3)实验分组:实验所用为4 ~6 代肺动脉平滑肌细胞,实验前要将所有细胞置于无血清培养基饥饿24h,分为5 组:①常氧组(N):DMEM 5%CO2,21%O2,37℃48h;②低氧组(H):DMEM 5% CO2,2% O2,37℃,48h;③DMSO 对照组(D):0.05% DMSO,5% CO2,2% O2,37℃48h;④SB203580 干预组(SB):10μmol/L SB203580,5%CO2,1% O2,37℃48h;⑤Anisomycin 干预组(A):10μmol/L Anisomycin,5% CO2,2% O2,37℃48h。以上每组6 皿细胞。(4)PASMCs CLC3 的蛋白和mRNA 表达的检测:①蛋白免疫印迹法检测PASMCs CLC3 的蛋白含量;②RT-PCR 法检测PASMCs CLC3 的mRNA 表达[3]。
4.统计学方法:应用SPSS 17.0 统计软件分析,数据用均数±标准差(±s)形式表示,组间比较采用单因素方差分析(one-way ANOVA),方差齐性者两两比较采用LSD 法,方差不齐者进行Dunnet't 检验,以P <0.05 为差异有统计学意义。
结 果
1.原代培养大鼠PASMCs 的培养和鉴定:(1)细胞形态学生长特点:原代的肺动脉平滑肌细胞为贴壁细胞,呈典型的“峰-谷”状生长(图1)。(2)免疫细胞荧光法鉴定PASMCs:发绿色荧光呈细丝状的为肺动脉平滑肌细胞的α-肌动蛋白,红色卵圆形的为肺动脉平滑肌细胞的细胞核(图2)。(3)台盼蓝染色结果:消化传代的肺动脉平滑肌细胞存活率为96.7%,冻存后复苏的肺动脉平滑肌细胞存活率为83.3%。

图1 大鼠原代培养肺动脉平滑肌细胞(×100)
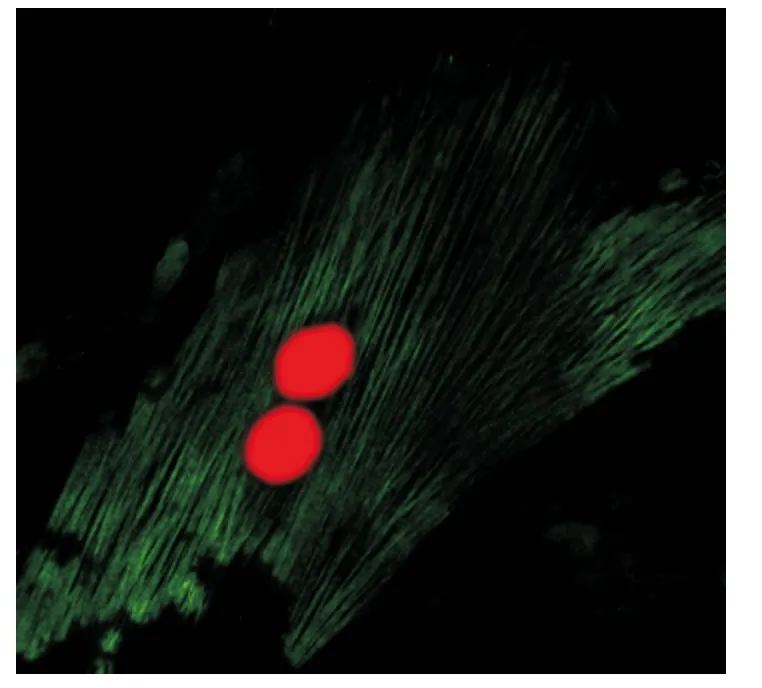
图2 大鼠肺动脉平滑肌细胞免疫荧光鉴定(×400)
2. 各组PASMCs 上CLC3 mRNA 表达的变化:(1)低氧对PASMCs 上CLC3 mRNA 表达的影响:H组CLC3 mRNA 表达量显着增加,与N 组相比,有统计学差异(0.784 ±0.011 vs 1.114 ±0.009,P <0.01)(图3、图4),即低氧能增加CLC3 mRNA 的表达。(2)低氧条件下SB203580 对PASMCs 上CLC3 mRNA表达的影响:与N 组相比,D 组、SB 组和A 组CLC3 mRNA 表达均显着上调(P <0.01 和P <0.05)。与H 组相比,D 组CLC3 mRNA 的表达无统计学差异(1.114 ±0.009 vs 1.119 ±0.003,P >0.05)。与D组相比,SB 组CLC3 mRNA 的表达显着上调(1.119±0.003 vs 1.322 ±0.027,P <0.01),A 组CLC3 mRNA 的 表 达 显 着 下 调(1. 119 ± 0. 003 vs 0. 846 ±0.047,P <0.01)(图3、图4),即 低 氧 条 件 下SB203580 能增加CLC3 mRNA 的表达。
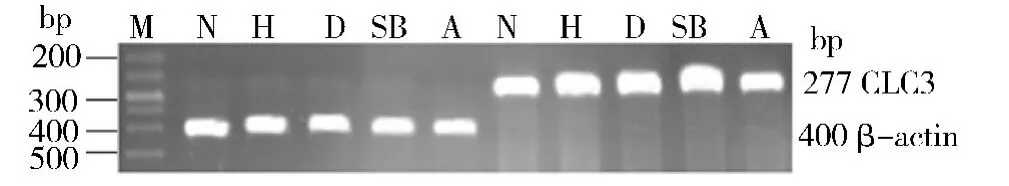
图3 各组细胞CLC3 mRNA 的表达
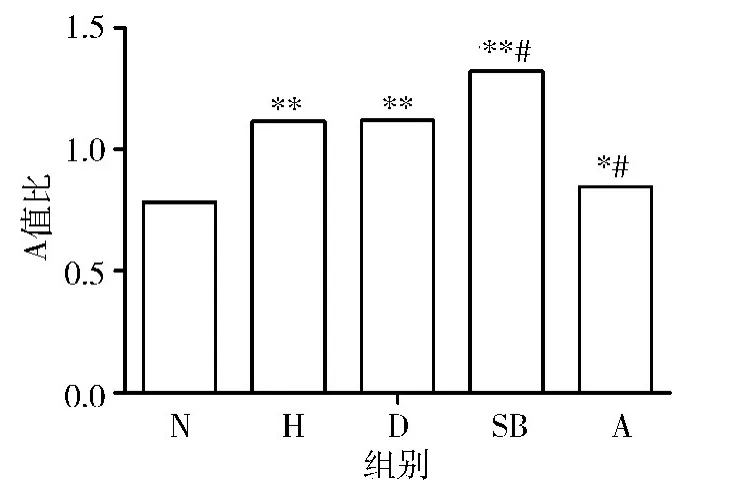
图4 各组细胞CLC3 mRNA 表达变化的比较(±s,n=6)
3.各组PASMCs 上CLC3 蛋白表达的变化:(1)低氧对PASMCs 上CLC3 蛋白表达的影响:与N 组相比,H 组CLC3 蛋白的表达均明显上调,差异有统计学意义(0.392 ±0.004 vs 0.525 ±0.029,P <0.01)(图5、图6),即低氧能增加CLC3 蛋白的表达。(2)低氧条件下SB203580 对PASMCs 上CLC3 蛋白表达的影响:与N 组相比,D 组和SB 组和A 组CLC3 蛋白表达均明显上调(P <0. 01)。与H 组相比,D 组CLC3 蛋白表达略微下调,差异无统计学意义(0.525±0.029 vs 0.522 ±0.017,P >0.05)。与D 组相比,SB 组CLC3 蛋白的表达显着上调(0.522 ±0.017 vs 0.593 ±0.030,P <0.01),A 组CLC3 蛋白的表达下调,但差异无统计学意义(0.522 ±0.017 vs 0.487 ±0. 029,P >0. 05)(图5、图6),即低氧条件下SB203580 能增加CLC3 蛋白的表达。
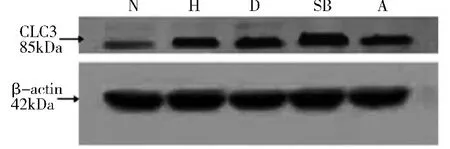
图5 各组细胞CLC3 蛋白的表达
讨 论

图6 各组细胞CLC3 蛋白表达变化的比较(±s,n=6)
氯离子是肺动脉平滑肌细胞内外分布最广泛的阴离子,细胞膜氯离子的静息通透性相对较大,血管平滑肌细胞氯离子平衡电位(约-34mV)比静息膜电位(约-55mV)高[4]。本实验室前期研究显示,加入氯离子通道阻滞剂能明显减轻肺动脉的持续收缩,故氯离子通道在肺动脉血管收缩方面起到了非常重要的作用[5]。平滑肌细胞的增殖是构成肺动脉高压及各种血管疾病的关键因素,Qian 等[6]研究证明,静态压力促进大鼠主动脉平滑肌细胞增殖,是通过上调CLC3 来实现的。Hisadome 等[7]研究发现,CLC3 阻断剂可显着抑制各类血管的生成,而且CLC3 还与各种生物体的跨膜氯离子转运及相关物质分泌密切相关。本研究发现:在低氧条件下,PASMCs 上CLC3 mRNA 和蛋白的表达量明显高于常氧条件下的表达量(P <0. 01),表明低氧可上调大鼠PASMCs 上CLC3 mRNA 和蛋白的表达,低氧性肺动脉高压的形成可能与CLC3 有关。
p38MAPK 是MAPK 家族的一员,是生物体内重要的信号系统之一。它是缺血、低氧、激素、生长因子及细胞因子等各种细胞外刺激诱导基因表达、细胞增殖分化、转化及凋亡等信息传递途径的交汇点和共同通路[8]。对于p38MAPK 现在研究比较多的是其对细胞的凋亡作用[9]。梁瑛琦等[10]研究发现,在慢性低氧状态下肺小血管壁p38MAPK 蛋白和mRNA 的表达量显着增高,可能参与了大鼠肺动脉高压形成的病理生理过程。本实验结果显示,使用p38MAPK 通路抑制剂SB203580 后,PASMCs 中CLC3 mRNA 和蛋白表达水平均上调,明显高于DMSO 对照组(P <0.01)。应用p38MAPK 通路激活剂Anisomycin 后,PASMCs 中CLC3 mRNA 表达水平显着下调,明显低于DMSO 对照组(P <0.01),蛋白表达轻微下调(P >0.05)。以上结果提示,SB203580 可上调PASMCs 上CLC3 mRNA 和蛋白的表达,Anisomycin 能下调PASMCs 中CLC3 mRNA 和蛋白的表达。由此推测p38MAPK 可能是CLC3 的上游分子并且可调控其表达水平。
1 Liang W,Huang L,Zhao D,et al. Swelling-activated Cl- currents and intracellular CLC-3 are involved in proliferation of human pulmonary artery smooth muscle cells[J].J Hypertens,2014,32(2):318-330
2 Jin N,Hatton N,Swartz DR,et al. Hypoxia activates jun-N-terminal kinase,extracellular signal - regulated protein kinase,and p38 kinase in pulmonary arteries[J]. Am J Respir Cell Mol Biol,2000,23(5):593 -601
3 黄林静,黎关龙,何金波,等. 钙激活性氯离子通道在大鼠低氧高二氧化碳性PASMCs 中的表达及与MAPK 通路的关系[J].中国细胞生物学学报,2013,35(9):1321 -1327
4 陈晓琳,尹松梅.血小板氯通道[J]. 中国病理生理杂志,2004,20(5):909 -912
5 黄林静,何金波,王淑君,等. 尼氟灭酸在大鼠低氧高二氧化碳性肺血管收缩中的作用[J]. 中国应用生理学杂志,2014,30(1):74 -78
6 Qian JS,Pang RP,Zhu KS,et al. Static pressure promotes rat aortic smooth muscle cell proliferation via upregulation of volume-regulated chloride channel[J]. Cell Physiol Biochem,2009,24(5 -6):461 -470
7 Hisadome K,Koyama T,Kimura C,et al. Volume - regulated anion channels serve as an auto/paracrine nucleotide felease pathway in aotric endothelial cells[J]. J GenPhysiol,2002,119(6):511 -520
8 刘忠,李闪,朱建华,等.不同年龄高血压大鼠血管平滑肌中ERK和MKP-1 的表达[J]. 中国病理生理杂志,2006,22(3):468 -471
9 Jiang Q,Li F,Shi K,et al. ATF4 activation by the p38MAPK -eIF4E axis mediates apoptosis and autophagy induced by selenite in Jurkat cells[J].FEBS Lett,2013,587(15):2420 -2429
10 梁瑛琦,贾旭广,王万铁,等.三七总皂苷对低氧大鼠肺动脉压和肺组织p38MAPK 表达的影响[J]. 中国病理生理杂志,2010,26(12):2438 -2441



