董 琳 王志远 万春杰 陈兆兴 陈小芳
呼吸道合胞病毒(RSV)是婴幼儿下呼吸道感染(LRTI)一种最常见的病原,每年全球大约有60 万患儿因直接或间接感染RSV 而发生死亡[1]。生命早期的RSV 感染还与反复喘息、气道高反应性(AHR)及哮喘密切相关[2]。虽然这种相关性的内在本质尚未明确,但RSV 诱导的炎性介质释放和气道炎症持续存在可能发挥关键的作用[3]。RSV 能诱导多种趋化因子表达增加,包括单核细胞趋化蛋白-1(MCP-1)、巨噬细胞炎性蛋白-1α(MIP -1α)、白介素-8(IL -8)[4,5]。过度的趋化因子表达在RSV 感染的发病机制中起着重要作用,能够刺激和募集炎性细胞到感染部位,导致气道黏液分泌增多、上皮细胞损伤、脱落等炎性反应,出现气道阻塞和气道高反应性[6,7]。因此,阻断趋化因子的表达和释放,对治疗RSV 感染具有重要价值。活化过氧化物酶体增殖物活化受体γ(PPARγ)因具有显着的免疫调节、广泛的抗炎及抗病毒作用,其在RSV感染治疗中的作用令人关注[8,9]。
本研究采用人气道上皮细胞A549 细胞系建立RSV 感染的细胞模型,检测RSV 感染A549 细胞后不同时间MCP-1、MIP -1α 和IL -8 mRNA 表达和蛋白水平,并进一步观察15d-PGJ2和罗格列酮抑制剂干预的影响,以阐明RSV 感染时趋化因子的变化及PPARγ 激动剂的抑制作用及机制,为应用PPARγ 激动剂治疗RSV 感染提供理论依据。
材料与方法
1.材料和试剂:人Hep -2 和A549 细胞株购自中科院上海细胞生物研究所,来源于ATCC。RSV-Long 标准株购自中国预防医学科学院病毒所。15d -PGJ2(美国Biomol 公司),罗格列酮(北京高盟化工有限公司),PPARγ 拮抗剂GW9662(上海贝基生物科技有限公司),PDTC(Sigma 公司),RNA 引物(Invitrogen 公司)cDNA 第一链合成试剂盒(北京天根生化科技有限公司),RealMasterMix(北京天根生化科技有限公司),actin 抗体、辣根过氧化物酶标记山羊抗小鼠IgG (碧云天生物技术研究所),MCP-1、MIP-1α 及IL-8 ELISA 试剂盒(R&D 公司)。
2.细胞培养:细胞接种于25cm2培养瓶中,用F12K 培养,置于5%CO2、饱和湿度、37℃培养箱中,待细胞基本长满后,用0.25%胰蛋白酶进行消化传代;每隔2 ~3 天换液,待细胞长至80%融合状态时用于实验。
3.RSV 接种和增殖:将冻存的long 标准株复苏后接种于对数生长期单层Hep -2 细胞上,37℃、5% CO2培养箱吸附2h 后加入维持液,置温箱培养;逐日观察细胞病变效应(CPE),待CPE 达75%以上(约2 ~5 天),收获病毒悬液置-20℃≥2h、37℃反复冻融4 次。5000r/min 离心10min,弃沉淀,收集病毒上清液备用,-80℃保存。
4.RSV 半数感染量(TCID50)测定:Hep -2 细胞以1 ×105/ml 浓度接种于96 孔培养板,每孔100μl。病毒原液用维持液10 倍系列稀释9 个浓度即10-1,10-2,……,10-9。细胞长成单层时吸弃培养液,PBS 洗3 次,接种各稀释度的病毒液,每个浓度8 个复孔,每孔50μl。并设细胞对照组。置37℃、CO2培养箱中吸附2h,吸弃上清液,每孔加维持液100μl,置培养箱中继续培养。逐日观察CPE 并记录,连续观察7 天,用Reed-Muench 公式计算病毒的TCID50。
5. 实验分组:将传代培养的A549 细胞随机分为6 组:A组(15d-PGJ2+ RSV 组)、B 组(罗格列酮+ RSV 组)、C 组(RSV 对照组)、D 组(PDTC +RSV 组)、E 组(GW9662 +罗格列酮+ RSV 组)、F 组(细胞对照组)。A 组~E 组均以100TCID50 RSV 吸附2h 后加培养液培养。RSV 吸附前A、B、D 组分别给予15d-PGJ2(20μmol/L)、罗格列酮(20μmol/L)、PDTC(10μmol/L)预处理0.5h,F 组先以0.01% DMSO 预处理0.5h,再以不含RSV 的培养液培养。各组分别在培养12、24、48h 收获细胞及上清液待测。
6.实时定量RT -PCR 检测MCP -1、MIP -1α 及IL -8表达:收集培养的细胞,Trizol 法提取总RNA,按cDNA 第一链合成试剂盒获得cDNA 模板,置于-20℃保存备用。针对每一需要测量的基因和管家基因,选择一确定表达该基因的cDNA 模板进行PCR 反应。10mmol/L dNTP mix 1μl,10 × PCR Buffer 2.5μl,50mmol/L MgCl21.5μl,Taq DNA polymerase(5U/μl)0.4μl,扩增引物1(10μmol/L)1μl,扩增引物2(10μmol/L)1μl,cDNA 2μl,补38.1μl 灭菌蒸馏水至总体积为50μl。轻弹管底将溶液混合,设置PCR 反应:94℃变性2min;40 个PCR循环(94℃,20s;60℃,30s;72℃,30s)。MCP -1 上游引物:5' -TATTGTCCACTGACCCC - 3',下游引物:5' - CTTCACCCAAGTCCTAAGGT - 3';MIP - 1α 上 游 引 物:5' -CTACGTCTCTTGACCAACGT - 3',下游引物:5' - CACTCCTCACCCAGGTCTTT-3';IL -8 上游引物:5' -TAGCAAAATTGAGGCCAAGG -3',下游引物:5' - AAACCAAGGCACAGTGGAAC-3';β -actin 上游引物:5' -TGCCCATTTATGAGGGCTAC - 3',下 游 引 物:5' - GCCATCTCGTTCTCGAAGTC - 3'。PCR 产物与100bp DNA Ladder 在2%琼脂糖凝胶电泳,溴化乙锭染色,检测PCR 产物是否为单一特异性扩增条带。PCR产物进行10 倍梯度稀释后的DNA 模板以及所有cDNA 样品分别配置real-time PCR 反应体系。体系参照RealMasterMix试剂盒,于real-time PCR 仪上进行PCR 反应。监测并收集荧光信号。扩增反应结束后建立PCR 产物的熔解曲线。2-△△Ct法计算各标本目的基因的相对表达量。
7.ELISA 检测MCP -1、MIP -1α 及IL -8 蛋白水平:无菌eppendorf 管收集A549 细胞培养上清液,置-80℃冰箱保存。应用ELISA 试剂盒严格按照说明书操作。
8.统计学方法:实验重复3 次,计量资料实验数据均以均数±标准差(±s)表示。采用SPSS 17.0 软件进行分析,以P<0.05 为差异有统计学意义。多组样本均数比较采用单因素方差分析;两两比较方差齐者采用LSD 检验,方差不齐者采用Dunnett's-T3 检验。
结 果
1.RSV 感染及PDTC 干预后MCP -1、MIP -1α、IL-8 mRNA 和蛋白表达的变化:如图1 及表1 ~表3所示,C 组与F 组相比,MCP-1、MIP-1α、IL-8 mRNA 和蛋白的表达均在12h 开始升高,其中mRNA 表达在24h 达高峰,48h 有所下降,与12h 的表达相近,差异无统计学意义(P 均>0.05);而蛋白的表达在48h 达高峰,与12h 比较差异有统计学意义(P 均<0.05);D 组各时间点3 种趋化因子mRNA 和蛋白的表达均明显低于C 组(P 均<0.05),但仍高于F 组(P 均<0.05)。
表1 PPARγ 激动剂干预对RSV 感染MCP-1 mRNA 及蛋白表达的影响(±s,n=4,pg/ml)
与C 组比较,* P <0.05;与F 组比较,#P <0.05
组别12h 24h 48h mRNA 蛋白 mRNA 蛋白 mRNA 蛋白A 组 1859.20 ±36.403* 250.860 ±13.105* 1959.957 ±45.609* 256.193 ±11.670* 1718.690 ±31.309* 269.845 ±11.646*B 组 1881.913 ±69.045* 261.333 ±10.832* 1957.190 ±51.828* 267.232 ±10.625* 1739.836 ±31.319* 277.152 ±10.826*C 组 2427.218 ±59.697# 299.061 ±10.656# 2862.060 ±51.526# 308.134 ±11.321# 2386.833 ±42.969# 367.606 ±11.142#D 组 1869.304 ±33.452* # 262.500 ±10.942* # 2031.330 ±28.600* # 264.515 ±10.813* # 1737.157 ±22.894* # 274.035 ±10.747* #E 组 2305.675 ±63.749# 288.852 ±11.683# 2691.560 ±56.187# 295.366 ±10.382# 2241.673 ±43.550# 339.449 ±13.123#F 组 1035.543 ±22.609* 151.305 ±11.157* 1007.398 ±21.047* 170.697 ±10.181* 1124.348 ±16.476* 149.868 ±13.157*
表2 PPARγ 激动剂干预对RSV 感染MIP-1α mRNA 及蛋白表达的影响(±s,n=4,pg/ml)

表2 PPARγ 激动剂干预对RSV 感染MIP-1α mRNA 及蛋白表达的影响(±s,n=4,pg/ml)
与C 组比较,* P <0.05;与F 组比较,#P <0.05
组别12h 24h 48h mRNA 蛋白 mRNA 蛋白 mRNA 蛋白A 组 361.117 ±21.036* 333.570 ±11.015* 378.687 ±25.725* 340.954 ±10.850* 343.072 ±18.471* 364.918 ±10.644*B 组 381.583 ±22.436* 379.530 ±10.881* 385.367 ±13.059* 370.202 ±10.577* 367.411 ±17.909* 385.513 ±11.725*C 组 469.296 ±30.146# 410.173 ±11.052# 569.500 ±26.803# 398.223 ±11.624# 471.853 ±30.448# 512.631 ±11.361#D 组 394.196 ±14.146* # 369.595 ±10.770* # 430.910 ±11.651* # 357.454 ±11.045* # 373.933 ±15.041* # 371.655 ±10.710* #E 组 423.410 ±9.070# 395.889 ±11.800# 522.780 ±14.545# 387.303 ±11.082# 433.972 ±26.809# 474.418 ±11.415#F 组 295.679 ±13.679* 90.516 ±8.070* 305.398 ±14.893* 92.013 ±5.400* 323.348 ±16.981* 84.214 ±11.650*
表3 PPARγ 激动剂干预对RSV 感染IL-8 mRNA 及蛋白表达的影响(±s,n=4,pg/ml)
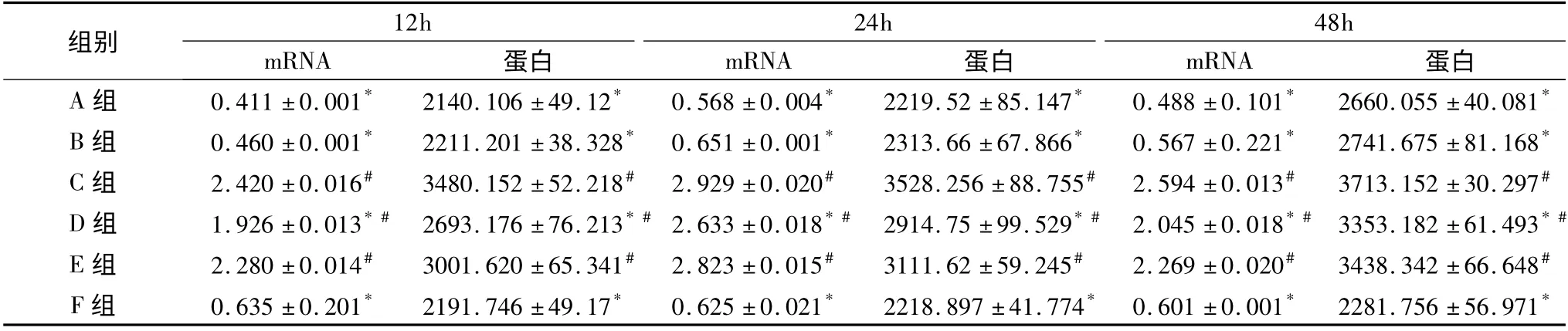
表3 PPARγ 激动剂干预对RSV 感染IL-8 mRNA 及蛋白表达的影响(±s,n=4,pg/ml)
与C 组比较,* P <0.05;与F 组比较,#P <0.05
组别12h 24h 48h mRNA 蛋白 mRNA 蛋白 mRNA 蛋白A 组 0.411 ±0.001* 2140.106 ±49.12* 0.568 ±0.004* 2219.52 ±85.147* 0.488 ±0.101* 2660.055 ±40.081*B 组 0.460 ±0.001* 2211.201 ±38.328* 0.651 ±0.001* 2313.66 ±67.866* 0.567 ±0.221* 2741.675 ±81.168*C 组 2.420 ±0.016# 3480.152 ±52.218# 2.929 ±0.020# 3528.256 ±88.755# 2.594 ±0.013# 3713.152 ±30.297#D 组 1.926 ±0.013* # 2693.176 ±76.213* # 2.633 ±0.018* # 2914.75 ±99.529* # 2.045 ±0.018* # 3353.182 ±61.493* #E 组 2.280 ±0.014# 3001.620 ±65.341# 2.823 ±0.015# 3111.62 ±59.245# 2.269 ±0.020# 3438.342 ±66.648#F 组 0.635 ±0.201* 2191.746 ±49.17* 0.625 ±0.021* 2218.897 ±41.774* 0.601 ±0.001* 2281.756 ±56.971*
2. PPARγ 激动剂及GW9662 干预对RSV 感染MCP-1、MIP-1α、IL-8 mRNA 和蛋白表达的影响:如表1 ~表3 所示,A 组、B 组与C 组相比,各时间点MCP-1、MIP -1α、IL -8 mRNA 和蛋白的表达均明显降低(P 均<0.05);E 组与C 组相比,各时间点3种趋化因子蛋白及mRNA 的表达差异无统计学意义(P 均>0.05),但仍高于F 组(P 均<0.05)。
讨 论
气道上皮细胞是RSV 感染的靶细胞,RSV 在其中复制能分泌大量的IL-8、MCP-1、MIP-1α 等趋化因子,其中IL-8 属于CXC 家族成员,对中性粒细胞有强烈的趋化和激活作用;MIP-1α 和MCP-1 属于CC 趋化因子,可募集中性粒细胞、淋巴细胞等炎性细胞到炎症部位。纯化的RSV G 蛋白可以刺激人支气管上皮细胞IL -8 和MCP -1 的分泌,F 蛋白则促使这些产物向炎症部位趋化渗出[10]。Seki 等[4]的体外研究发现,胎儿肺纤维母细胞RSV 感染24h 后,包括IL-8、MCP-1 和MIP-1 在内的多种炎性介质表达升高,提示趋化因子和细胞因子的过度产生可能与RSV 诱导的过度变态反应性炎症的病生机制有关。体内研究显示,RSV 感染后肺部炎性反应的程度及病情与鼻咽分泌物、BALF 或肺组织中IL -8、MIP-1α 和MCP-1 水平相关,表明这些趋化因子在RSV 感染的气道炎症中发挥了重要作用,还可以用来评估病情及指导治疗[11~13]。本实验结果显示:RSV 感染后A549 细胞MCP -1、MIP -1α 和IL - 8 mRNA 和蛋白的表达明显升高,其中基因的表达自感染后12h 开始明显增加,高峰时间在24h;蛋白的表达则自感染后12h 明显增加,高峰时间在48h,与文献报道相一致[10,13]。证实RSV 感染可诱导MCP -1、MIP-1α 和IL- 8 的表达和释放。
核转录因子-κB(NF-κB)是调控趋化因子、细胞因子等炎性介质基因转录的关键转录因子,激活后可引发全面的炎性反应。PDTC 是是NF-κB 特异性阻断剂,可抑制NF -κB 的p65 亚单位,并具有金属螯合作用,通过抑制NF -κB 信号通路,抑制炎性因子基因的表达从而减少其释放[14]。本研究预先应用PDTC 处理RSV 感染的A549 细胞,结果能明显下调MCP-1、MIP-1α 和IL -8mRNA 表达和蛋白分泌,证明NF-κB 的激活在调节趋化因子的表达中有重要作用。抑制NF-κB 信号通路活化,阻断趋化因子的表达和释放,可为抑制RSV 诱发的气道炎症、减轻病情提供可靠的治疗手段[6,12]。
抑制NF-κB 信号通路激活,下调细胞因子和趋化因子表达,减少炎性细胞募集是PPARγ 激动剂主要抗炎机制[15]。PPARγ 激动剂可直接与NF - κB p65/p50 结合,降低NF -κB 与DNA 的结合活性,也可通过抑制NF - κB 复合物抑制因子(IκB)激酶(IKKs)活性,减少IκB-α 降解而下调趋化因子。体内外研究显示15d -PGJ2能抑制IL -8 mRNA 及蛋白水平,延缓IκB-α 降解;而吡格列酮能抑制NF -κB 活性及MCP -1 表达[16]。Arnold 等[17]的研究结果显示,15d-PGJ2和罗格列酮干预对RSV 增殖有显着的抑制作用,并能有效减少RSV 诱导的细胞因子及合胞体形成,显着抑制RSV 表面黏附蛋白G 和融合蛋白F 蛋白表达,表明其对RSV 感染兼有抗病毒和抗炎作用。本实验通过研究15d -PGJ2和罗格列酮对RSV 感染A549 细胞的趋化因子表达水平来探讨PPARγ 激动剂的体外抗炎作用,结果发现15d -PGJ2和罗格列酮干预均可下调RSV 感染的MCP -1、MIP-1α 和IL-8 蛋白和mRNA 和表达,而预先应用PPARγ 拮抗剂GW9662 后可以阻断罗格列酮的上述作用,表明15d-PGJ2和罗格列酮有体外抑制RSV感染MCP-1、MIP-1α 和IL-8 表达的作用,也进一步证实了趋化因子在RSV 诱导的气道炎症中的作用。
综上所述,本研究为PPARγ 激动剂治疗RSV 感染的作用及其机制提供了理论证据,由于PPARγ 激动剂具有多方面的抗炎作用和抗氧化作用,其在RSV感染中是否还可通过非PPAR 依赖的途经发挥作用尚未明确,有待于今后进一步研究。
1 Stockman LJ,Curns AT,Anderson LJ,et al. Respiratory syncytial virus-associated hospitalizations among infants and young children in the United States,1997 -2006[J]. Pediatr Infect Dis J,2012,31(1):5 -9
2 Perez-Yarza EG,Moreno A,Lazaro P,et al. The association between respiratory virus infection and the development of childhood asthma:a systematic review of the literature[J].Pediatr Infect Dis J,2007,26(8):733 -739
3 Hansbro NG,Horvat JC,Wark PA,et al. Understanding the mechanisms of viral induced asthma:new therapeutic directions[J]. Pharmacol Ther,2008,117(3):313 -353
4 Seki E,Yoshizumi M,Tanaka R,et al. Cytokine profiles,signalling pathways and effects of fluticasone propionate in respiratory syncytial virus - infected human foetal lung fibroblasts[J]. Cell Biol Int,2013,37(4):326 -339
5 Tian B,Zhang Y,Luxon BA,et al. Identification of NF-kappaBdependent gene networks in respiratory syncytial virus-infected cells[J]. J Virol,2002,76(13):6800 -6814
6 Zeng R,Li C,Li N,et al. The role of cytokines and chemokines in severe respiratory syncytial virus infection and subsequent asthma[J]. Cytokine,2011,53(1):1 -7
7 刘琳,董琳,徐月波,等. RSV 感染诱导的RANTES、FKN、IP-10表达及PPARγ 激动剂抑制作用的体外研究[J]. 中华微生物学和免疫学杂志,2013,9:659 -665
8 万春杰,董琳,林洁,等. PPARγ 激动剂抗呼吸道合胞病毒感染作用的体外研究[J]. 中华实验和临床病毒学杂志,2011,25(6):480 -482
9 Daynes RA,Jones DC. Emerging roles of PPARs in inflammation and immunity[J]. Nat Rev Immunol,2002,2(10):748 -759
10 Oshansky CM,Barber JP,Crabtree J,et al. Respiratory syncytial virus F and G proteins induce interleukin lalpha,CC,and CXC chemokine responses by normal human bronchoepithelial cells[J]. J Infect Dis,2010,201(8):1201 -1207
11 Reimers K,Buchholz K,Werchau H. Respiratory syncytial virus M2-1 protein induces the activation of nuclear factor kappa B[J]. Virology,2005,331(2):260 -268
12 Brand HK,Ferwerda G,Preijers F,et al. CD4+T-cell counts and interleukin -8 and CCL -5 plasma concentrations discriminate disease severity in children with RSV infection[J].Pediatr Res,2013,73(2):187 -193
13 Mella C,Suarez-Arrabal M C,Lopez S,et al. Innate immune dysfunction is associated with enhanced disease severity in infants with severe respiratory syncytial virus bronchiolitis[J]. J Infect Dis,2013,207(4):564 -573
14 Liu SF,Ye X,Malik AB. Inhibition of NF - kappaB activation by pyrrolidine dithiocarbamate prevents In vivo expression of proinflammatory genes[J]. Circulation,1999,100(12):1330 -1337
15 Straus DS,Glass CK. Anti -inflammatory actions of PPAR ligands:new insights on cellular and molecular mechanisms[J]. Trends Immunol,2007,28(12):551 -558
16 Arnold R,Konig W. Peroxisome -proliferator -activated receptor -gamma agonists inhibit the release of proinflammatory cytokines from RSV-infected epithelial cells[J]. Virology,2006,346(2):427 -439
17 Arnold R,Konig W. Peroxisome proliferator - activated receptor -gamma agonists inhibit the replication of respiratory syncytial virus(RSV)in human lung epithelial cells[J]. Virology,2006,350(2):335 -346



