张孝天 臧 琦
肺气肿是一种慢性、渐进性、不可逆的疾病,严重威胁着人类的健康,它以肺的高膨胀性、低弹性为特点。目前药物治疗只能缓解患者的自觉症状但不能改变或逆转疾病的进程。传统肺减容手术和微创肺减容术对肺气肿的治疗均取得了一定的效果,然而,大规模的临床对照试验显示传统肺减容术( LVRS) 对患者选择要求高、创伤大,且此类患者心肺功能差,导致手术并发症和病死率仍相对较高;微创肺减容术系指经支气管镜封堵靶区支气管以达到肺减容的效果,但因目前的注射药物及封堵材料不理想,靶区可出现无菌性炎症和( 或) 脓肿; 由于气肿肺组织的高度充气及侧支通气的存在,被封堵远端肺组织萎陷程度不一,使肺减容效果不确切。因此,研究一种新途径的微创肺减容术,既能达到传统肺减容术的效果,又能将创伤减小到最低,这是目前临床所需要的。本研究基于肺减容术和微创技术两个概念及氩氦刀冷冻消融原理,设计采用氩氦刀经皮靶向肺减容术治疗实验兔肺气肿,探讨经皮冷冻肺的治疗技术方案,了解气肿肺冷消融后不同时间的肺功能及血气变化以及组织病理学特性,确定氩氦刀经皮靶向肺减容术的有效性、可行性和安全性。
对象与方法
1.实验对象:纯种健康新西兰成年大白兔20 只( 山东大学医学实验动物中心提供) ,常规喂养,实验前2 周内接受常规检查,无饮食和行为异常。本研究设计获得山东省千佛山医院伦理委员会的批准。
2.实验仪器: ( 1) 氩氦冷冻系统: 美国恩多凯尔( endocare) 公司生产,氩氦刀直径2mm。该系统是根据焦耳定律设计,其原理是高压气体经过狭窄的喷嘴进入探针尖端,压力突然下降,不同的气体在局部产生不同的温度变化。氩气引起温度降低( 可达-150℃) ,氦气可使温度升高( 可达60℃) 。(2) AniRes 2005 动物肺功能分析系统:北京贝兰博科技有限公司生产。(3) 快速血气分析仪: i -stat corporation,East Windsor,NJ。
3.兔肺气肿造模方法:胰弹性蛋白酶( 上海伯奥生物科技有限公司产品,活性1000U/mg) 按2000U/kg 体重加生理盐水稀释至3ml,将内径为3.0mm 的气管插管盲插入兔气管内,经气管插管1 次性缓慢注入兔肺内,将兔直立旋转,使酶液均匀分布肺内,正常饲养6 周,经肺功能检测证实形成中至重度肺气肿( 造模过程中如出现造模兔死亡,由备用新西兰大白兔补充) 。
4.氩氦刀冷消融方法: 经兔耳缘静脉注射氯胺酮与安定混合麻醉。氯胺酮(100mg∶2ml) 与地西泮(10mg∶2ml) 按1∶1混合,加生理盐水稀释至20ml,每次注射2 ~3ml。麻醉成功后用CT 确定冷冻部位,采用经皮穿刺的方法,刀尖至靶肺中心。
首先对兔正常肺实施2 ~3 次冷融循环,冷冻时间每次5min,复温过程每次2min,发现3 次冷融循环可使兔术中及术后出现较高病死率,因此,实验组冷冻全部采用2 次冷融循环,每次5min,复温过程采用氦气主动复温,复温时间为2min。实验组20 只建立肺气肿模型新西兰大白兔分别随机对应分为5 组,每组4 只,标示术后1、3、7、14 和28 天。
5.肺功能检查:在造模前后和治疗后不同时间内经兔耳缘静脉注射氯胺酮与地西泮混合麻醉药物麻醉动物,气管插管后用AniRes2005 动物肺功能分析系统检测兔肺功能。检测指标包括:用力呼气量( FEV0.4) 、用力肺活量/最大肺活量( FEV0.4/ FVC) 、残气量/肺总量( FRC/TLC) 、呼气相气道阻力( Re) 。
6.血气分析:在造模前后和治疗后不同时间内分别从兔耳背动脉抽取动脉血1ml,用肝素钠抗凝后,在快速血气分析仪上进行血气分析。测定指标包括:PaO2、PaCO2、SaO2和pH 值。
7.组织标本制作:5 组动物分别于术后1、3、7、14 和28 天时行肺功能检测、血气分析,然后相应当天随机处死1 只动物留取双肺组织,10%甲醛溶液固定、石蜡包埋、切片,HE 染色。
8.统计学方法:造模后术前和术后1、3、7、14 和28 天肺功能和血气分析数值对照,采用SPSS 11.5 统计学软件,数据以均数±标准差(±s) 表示,多组间均数比较采用方差分析,确定肺功能改善最佳时间。以P <0.05 为差异有统计学意义。
结 果
1.氩氦刀肺减容肺部影像学变化趋势:冷冻开始后肺部靶向部位磨玻璃样影( 边界较模糊) →密度增高( 边界清晰) →肺组织高密度实变影。肺冷冻消融开始第1 次冷冻循环时,探针周围逐渐出现毛玻璃样阴影,与周围组织分界不清;而第1 次复温期间,开始时CT 下可见探针周围不透明磨玻璃样影,与周围分界不清,并逐渐扩大,密度亦逐渐增加;第2 个冷融循环时,可见冷冻区肺组织高密度实变影,周围边界清晰;可见冷冻探针金属高密度影( 图1) 。

图1 氩氦刀冷冻消融时肺部影像学变化
2.肺功能检测指标变化: 与正常肺功能比较,肺气肿模型或氩氦刀肺减容术后各组,FEV0.4、FEV0.4/FVC 均降低,FRC/TLC,Re 均增高( P <0.05) ; 与肺气肿模型比较,氩氦刀肺减容术后1 天肺功能无明显变化( P >0.05) ,术后3 天、术后7 天FEV0.4、FEV0.4/FVC 均增加,FRC/TLC,Re 均降低( P <0.05) ,术后14 天和术后28 天FEV0.4、FEV0.4/FVC 均显着增加,FRC/TLC,Re 均显着降低( P <0.01) ; 术后14 天与术后28 天肺功能变化之间相比,差异无统计学意义( P >0.05,表1) 。
表1 氩氦刀肺减容术前后肺功能变化(±s)
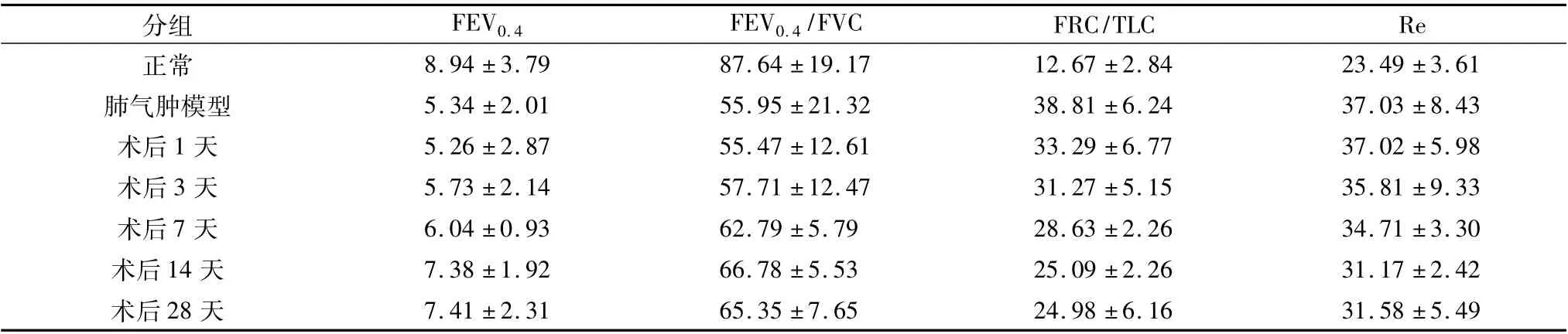
表1 氩氦刀肺减容术前后肺功能变化(±s)
分组 FEV0.4 FEV0.4/FVC FRC/TLC Re正常 8.94 ±3.79 87.64 ±19.17 12.67 ±2.84 23.49 ±3.61肺气肿模型 5.34 ±2.01 55.95 ±21.32 38.81 ±6.24 37.03 ±8.43术后1 天 5.26 ±2.87 55.47 ±12.61 33.29 ±6.77 37.02 ±5.98术后3 天 5.73 ±2.14 57.71 ±12.47 31.27 ±5.15 35.81 ±9.33术后7 天 6.04 ±0.93 62.79 ±5.79 28.63 ±2.26 34.71 ±3.30术后14 天 7.38 ±1.92 66.78 ±5.53 25.09 ±2.26 31.17 ±2.42术后28 天7.41 ±2.31 65.35 ±7.65 24.98 ±6.16 31.58 ±5.49
3.血气分析检测指标变化:与正常兔血气指标变化比较,肺气肿模型或氩氦刀肺减容术后各组相比,各组血气指标PaCO2均增加,pH 值、SaO2和PaO2均降低( P <0.05) ; 与肺气肿模型比较,术后1 天血气分析指标无明显变化( P >0.05) ,术后3 天和术后7天pH、PaO2、SaO2均增加,PaCO2均降低( P <0.05) ,术后14 天和术后28 天pH 值、PaO2、SaO2均显着增加,PaCO2均显着降低( P <0.01) ;术后14 天与术后28 天血气分析指标变化相比无明显变化( P >0.05,表2) 。
4.病理观察:氩氦刀冷冻消融后1 天: 冷冻中心可见肺组织出血坏死,气管及血管较难分辨( 图2A) ;周围肺泡结构存在,部分肺泡间隔毛细血管充血,肺组织水肿,少量出血( 图2B) ;冷冻消融3 天:冷冻中心区域可见坏死出血( 图2C) ,周围组织肺泡骨架正常,部分肺泡间隔毛细血管充血水肿( 图2D) ;冷冻消融后7 天: 冷冻中心区域出血坏死,可见胶原生成( 图2E) ,冷冻中心周围可见肉芽组织、肺泡上皮和支气管上皮增生。肺泡周围毛细血管充血,可见含铁血黄素巨噬细胞( 图2F) 。冷冻消融术后14 天:冷冻中心组织坏死,慢性炎性细胞浸润( 图2G) ,周围组织充血,可见肉芽组织增生,含铁血黄素沉积( 图2H) 。冷冻消融术后28 天:冷冻中心胶原纤维增生,纤毛柱状上皮增生,黏膜内及黏膜下中性粒细胞、淋巴细胞浸润( 图2I) ,周边纤维组织增生,散在慢性炎性细胞浸润,含铁血黄素沉积( 图2J) 。
表2 氩氦刀肺减容术前后血气变化(±s)
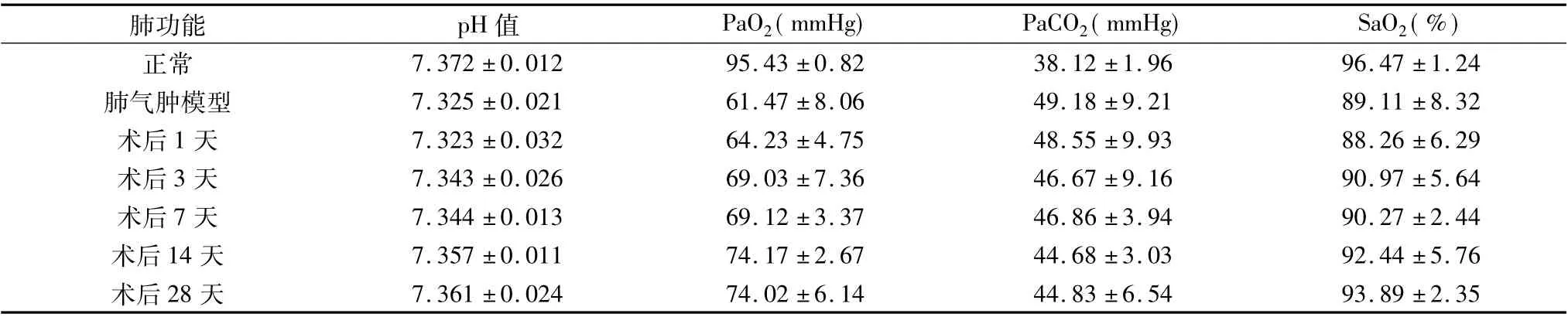
表2 氩氦刀肺减容术前后血气变化(±s)
肺功能 pH 值 PaO2( mmHg) PaCO2( mmHg) SaO2( %)24肺气肿模型 7.325 ±0.021 61.47 ±8.06 49.18 ±9.21 89.11 ±8.32术后1 天 7.323 ±0.032 64.23 ±4.75 48.55 ±9.93 88.26 ±6.29术后3 天 7.343 ±0.026 69.03 ±7.36 46.67 ±9.16 90.97 ±5.64术后7 天 7.344 ±0.013 69.12 ±3.37 46.86 ±3.94 90.27 ±2.44术后14 天 7.357 ±0.011 74.17 ±2.67 44.68 ±3.03 92.44 ±5.76术后28 天 7.361 ±0.024 74.02 ±6.14 44.83 ±6.54 93.89 ±2.35正常 7.372 ±0.012 95.43 ±0.82 38.12 ±1.96 96.47 ±1.

图2 肺冷冻区光镜下的组织学改变( HE,×20)
讨 论
肺减容术是由Brantigan 等[1]于1957 年在前人经验和对胸腔生理深入了解的基础上,对肺气肿及其治疗提出的,并在临实践中达到预期的效果,但是肺组织漏气等并发症较多,病死率较高。此后Cooper等[2]虽经多方面的改进已基本解决残肺漏气的问题,使LVRS 的安全性得到了明显提高。但仍有文献报道LVRS 术后并发症肺持续漏气高达68%,FEV1和DLCO ≤20% 的病例术后30 天内病死率高达16%[3,4]。微创手术包括支气管生物蛋白胶封堵、支气管内单向阀门置入等新的方法目前大多尚处于探索或初期试验阶段,仍有不少问题有待解决[5]。氩氦刀通过介入人体微控针的冷冻来促使病灶组织快速降温、冷冻及融化,同时使血管闭塞引起缺血性缺氧致相应区域细胞变性坏死,产生不可逆损伤,从而达到清除病灶的目的,常用于肝、肾、前列腺以及肺部实体肿瘤的治疗。随着氩氦刀的免疫效应、热池效应等优点不断被发现以及氩氦刀治疗实体肿瘤方法的逐渐成熟,关于氩氦刀治疗肿瘤的报道越来越多,然而文献对氩氦刀冷冻消融对肺气肿治疗方法却鲜有报道[6,7]。
氩氦刀对肺脏的冷冻消融与其他实质性脏器略有不同。因肺内含有大量气体,阻碍低温在肺内顺利传导,使冰球的形成受阻,导致在相同冷溶循环及时间下,使肺气肿肺与其他实体组织冷冻范围有较大区别。Permpongkosol 等[8]通过对猪应用相同冷冻消融方案,比较氩氦刀冷冻消融作用于肝脏、肾脏、肺3 个器官时,肺的冷冻区域面积最小。Hinshau 等[9]对正常猪肺总共行18 次冷融循环,其中2 次冷融循环和3 次冷融循环各9 次,结果行3 次冷融循环组有较大的冷冻消融面积,且产生较高的免疫反应。Izumi等[10]对正常猪肺分别进行1 和2 次冷溶循环后,指出经过第1 次冷冻-复温循环后,肺泡腔被液体填充,改变了肺的冷冻性能,使冷冻区域面积在行第2次冷冻-复温循环后较第1 次明显扩大。在预实验中,笔者曾对兔正常肺施行3 次冷融循环,冷冻时间每次5min,复温过程每次2min,但术中及术后死亡率较高,笔者考虑由于兔肺脏体积相对较小,3 次冷融循环使冷冻范围过大导致死亡率增加。因此,在肺气肿氩氦刀肺减容治疗中,笔者全部采用2 次冷融循环,冷冻过程每次5min,复温过程每次2min。根据冷融循环过程中胸部CT 表现中笔者了解到,随着冷融循环次数的增加,冰球直径及冷冻区域密度逐渐升高。苏木素伊红染色病理切片证实氩氦刀探针中心部位肺组织及周围临近组织出血坏死,可以推断冷冻时靶向肺组织充血使局部区域密度升高,出现磨玻璃样影,复温后周围组织水肿,坏死并伴出血,使局部氩氦刀治疗靶向区域密度继续升高,进而出现CT 下靶向区域实变影。
对肺气肿模型行氩氦刀肺减容术后,术后3、7、14、28 天FEV0.4、FEV0.4/FVC 均增高; FRC/TLC、Re均降低; 血气指标如PaCO2均降低,pH 值、PaO2、SaO2均增加。术后第1 天的肺功能及血气指标较肺气肿模型相比改善并不明显( P >0.05) ,考虑氩氦刀术后胸腔内渗出较多,局部肺水肿,肺复张受限所致。本次研究中,术后14、28 天肺功能及血气分析指标较肺气肿模型( P <0.01) 以及术后第7 天( P <0.05) 明显改善;然而术后14 天与28 天之间各项肺功能及血气指标并未出现明显差异( P >0.05) 。由此肺功能及动脉血气最佳改善时间为7 ~14 天。肺功能及血气分析在术后明显改善笔者考虑有以下几个原因:①氩氦刀冷冻消融使无功能的肺组织变性坏死,降低胸廓运动负荷,减少呼吸做功,恢复正常呼吸运动功能,使肺功能改善;②相邻正常肺组织内肺泡扩张,气体交换能力较前加强,改善全身氧供;③无功能肺组织的移除,减少慢性炎症及氧化应激对肺组织的进一步损伤,延缓了肺气肿的发展;④对周围组织损伤较少,明显的减少漏气,出血等并发症,机体较快恢复[11]。
根据氩氦刀肺减容术后各时间段病理结果分析,术后1 天氩氦刀探针中心部位肺组织出血坏死,而探针外围则仅仅出现肺组织充血;说明氩氦刀对周围组织损伤较小,术中及术后的轻度出血、气胸或皮下气肿等并发症主要是由于探针中心止血不彻底或漏气所致。冷冻消融术后7 天后可见纤维组织增生伴肉芽组织以支气管上皮细胞的增生,处于术后恢复期;较传统的LVRS 创伤小,术后恢复快。然而氩氦刀实验组治疗过程中,3 例在行2 次冷融循环后少量出血,经对症处理后,出血停止;考虑氩氦刀治疗过程中冷冻探针损伤支气管动脉,导致出血。2 例在治疗过程中及其后出现轻度皮下气肿,但皮下气肿在术后恢复中均逐渐消失。氩氦刀冷冻消融过程及术后除轻度出血以及皮下气肿外,并未出现血胸,持续漏气,脓胸等其他严重并发症,与LVRS 术后持续漏气概率( 高达68%) 相比,明显减少[3,4]。
综上所述,氩氦刀肺减容术治疗能明显改善肺气肿症状,创伤小,并发症较少。但由于实验兔肺体积较小以及操作等各方面原因的限制,笔者对实验兔全部进行2 次冷融循环,致使本研究不能将冷融循环次数对肺功能和血气分析等指标的影响做详细的对比研究。尽管如此,但这并未影响氩氦刀微创肺减容术对肺气肿治疗的有效性及安全性。因此在进行下一步研究时应选取肺体积较大的实验动物,将冷融循环次数、时间对靶向肺组织面积、并发症以及肺功能和血气分析的影响做详细的研究及分析。经皮下对肺气肿进行氩氦刀冷冻消融术是新兴领域,目前尚有许多问题尚未解决,如对氩氦刀治疗过程中出血,漏气等并发症的预防及治疗;改变冷冻或复温时间以及循环次数对冷冻面积大小或并发症多少有无差别;冷冻消融位置的选择,最佳的冷冻复温时间以及循环次数的确定等仍需进一步研究。
1 Brantigan OC,Mueller E. Surgical treatment of pulmonary emphysema[J]. Am Surg,1957,23(9) :789 -804
2 Cooper J,Trulock E,Triantafillou A,et al. Bilateral pneumonectomy( volume reduction) for chronic obstructive pulmonary disease[J]. J Thorac Cardiovasc Surg,1995,109(1) :106 -116
3 National Emphysema Treatment Trial Research Group. Patients at high risk of death after lung - volume - reduction surgery[J]. N Engl J Med,2001,345(15) :1075 -1083
4 National Emphysema Treatment Trial Research Group. A randomized trial comparing lung-volume-reduction surgery with medical therapy for severe emphysema[J]. N Engl J Med,2003,348( 21) :2059 -2073
5 Brenner M,Hanna NM,Mina -Araghi R,et al. Innovative approaches to lung volume peduction for emphysema[J]. Chest,2004,126(1) :238 -248
6 Ablin RJ. An immune response a possible careat to endoscopiccryotherapy[J]. Gastroinetest Endose,2001,53 (7) : 840
7 Lau WY,Leung TW,Yu SC,et al. Pecutaneous local ablativetherapy for hepatocellular carcinoma a review and look into the future[J].Ann Surg,2003,237(2) :171 -179
8 Permpongkosol S,Nicol TL,Link RE,et al. Differences in ablation size in porcine kidney,liver,and lung after cryoablation using the same ablation protocol[J]. AJR Am J Roentgenol,2007 ,188( 4) :1028 -1032
9 Hinshaw JL,Littrup PJ,Durick N,et al. Optimizing the protocol for pulmonary cryoablation: a comparison of a dual - and triple - freeze protocol[J]. Cardiovasc Intervent Radiol,2010 ,33(6) :1180 -1185
10 Izumi Y,Oyama T,Ikeda E,et al. The acute effccts of transthoracic cryoablation on normal lung evaluation in a porcine model[J]. Ann Thorac Surg,2005,79(1) :318 -322
11 Mineo D,Mineo TC. et al. Lung volume reduction surgery: a better understanding for a renewed challenge in the treatment of emphysema[J]. Am J Respir Crit Care Med,2012,186(11) :1068 -1070



