刘平莉
合并支气管扩张的慢性阻塞性肺疾病急性加重期患者病原谱及耐药性分析
刘平莉
目的 探讨合并支气管扩张的急性加重期慢性阻塞性肺疾病(AECOPD)感染病原菌分布及其耐药情况,指导临床合理用药。方法 选择笔者医院2010年1月~2014年4月住院的98例合并支气管扩张的COPD急性加重期患者为研究对象,对所有患者痰标本中分离出的病原菌进行菌种鉴定和耐药性分析。结果 共分离出66株病原菌,其中,革兰阴性杆菌52株,占78.8%;革兰阳性球菌5株,占7.6%;真菌9株,占13.6%。最主要的革兰阴性杆菌依次为铜绿假单胞菌(27.3%)、大肠杆菌(13.6%)、肺炎克雷伯菌(12.1%)、鲍曼不动杆菌(10.6%)、阴沟肠杆菌(7.6%)。革兰阳性球菌以金黄色葡萄球菌(4.5%)为主。革兰阴性杆菌耐药现象均较普遍,对亚胺培南、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、阿米卡星敏感度较高。金黄色葡萄球菌未发现对万古霉素耐药。结论 合并支气管扩张的COPD急性加重期感染致病菌以革兰阴性杆菌为主,其次为真菌、革兰阳性球菌。细菌耐药情况较为严重,应结合本地区病原菌分布特点及耐药状况,合理选用抗菌药物。
急性加重 慢性阻塞性肺疾病 支气管扩张 病原菌 耐药性
慢性阻塞性肺疾病(COPD)和支气管扩张是常见的慢性呼吸道疾病,两者均可导致肺组织结构破坏、肺功能逐渐恶化,导致患者生活质量下降。长期以来认为COPD和支气管扩张是相互独立、不能共存的两种疾病。但近年来临床研究发现COPD与支气管扩张关系密切、是导致支气管扩张发病的一个危险因素,为数不少的中重度COPD患者随着病情进展,可同时合并有支气管扩张。合并支气管扩张的COPD患者气道内病原菌定植率增加,感染控制难度大,患者病情恶化更快[1~3]。因此了解COPD合并支气管扩张患者病原菌分布及耐药情况,对于提高治疗成功率、延长患者的生存期具有重要的意义。
本研究对2010年1月~2014年4月笔者医院住院合并支气管扩张的AECOPD患者痰病原菌分布及细菌耐药性进行分析,以便为临床合理抗感染治疗提供科学依据。
资料与方法
1.研究对象:选择2010年1月1日~2014年4月31日在笔者医院住院治疗的98例合并支气管扩张的AECOPD患者为研究对象,其中,男性61例,女性37例,患者年龄54~87岁,平均年龄65.0±10.8岁。所有COPD患者均符合2013年中华医学会呼吸病学分会制定的诊断标准,AECOPD定义为在COPD基础上咳嗽、咳脓痰、气短和(或)喘息症状恶化,超出日常的变异,并且需要改变日常药物用量[4]。在符合COPD诊断标准的基础上,参照文献[5]胸部高分辨率CT(HRCT)具备以下表现诊断为COPD合并支气管扩张:①缺乏支气管从中央到外周逐渐变细的趋势; ②支气管管径大于伴行的肺动脉直径;③距外周肋胸膜或纵隔胸膜1cm内见支气管影。具备以下情况之一者被排除在本研究之外:①在诊断COPD之前具备反复咳嗽、咳脓痰、咯血等典型症状,高度可能为支气管扩张患者或已经确诊为支气管扩张者;②合并支气管哮喘、肺癌、间质性肺疾病等其他肺部疾病。
2.标本采集:入院后第1天清晨采集痰标本进行分离培养,能自主咳痰者晨起清水漱口2次后用力咳痰,咳嗽乏力及机械通气的患者用一次性吸痰管采集痰液,去除同一病例所获重复菌株。1h内送检。痰培养前先行革兰染色涂片,每低倍镜下见白细胞>25个、上皮细胞<10个,视为合格标本,可进行细菌培养。不合格标本退回,需重新留取。
3.细菌分离鉴定:采用法国生物梅里埃ATB鉴定系统进行菌株鉴定,操作过程按照《全国临床检验操作规程》进行,>103CFU/ml认为阳性。每例连续2次以上培养出同一种病原菌或同一培养皿培养出两种以上病原菌且属优势生长认作阳性结果,该病原菌株被认定为致病菌。同一患者连续2次以上痰培养结果一致,计1次阳性结果,若结果不一致按不同份计。
4.药敏试验方法:采用K-B纸片扩散法进行药敏实验,所用纸片购自英国Oxoid 公司。质控菌株为大肠杆菌ATCC25922、金黄色葡萄球菌ATCC25923、铜绿假单胞菌ATCC27853。药敏结果按照2006年临床实验室标准化研究所(CLSI)的标准判定。产超广谱β-内酰胺酶(ESBLs) 检测采用美国临床实验室标准化委员会(NCCLS)推荐的纸片扩散法进行测定初筛和确证试验。
5.统计学方法:细菌菌谱及耐药性分析应用WHONET5.6软件进行分析。
结 果
1.病原菌的分布:98例合并支气管扩张的AECOPD患者痰标本同分离出66株病原菌,阳性率为67.3%。其中革兰阴性菌占阳性总例数78.8%,共52株;革兰阳性菌占7.6%, 共5株;真菌占13.6%,共9株。最常见的5种革兰阴性菌依次为铜绿假单胞菌(27.3 %)、大肠杆菌(13.6%)、肺炎克雷伯菌(12.1%)、鲍曼不动杆菌(10.6%)、阴沟肠杆菌(7.6%)。革兰阳性球菌以金黄色葡萄球菌(4.5%)为主,真菌以白丝假酵母菌为主。64株病原菌分布及构成比情况见表1。主要革兰阴性杆菌对常见抗菌药物的耐药率见表2。主要革兰阳性杆菌对常见抗菌药物的耐药率见表3。

表1 64株病原菌的种类及构成比
讨 论
急性加重是COPD患者病程中重要的风险事件,频繁的急性加重可导致患者肺功能快速恶化,生活质量严重下降,致残率和致死率明显增加。合理有效的抗感染治疗,对于提高AECOPD患者的治疗成功率、改善患者预后非常关键[6]。近年来随着对COPD临床表型的深入研究,逐渐认识到为数不少的COPD患者在病程中可继发支气管扩张,国外的临床研究表明,50.0%~57.6%的中重度COPD患者继发支气管扩张[1~3]。与单纯COPD患者相比,COPD合并支气管扩张者发生急性加重风险大,气道内分离的致病菌增加,病死率高。因此,了解合并支气管扩张的AECOPD患者致病菌株的分布与耐药性特点,对于临床上针对这部分患者的合理用药具有重要的指导作用。
本研究回顾性分析2010年1月1日~2014年4月31日在笔者医院住院治疗的98例合并支气管扩张的AECOPD患者,共分离出64株病原菌,其中细菌感染仍是笔者医院COPD合并支气管扩张患者发生急性加重的主要诱因。目前国内外数据均表明革兰阴性杆菌在AECOPD感染中占据主要地位,是AECOPD经验性抗感染治疗要重点覆盖的菌群[7~9]。
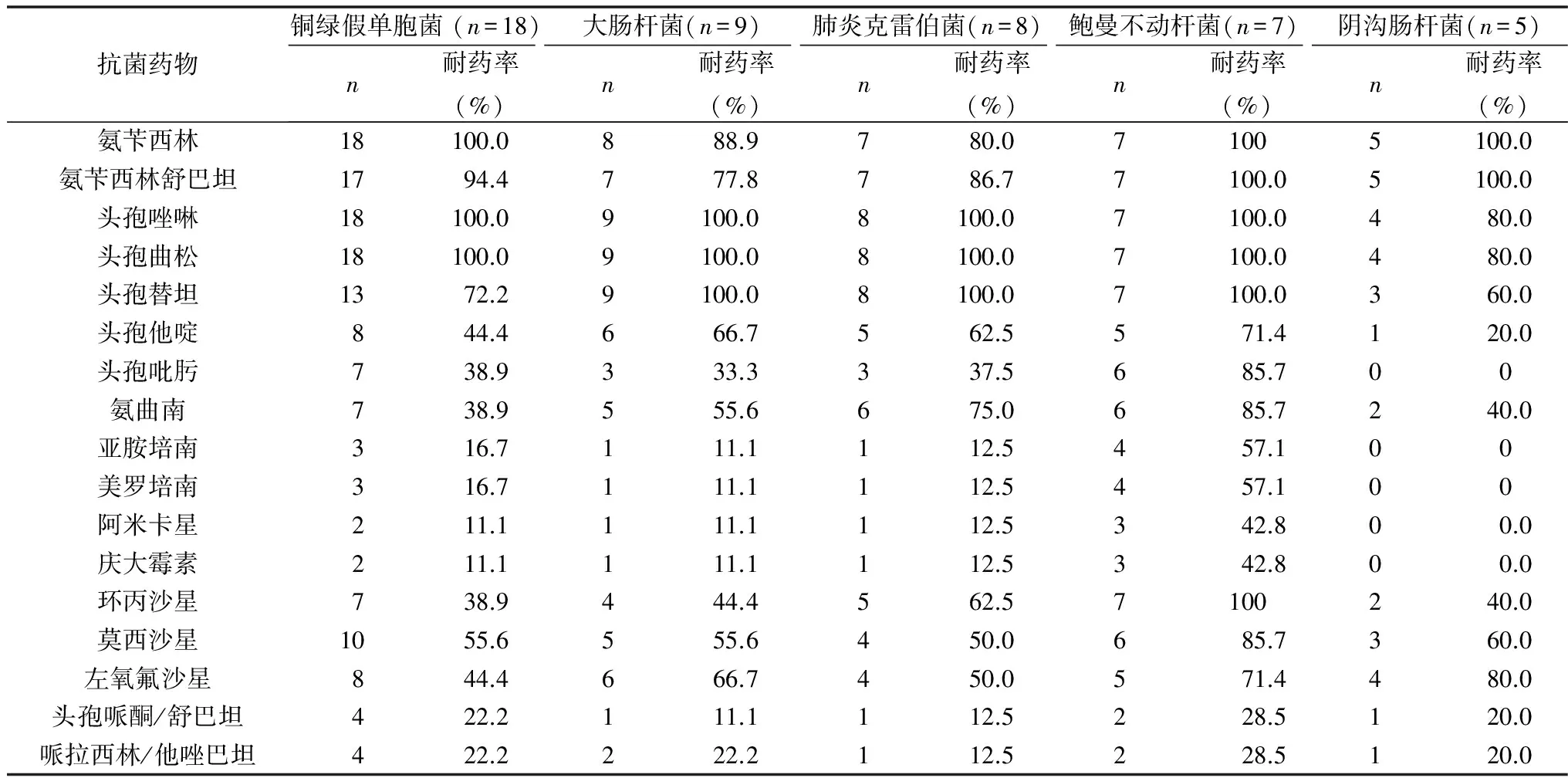
表2 主要革兰阴性杆菌对常见抗菌药物的耐药率
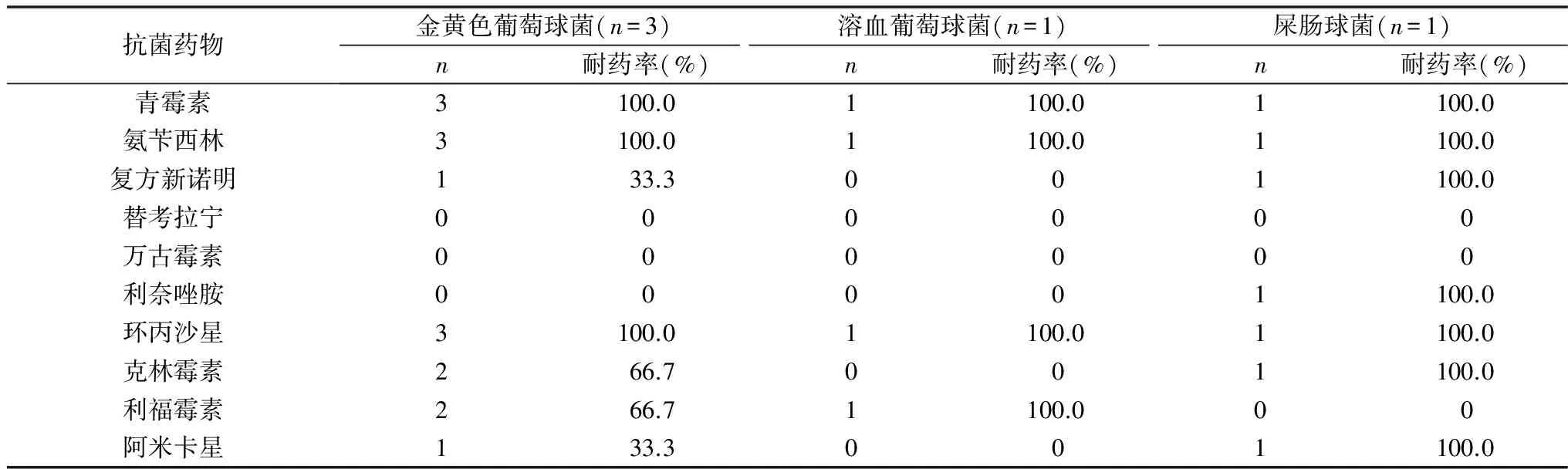
表3 主要革兰阳性球菌对常见抗生素的耐药率
本组资料COPD合并支气管扩张患者痰标本所分离的病原菌中,革兰阴性杆菌是最主要的病原菌,占总菌株数的78.8%,与上述文献报道一致。革兰阴性杆菌占主要地位可能与以下原因有关:①革兰阴性菌对气道上皮具有较强的黏附性,易于定植、侵犯呼吸道。而COPD患者年龄大、基础疾病多,加之广谱抗生素与糖皮质激素的广泛使用,导致身体免疫低下、革兰阴性菌感染增多[10];②COPD患者住院治疗后接受氧疗、气道雾化、机械通气等诊疗操作,可以增加革兰阴性杆菌的感染机会。
与普通COPD人群日益严重的细菌耐药情况类似,本组资料中合并支气管扩张的AECOPD患者药敏结果表明主要革兰阴性杆菌对氨苄西林、头孢唑林、头孢曲松、头孢替坦均高度耐药。其中铜绿假单胞菌和鲍曼不动杆菌是目前耐药情况最为严重的下呼吸道病原菌,治疗十分困难。铜绿假单胞菌的耐药机制包括主动外排、产生抗菌药物水解酶(AmpC β-内酰胺酶和金属酶等)、形成生物被膜等,这些机制可以单独或协同作用,导致细菌产生交叉耐药和多重耐药例[11, 12]。本组资料中铜绿假单胞菌对2代头孢和大多数3代头孢耐药率均超过70%,环丙沙星等喹诺酮类抗生素耐药率均>30%,而碳青霉烯类药物(亚胺培南和美罗培南)、阿米卡星、头胞哌酮舒巴坦、哌拉西林他唑巴坦的敏感度较好,耐药率低于汪俊等的报道[13]。因此,本地区针对合并支气管扩张的AECOPD患者铜绿假单胞菌感染的治疗应优先选用碳青霉烯类、阿米卡星、头孢哌酮舒巴坦、哌拉西林他唑巴坦。鲍曼不动杆菌具有强大的获得耐药性和克隆传播的能力,多重耐药、广泛耐药、全耐药鲍曼不动杆菌已成为世界性的临床治疗难题。笔者医院合并支气管扩张的AECOPD患者鲍曼不动杆菌对碳氢酶烯类、阿米卡星、庆大霉素>50%,与2012年中国CHINET监测数据相似,而对头孢哌酮舒巴坦、哌拉西林他唑巴坦耐药率<30%,低于2012年中国CHINET报道的数据[14]。因此,如临床上明确鲍曼不动杆菌为COPD合并支气管扩张的致病菌,应首选头孢哌酮舒巴坦或哌拉西林他唑巴坦。鲍曼不动杆菌耐药性极强,单一用药很容易继发耐药,多黏菌素和近年上市的替加环素对多重耐药的鲍曼不动杆菌具有较好的抗菌作用,有条件的医院可常规进行这两种药物的药敏检测。
本组资料中主要革兰阳性球菌对万古霉素和替考拉宁均敏感,对青霉素、左氧氟沙星耐药率为100%。因此目前临床上对于毒力较强、耐药性高的葡萄球菌属、肺炎链球菌、肠球菌,万古霉素仍是最有效的药物。近年来真菌感染在COPD急性加重期中有逐渐增加的趋势。本研究中COPD合并支气管扩张患者真菌分离率已高于革兰阳性球菌,占13.6%,高于文献报道的普通COPD急性加重人群中的真菌分离率[15,16]。可能与合并支气管扩张的AECOPD患者容易反复感染,频繁接受广谱抗生素及激素治疗,导致机体免疫力下降,继发二重感染有关。本研究中真菌以白假丝酵母菌最为多见,临床上应注意结合症状及前期治疗反应综合判断是否为致病菌。如果在积极抗细菌治疗效果欠佳的情况下,痰检多次阳性,需考虑真菌感染,并给予抗真菌治疗。
综上所述,笔者医院合并支气管扩张的AECOPD感染病原菌以革兰阴性杆菌为主,其中以铜绿假单胞菌最为常见,耐药现象较为普遍。由于不同地区耐药状况存在差别,应结合本地区病原学和耐药性的监测资料,指导临床合理应用抗菌药物。
1 Patel IS, Vlahos I, Wilkinson TM,etal. Bronchiectasis, exacerbation indices, and inflammation in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med,2004,170(4):400-407
2 Martínez-García MA,Soler-Cataluňa JJ,Conat Sanz Y,etal.Factors associated with bronchiectasis in patients with COPD [J]. Chest,2011, 140(5): 1130-1137
3 Martinez-Garcia MA, de la Rosa CD, Soler-Cataluna JJ,etal. Prognostic value of bronchiectasis in patients with moderate-to-severe chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med,2013,187(8):823-831
4 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版)[J]. 中华结核和呼吸杂志,2013,36(4):255-264
5 Naidich DP, Mccauley DI, Khouri NF,etal. Computed tomography of bronchiectasis[J]. J Comput Assist Tomogr,1982,6(3):437-444
6 徐平,宋卫东,刘媛媛,等. 慢性阻塞性肺疾病急性细菌性加重患者病原菌分析[J]. 中国感染与化疗杂志,2010(2):108-111
7 兰静,李秋根. 慢性阻塞性肺疾病不同时期病原体分布及其与疾病的关系[J]. 国际呼吸杂志,2013,33(11):861-864
8 岳红梅,王万淑. 慢性呼吸道疾病并发下呼吸道感染病原菌及耐药情况调查分析[J]. 中国全科医学,2012(30):3509-3512
9 陈世平,冯旰珠. 慢性阻塞性肺疾病急性加重期患者的细菌学研究及耐药分析[J]. 临床肺科杂志,2013(11):2109-2110
10 洪旭林. 慢性阻塞性肺疾病患者急性发作期的病原菌分布和耐药性分析[J]. 安徽医药,2012(7):969-971
11 蒋旭宏,王原,华军益,等. 急诊科C、D类慢性阻塞性肺疾病急性发作患者细菌分布及耐药性分析[J]. 中华急诊医学杂志,2013,22(6):626-629
12 李钊,蒋扞东. 生物膜形成对铜绿假单胞菌产不同种β-内酰胺酶的影响[J]. 中华结核和呼吸杂志,2009,32(8):613-616
13 汪俊,刘晓,兰艳丽,等. 慢性阻塞性肺疾病合并支气管扩张病原菌分布及耐药性分析[J]. 中华临床医师杂志:电子版,2013,13:6093-6096
14 汪复,朱德妹,胡付品,等. 2012年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志,2013,13(5):321-330
15 陈幕. 临床常见革兰阴性杆菌分布及耐药性分析[J]. 中华医院感染学杂志,2013,14:3515-3517
16 刘鸿翔,南勇,石斌. 慢性阻塞性肺疾病急性加重期合并呼吸衰竭患者的痰病原菌学分析[J]. 实用医学杂志,2013,8:1347-1349
(修回日期:2014-11-13)
Analysis of Pathogens Distribution and Drug Resistance in Acute Exacerbation of Coexisting Chronic Obstructive Pulmonary Disease and Bronchiectasis.
LiuPingli.
DepartmentofRespiratoryMedicine,AffiliatedHospitalofXuzhouMedicalCollege,Jiangsu221004,China
Objective To explore the distribution and antibiotic resistance of pathogenic bacteria isolated from sputum of patients with acute exacerbation of coexisting chronic obstructive pulmonary disease(COPD) and bronchiectasis, so as to guide the rational antimicrobial application in clinical practise.Methods Bacteria culture and drug susceptibility testing were performed for the sputum samples of 98 hospitalized patients with acute exacerbation of coexisting COPD and bronchiectasis from January 2010 to April 2014. Results A total of 66 strains of pathogenic bacteria were isolated in 96 patients, including 52 strains of Gram-negative bacilli(78.8%), 5 strains of Gram-positive cocci (7.6%) and 9 strains of fungi(13.6%). The five predominant Gram-negative bacterial species were P.aeruginosa(27.3%), Escherichia coli(13.6%), Klebsiella pneumonia (12.1%), Acinetobacter baumannii(10.6%), and Enterobacter cloacae(7.6%).The effective antibiotics against Gram -negative bacterial infection in patients with acute exacerbation of coexisting COPD and brochiectasis included carbapenems, cefoperazone/sulbactam, piperacillin/tazobactam and amikacin. All the S. aureus strains in this stuy were sensitive to vancomycin.Conclusion The Gram-negative bacilli are the main pathogens in acute exacerbation of coexisting COPD and brochiectasis, followed by fungi and Gram-positive bacteria. As the problem of bacterial resistance is getting worse , antibiotics should be used more rationally according to the distribution of common pathogens and drug resistance trends in the region.
Acute exacerbation; Chronic obstructive pulmonary disease; Brochiectasis; Pathogen; Drug resistance
221004 徐州医学院附属医院呼吸科
R563
A DOI 10.11969/j.issn.1673-548X.2015.10.037
2014-09-28)



